FAT10在胶质瘤发生发展和放疗抵抗中的可能作用机制
2018-05-08涂艳阳
刘 辉,闵 彬,涂艳阳
(1第四军医大学唐都医院实验外科,陕西 西安710038;2空军工程大学门诊部,陕西西安710051)
0 引言
恶性胶质瘤(malignant glioma)是严重危害人类健康的恶性肿瘤之一,是最常见的颅内原发性肿瘤,具有较强的复发性及侵袭性,临床上治愈率极低,且预后较差。因其多呈浸润性生长,外科手术很难达到真正的全切除,因此常于术后辅以放、化疗,以提高胶质瘤患者的综合治疗效果。放射治疗是有效的并被广泛采用的治疗恶性胶质瘤的方法之一,但许多临床资料却显示,放疗对胶质瘤的总体疗效不尽人意,治疗效果存在极大的个体差异,大多数使用高剂量放疗后的胶质瘤依旧复发,或者在加大照射剂量后,放疗在杀灭胶质瘤细胞的同时,也会造成周围甚至全身的正常组织或器官的损伤,从而提示我们,胶质瘤有较强的放疗抵抗性。因此,寻找胶质瘤发生发展和放疗抵抗调控中的关键信号途径和核心调控分子是对胶质瘤细胞进行分子干预的前提,对胶质瘤的临床治疗具有重要的意义。
FAT10也称为双泛素,属于泛素样调节子(ubiq⁃uitin⁃like protein,UBL)蛋白家族,在许多肿瘤组织中高水平表达,如卵巢癌、结直肠癌、肝癌等,与肿瘤的发生、发展、转移等生物学过程密切相关。研究[1]表明,FAT10会引起人结直肠癌细胞的纺锤体聚集检测点蛋白(mitotic arrest defect 2,MAD2)的功能异常而导致染色体不稳定,从而发生癌变。另外,研究[2]还发现FAT10可以受到抑癌基因p53的负调控,且通过参与细胞周期调节在肿瘤的发生发展中发挥作用。胶质瘤的发病原因同其他肿瘤一样,都是多基因、多事件积累的结果。研究细胞转导通路在胶质瘤中的过度表达或关闭已成为探索胶质瘤病因、发展、放化疗抵抗、预后的一种重要方法。许多研究[3-5]结果表明,PI3K/AKT信号通路可以调节肿瘤细胞的增殖、迁移、侵袭、凋亡、分化等特性,进而在肿瘤发生的过程中起重要作用,而这种调控活性在人脑胶质瘤的发生发展过程中同样发挥作用。GSK3β作为PI3K/Akt信号传导通路的下游蛋白,可受pAkt的抑制,从而降低了细胞周期素CyclinD1的降解。这一过程也是胶质瘤在放疗抵抗过程中的重要因素之一。
FAT10基因在肝癌的发生发展中发挥着重要作用,并且其功能是通过PI3K/Akt/GSK3β通路来实现的,而 PI3K/Akt/GSK3β/CyclinD1 通路在肿瘤放疗抵抗中又起到至关重要的作用。那么FAT10/PI3K/Akt/GSK3β/CyclinD1通路是否会影响胶质瘤发生、发展以及放疗抵抗,其具体的分子机制又是怎样的?因此,本文旨在探讨 FAT10通过调控 PI3K/Akt/GSK3β/CyclinD1通路影响胶质瘤发生发展和放疗抵抗的可能分子机制,阐明 FAT10是否对 PI3K/Akt/GSK3β/CyclinD1通路具有调节作用,并从G1/S期转变、DNA损伤反应和DNA双链断裂三个方面探索胶质瘤放疗抵抗的分子机制,从而揭示影响胶质瘤发生发展以及放疗抵抗的新的分子机制,为针对胶质瘤的治疗提供新的潜在靶点,为胶质瘤的分子治疗策略提供实验和理论依据.
1 胶质瘤
胶质瘤是中枢神经系统最常见的恶性肿瘤,占颅内肿瘤的50%~60%。其不仅增殖能力较强,易形成大块肿物,而且还具有很强的侵袭特性,能与正常脑组织混合生长,因而用手术无法将瘤组织全部清除。即使辅以放、化疗,胶质瘤的治疗效果仍然较差。据统计,胶质瘤治疗后,患者平均五年存活率为20%~30%,而胶质母细胞瘤五年存活率仅为1%[6]。因此,寻找和发现胶质瘤发生发展及放疗抵抗调控中的关键信号途径和核心调控分子是对胶质瘤细胞进行分子干预的前提,对胶质瘤的临床治疗具有
重要的意义。
2 FAT10的研究进展
2.1 FAT10简介FAT10蛋白大小 18 kDa,由 165个氨基酸组成,属于UBL家族,由两个泛素样部分融合而成,在每个组成部分中有保守的赖氨酸残基,是共价结合底物蛋白并形成多泛素的位点[7-9]。泛素⁃蛋白酶体主要负责降解细胞内的蛋白,它可根据代谢和功能的需要降解转录因子、关键酶以及细胞周期调控蛋白等。FAT10可通过其羧基末端2个甘氨酸共价结合靶蛋白而发挥泛素样修饰作用,且其可以更快速但不可逆地进行降解过程,而FAT10在这一过程中也同时被降解。在这个过程中,NUB1L(neg⁃ative regulatorof ubiquitin⁃like proteins 1)蛋白通过与FAT10非共价相互作用发挥重要作用[10]。泛素⁃蛋白酶体系统不仅具有降解蛋白的功能,还与很多生物学过程密切相关,如细胞分裂、DNA修复、自唆、信号转导及胚胎发育等过程[11],而且其对许多肿瘤,包括胶质瘤的发生发展也产生了重要影响。
2.2 FAT10在胶质瘤及其它一些肿瘤中的作用及其机制研究[12]表明,FAT10在多种肿瘤组织中高水平表达,如卵巢癌、结直肠癌、肝癌、宫颈癌等,与这些肿瘤的生物学过程密切相关。那么FAT10在肿瘤中的高表达水平的机制又是什么呢?迄今为止,FAT10的机制研究主要集中在其调节人纺锤体聚集检测点蛋白的功能方面,这个蛋白主要发挥保持有丝分裂时纺锤体完整性的作用。有研究[13]报道,FAT10的过表达可以导致人结直肠癌细胞HCT116的MAD2蛋白功能异常,使细胞有丝分裂时不发生分离而出现异常分裂,最终引起染色体的不稳定 (chromosomal in⁃stability,CIN),从而发生癌变。此外,FAT10能参与调节细胞周期,其过表达可缩短细胞的有丝分裂期,使许多细胞能逃避有丝分裂期的控制而导致染色体的不稳定。 此外,有研究[14-15]还报道 FAT10的表达可受到p53的负调控,野生型的p53与FAT10启动子区结合并抑制FAT10的表达,而突变型p53则无此功能。Liu等[16]报道了FAT10在肝癌中的一些重要作用:FAT10在肝癌细胞中可激活Akt/Gsk3β信号通路,并与细胞的增殖、侵袭及EMT密切相关,FAT10还可上调G1/S周期相关蛋白表达水平,促进细胞周期进展,进而促进肝癌发生及恶性进展。而研究者通过筛选与肝癌发生发展过程相关的一系列可能影响FAT10生物学功能的信号通路,主要包括STAT、PI3K/AKT、p38、ERK、NF⁃κB 及 JNK 等信号通路,最终通过运用通路抑制剂发现,FAT10可能通过激活AKT/Gsk3β信号通路从而参与调控肝癌的一系列生物功能。具体如下:FAT10激活AKT/Gsk3β信号通路后可上调 β⁃catenin的表达及胞核转位,β⁃catenin入核后可以调控与细胞增殖和细胞周期相关的蛋白,如CyclinD1、c⁃myc等,同时其还可以通过促进 vimentin表达和抑制 E⁃cadherin表达而诱导EMT发生。此外,FAT10还可通过激活AKT/GSK3β信号通路来调控 E⁃cadherin的上游调节蛋白,如snaill和 smad2/3 等的表达,最终导致 E⁃cadherin 的表达降低和 EMT发生[17-18]。 目前关于 FAT10在胶质瘤中作用的研究极少,而我们前期在胶质瘤患者样本中的实验结果表明,FAT10在胶质瘤中高表达,并且随着胶质瘤病理等级的升高表达也逐渐上升,与胶质瘤患者总体生存率及术后复发有密切的关系,并能作为独立判定胶质瘤患者预后的因素。因此,FAT10在胶质瘤中也像在其它一些肿瘤中一样,对胶质瘤的发生发展起着重要的作用。而其调节胶质瘤发生发展的分子机制又是什么呢?也是通过 PI3K/Akt/GSK3β信号通路?这还需在以后的研究中做进一步的证实。
3 PI3K/Akt/GSK3β 信号通路在胶质瘤中的作用
人脑胶质瘤是神经系统肿瘤中最常见的类型,占颅内肿瘤的50%~60%,不同级别的胶质瘤之间,甚至相同级别不同个体之间的预后差别甚大,这就需要我们更加深入地了解胶质瘤发生发展及其恶化过程,洞悉其产生的细胞信号传导通路,从而为治疗胶质瘤提供新的理论依据及寻找新的靶点。PI3K/AKT信号通路在人类多种肿瘤的发生发展过程中发挥重要作用:PI3K/AKT信号通路提高肿瘤细胞的生存和增殖能力,其是通过抑制细胞调亡,促进细胞周期进展而实现的。同时PI3K/AKT信号通路还可参与肿瘤的血管形成,参与肿瘤的侵袭和转移,在肿瘤的发生发展中扮演重要角色[19]。在提高肿瘤细胞的增殖能力方面,PI3K可通过AKT/mTOR通路将有丝分裂信号传递给P70S6K,进而使细胞周期素(cyclin)的表达上调,并进一步促进 G1期进展,使细胞周期加速[20-21]。 而在抑制肿瘤细胞凋亡方面,Akt是通过调控多个与细胞凋亡相关的家族蛋白来实现的。PI3K/Akt信号通路激活后,前凋亡蛋白 BAD及caspase9的活性因被磷酸化而受到抑制,且细胞色素c的释放也同样受到了抑制,继而线粒体能保持完整,从而细胞凋亡受到抑制[22-24]。 在促进肿瘤侵袭方面,PI3K/Akt通路激活后,基质金属蛋白酶2(matrix metalloproteinase 2,MMP2)在 mRNA 和蛋白质水平都发生了显著的上调,进而诱导刺激了癌细胞的侵袭。而PI3K/Akt/GSK3β信号通路在人脑胶质瘤的发生发展过程中是否也起到同样的作用?下面,我们就PI3K/Akt/GSK3β信号传导通路中的关键分子或者蛋白的生物学结构及生物学功能进行分析。
PI3K,磷脂酞肌醇3⁃激酶,是一类特异性磷酸化肌醇磷脂3位羟基的激酶,称为PI3Ks家族,同多种癌基因如v⁃src和v⁃ras等的产物密切相关。其活化可以通过接受如PDGF、IGF、bFGF等生长因子刺激或着通过Ras同p110直接结合。一般来说,PI3K可以通过两种方式激活:第一是二聚体构象改变而被激活,这是PI3K通过与具有磷酸化酪氨酸残基的生长因子受体或者连接蛋白相互作用来实现的;第二,PI3K可通过与 p110、Ras直接结合而活化[25]。 在PI3K被激活后,质膜上会产生PIP2和PIP3等第二信使,并同细胞内其它含有PH结构域的信号蛋白Akt和 PDK1(phosphoinositide⁃dependent kinase⁃1)结合,从而促使 Akt的活化。 Bad、Caspase9、NF⁃κB、GSK3等均为活化后Akt的下游靶蛋白,活化后的Akt即pAkt通过磷酸化作用激活或者抑制这些靶蛋白,进一步调节细胞的增殖、迁移、凋亡和分化。
在PI3K/AKT信号通路中,Akt是关键蛋白,处于通路的中心环节,同PKA、PKC相关的蛋白激酶因高度同源,一起被称为PKB(protein kinase B)。在胶质瘤的发生过程中,Akt功能的活化也是其中一个重要的不可忽视的因素:pAkt主要作用于PI3K/Akt抗凋亡通路,激活后的Akt通过磷酸化其下游的靶蛋白,如GSK3β蛋白等,发挥抗凋亡的作用。除此之外,Akt还能通过很多途径影响细胞的生长与凋亡:首先,其可直接作用于细胞周期,通过传递生存信号以抑制细胞的凋亡;其次,pAkt还能通过对p53和NF⁃κB的间接作用而影响细胞存活;再次,pAkt还能通过磷酸化作用于转录因子Forkhead家族的成员FKHR,通过抑制FKHR的基因靶点——FAS和BIM配体的激活,以及FKHR的核转位而抑制凋亡;同时,pAkt能通过磷酸化蛋白水解酶Caspase⁃9和Bcl⁃2家族成员BAD来抑制细胞的凋亡;最后,pAkt可以升高CyclinD的mRNA和蛋白水平,推动细胞周期的进行,而且这种上调作用无需生长因子的维持。Akt的这些功能都暗示着其与胶质瘤的发生发展及放疗抵抗之间可能存在着密切联系,其可能在FAT10作用胶质瘤的过程中发挥关键作用。
多数文献也肯定了pAkt在PI3K/Akt信号传导通路中的关键作用,甚至有报道,在胶质瘤的预后中,pAkt的含量是仅次于手术切除率的第二大影响因素[26]。但是有关Akt作为胶质瘤治疗靶点的问题则存在一定的争议。有文献[27]报道,在恶性程度高的胶质瘤中,pAkt抑制剂可以抑制肿瘤的发展,而Akt的抑制剂则没有这种作用。但另有报道[28]指出,在胶质母细胞瘤中,Akt及pAkt的表达均有一定程度的提高,并肯定了两者在恶性胶质瘤中的靶向治疗效果。
综上所述,pAkt是Akt的活性形式,用以体现其生物学功能,在调控细胞周期,影响细胞的侵袭性和凋亡、血管生成和端粒酶活性等诸多方面发挥作用(图1)。总体来讲,pAkt可以促进细胞增殖,抑制细胞凋亡,所以pAkt在正常脑组织中是低表达(相对于胶质瘤)的,而在胶质瘤细胞中表达量升高,并与正常脑组织中的表达量差异显著。所以,pAkt在胶质瘤的发生发展及放疗抵抗中可能有着十分重要的作用。

图1 Akt可能参与的信号通路对细胞的调节作用
在PIK3/Akt信号转导通路中,GSK3是pAkt的下游靶蛋白,有关GSK3的功能研究是最近的研究热点。GSK3本身有抑制凋亡,促进生长的作用。那么在PI3K/AKT信号传导通路中,它又是以怎样的形式参与,发挥怎样的生物学作用呢?
近年来,有关GSK3功能的研究逐渐成为肿瘤研究中的热点,研究[29]证明,GSK3作为一种多功能激酶,在细胞增殖、细胞运动、细胞分化、蛋白合成、肿瘤发生发展等方而都扮演了重要角色,在多种肿瘤组织中均高表达。GSK3在哺乳动物中包括两个亚基,即GSK3α和GSK3β。GSK3β活性调节异常与人类多种疾病如糖尿病、肿瘤、神经退行性疾病、情感障碍和炎症等密切相关,已经证明在肿瘤形成中GSK3β发挥了重要作用,目前至少发现 Wnt、NF⁃κB和 PI3K/Akt三条与肿瘤密切相关的转导通路与GSK3β联系密切[30-31]。 已有实验[32]证实,GSK3β 蛋白在正常脑组织和胶质瘤中均有表达,主要位于细胞质中,为棕黄色细颗粒状,在正常脑组织中呈高表达,在胶质瘤组织中相对低表达(P<0.01);将 41例胶质瘤分成WHOⅠ、Ⅱ、Ⅲ、Ⅳ级,GSK3β的表达水平随着肿瘤级别升高而逐渐降低,各组均存在显著性差异(P<0.01);GSK3β在胶质瘤组织中的表达与患者的性别、年龄无关;且在正常脑组织中高表达;随着胶质瘤恶性程度的增加,表达水平在逐渐降低,该结果提示GSK3β可能具有抑癌作用,增加GSK3β活性可减少胶质瘤细胞的增殖,GSK3β有望成为治疗胶质瘤的一个新靶点。这些都提示我们,GSK3β也可能是FAT10通过PI3K/Akt/GSK3β信号通路调控胶质瘤过程中的一个重要靶蛋白,证实这一作用也是我们要解决的关键问题。
4 细胞周期素在胶质瘤放疗抵抗中的作用
肿瘤的放疗敏感性是多基因参与、多步骤、多阶段的调控结果。细胞周期在放疗后发生的最主要的变化是G1/S期的延迟和G2/M期的阻滞。而细胞在细胞周期的各阶段对放射的敏感性差异很大,G0期对放射抗拒,S期不敏感,G1期次之,最敏感的是G2期。肿瘤发生中最常改变的共同通路是以Cyc⁃lins/CDKs/CKI/pRb 为核心的 G1/S 期细胞周期网络调控系统[33-34]。关于细胞周期调控机制的研究结果表明,促进细胞增殖、启动细胞周期的主要的调控点在G1期,细胞在外界生长因子的刺激下一旦越过G1/S期这个限制点,细胞周期的推进就变得不可逆转,即自动很快完成分裂过程而不再受外界信息刺激的调控[35]。
作为PI3K/Akt/GSK3β通路下游的一个与细胞放疗抵抗密切相关的蛋白,细胞周期素CyclinD1,对细胞周期的G1期调控发挥重要的作用。它可以与Cdk4结合,介导Rb的磷酸化以释放E2F转录因子,使其不再抑制细胞的生长而促使细胞进入S期,是细胞周期中期向S期转化的重要调节因子,也是G1/S期行进的控制点,对于细胞周期的行进必不可少。过表达CyclinD1可以促使CVS期转换时间缩短,且引发细胞G1/S期调控检测点失调,进而加速细胞周期的进程,引发细胞不可逆的异常增殖,从而致使细胞增殖和凋亡的紊乱失控。CyclinD1在细胞周期调控因子中与细胞增殖的关系最为密切[36],通过相应的细胞周期素依赖性蛋白激酶(cyclin dependent kina⁃ses,CDK)在细胞的分裂增殖中发挥着重要的生物学作用,它还是调节细胞周期行进的重要正性调节因子,参与细胞周期调控,在某种程度上反映细胞的增殖活性和放疗抵抗性,是连接外界生长因子、信号传导与细胞周期调控机制的纽带,被认为是一种在分子医学研究中非常有用的生物学指标[37-38]。而胶质瘤的放疗抵抗是否也与CyclinD1的过表达密切相关?FAT10 是否通过 PI3K/Akt/GSK3β 信号通路调控CyclinD1的表达而进一步调控胶质瘤的放疗抵抗性?还都需要实验进一步证实。
5 结语
在人脑胶质瘤中,FAT10基因可能是一个重要的癌基因,其在胶质瘤中高表达,可能与胶质瘤的发生、发展有着密切的联系。而其可通过直接引起PI3K/Akt/GSK3β/CyclinD1信号通路的激活使胶质瘤产生放疗抵抗。而PI3K/Akt信号传导通路是公认的与细胞增殖、分化、凋亡等的调节有密切关系的信号传导通路之一,在人脑胶质瘤中可以观察到此信号传导通路的过度激活及表达,这种过度激活可以通过其关键蛋白的表达量来体现。在此信号传导通路中,关键蛋白为Akt,Akt磷酸化后可成为其活性形式pAkt,从而体现其生物功能,发挥抑制凋亡,促进生长的作用。其在正常脑组织中是低表达的,而在胶质瘤细胞中表达量升高,并与正常脑组织中的表达量差异显著。另外,在PI3K/Akt信号传导通路的下游,pAkt的一个靶蛋白,GSK3β也是目前研究的热点。GSK3β主要参与信号传导通路,可以抑制细胞蛋白合成的过程,或者通过调节转录因子促进凋亡,是一种决定细胞命运的关键物质。与Akt不同的是,GSK3β是为数不多的通过磷酸化而失活的蛋白激酶之一,PI3K/Akt信号传导通路中的Akt、PKA、PKC等激酶均可以通过磷酸化Ser9来抑制GSK3β的活性。也就是说,GSK3β本身可以促进细胞的凋亡,但若 Akt通过Ser9位置的磷酸化GSK3β成为pGSK3β后,GSK3β的活性是下降的,故pGSK3β增多可以抑制细胞的凋亡,也可以说是参与了肿瘤的发生、发展过程。
另有研究[39]表明,肿瘤细胞放疗抵抗性的获得是通过改变DNA损伤反应(DNA damage response,DDR)或者加强肿瘤细胞的DNA损伤修复来实现的。在放疗后,一系列的DDR开始发挥作用,且细胞周期检验点也被激活来阻止细胞进行DNA损伤修复的过程。G1/S检验点通过抑制细胞周期素依赖性蛋白酶来启动,其与 CDKs结合来调控细胞周期,比如,CyclinD1可以与Cdk4结合,结合后的复合物通过激活Rb,继而释放E2F来调控G1/S转变进程。当细胞受到发射刺激,产生DNA损伤时,PI3K介导Akt转位至细胞质膜并激活Akt,激活的Akt又可通过抑制GSK3β来减少Cyclin D1的降解,而CyclinD1的过表达又进一步加剧了DNA损伤程度,形成了一个CyclinD1过表达与放疗抵抗之间的反馈调节(图2)。
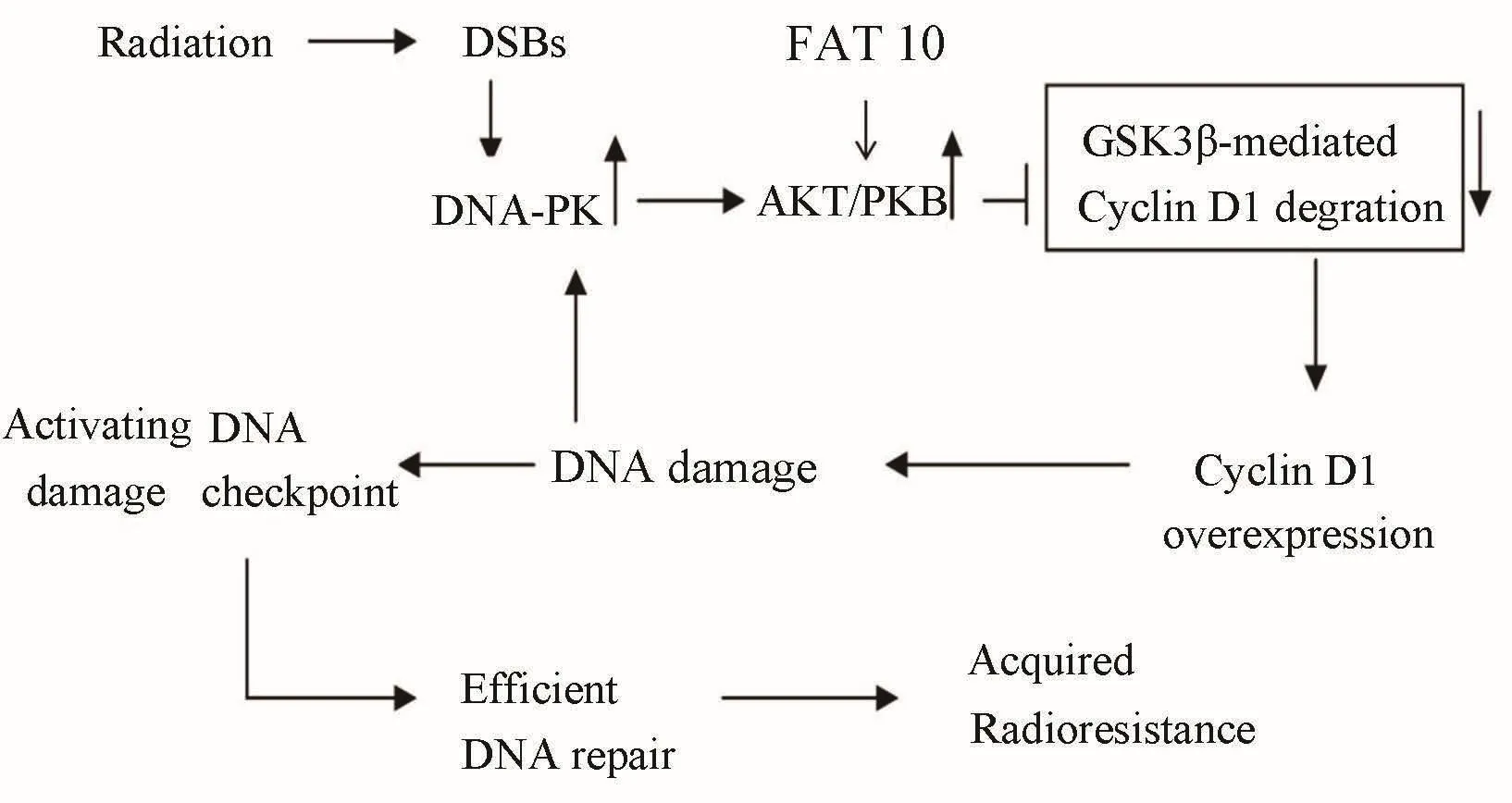
图 2 FAT10/PI3K/Akt/GSK3β/CyclinD1 通路在放疗抵抗中可能作用机制
我们前期的研究结果已表明,在胶质瘤中,FAT10高表达,且在体内外对胶质瘤的发生发展起着至关重要的作用,而 PI3K/Akt/GSK3β/CyclinD1 通路也是胶质瘤中重要的一条信号通路,这两者之间是否存在着紧密联系?FAT10是否是通过这条信号通路在胶质瘤发生发展甚至放疗抵抗中发挥作用?其调节这条信号通路的机制是什么?在胶质瘤产生放疗抵抗时,是否也存在一个DNA损伤与FAT10高表达之间的反馈调节?这些都还是需要研究者证实的问题。
本文旨在探讨 FAT10通过调控 PI3K/Akt/GSK3β/CyclinD1通路影响胶质瘤发生、发展及放疗抵抗的分子机制,以期揭示影响胶质瘤发生的新的分子机制,为针对胶质瘤的治疗提供新的潜在靶点,为胶质瘤的分子治疗策略提供实验和理论依据。
【参考文献】
[1] Theng SS,Wang W,Mah WC,et al.Disruption of FAT10⁃MAD2 binding inhibits tumor progression[J].Proc Nati Acad Sci USA,2014,111(49):E5282.
[2] Li T,Jantockyte R,Yu S,et al.FAT10 modifies p53 and upregu⁃lates its transcriptional activity[J].Arch Biochem Biophys,2011,509(2):164-169.
[3] Knobbc CB,Trampe⁃Kieslich AT,Reifenberger G.Genetic altera⁃tion and expression of the phosphoinositol⁃3⁃kinase/Akt pathway genes Pik3CA and PIKE in human glioblastomas[J].Neuropathol Appl,2005,31(5):486-490.
[4] Edwards LA,Thiessen B,Dragowska WH,et al.Inhibition of Ilk IN PTEN⁃mutant human glioblastomas inhibits PKB/Akt activation,in⁃duces apoptosis and delays tumor growth [J].Oncogene,2005,24(22):3596-3605.
[5] Wu YL,Maachani UB,Schweitzer M,et al.Dual inhibition of PI3K /AKT and MEK /ERK pathways induces synergistic antitumor effects in diffuse intrinsic pontine glioma cells[J].Transl Oncol,2017,10(2):221-228.
[6] Staedtke V,Bai RY,Laterra J.Investigational new drugs for brain cancer[J].Expert opin Investig Drugs,2016,25(8):937-956.
[7] Canaan A,Yu X,Booth CJ,et al.FAT10/diubiquitin⁃like protein⁃deficient mice exhibit minimal phenotypic differences[J].Mol Cell Biol,2006,26(13):5180-5189.
[8] Aichem A,Groettrup M.The ubiquitin⁃like modifier FAT10 in canc⁃er development[J].Int J Biochem Cell Biol,2016,79:451-461.
[9] Schmidtke G,Kalveram B,Weber E,et al.The UBA domains of NUB1L are required for binding but not for accelerated degradation of the ubiquitin⁃like modifier FAT10[J].J Biol Chem,2006,281(29):20045-20054.
[10] Lee CG,Ren J,Cheong IS,et al.Expression of the FAT10 gene is highly upregulated in hepatocellular carcinoma and other gastrointes⁃tinal and gynecological cancers[J].Oncogene,2003,22(17):2592-2603.
[11] Wang J,Cai S,Chen Y.Mechanism of E1⁃E2 interaction for the inhibition of UBL adenylation[J].J Biol Chem,2010,285(43):33457-33462.
[12] Ji F,Jin X,Jiao CH,et al.FAT10 level in human gastric cancer and its relation with mutant p53 level,lymph node metastasis and TNM staging[J].World J Gastroenterol,2009,15(18):2228-2233.
[13] Ren J,Wang Y,Gao Y,et al.FAT10 mediates the effect of TNF⁃α in inducing chromosomal instability[J].J Cell Sci,2011,124(Pt21):3665-3675.
[14] Zhang DW,Jeang KT,Lee CG.P53 negatively regulates the expres⁃sion of FAT10,a gene upregulated in various cancers[J].Onco⁃gene,2006,25(16):2318-2327.
[15] Lukasiak S,Schiller C,Oehlschlaeger P,et al.Proinflammatory cytokines cause FAT10 upregulation in cancers of liver and colon[J].Oncogene,2008,27(46):6068-6074.
[16] Liu L,Dong Z,Liang J,et al.As an independent prognostic factor,FAT10 promotes hepatitis B virus⁃related hepatocellular carcinoma progression via Akt/GSK3β pathway[J].Oncogene,2014,33(7):909-920.
[17] Hutchinson JN,Jin J,Cardiff RD,et al.Activation of Akt⁃1(PKB-alpha) can accelerate ErbB⁃2⁃mediated mammary tumorigenesis but suppresses tumor invasion[J].Cancer Res,2004,64(9):3171-3178.
[18] Cheng JC,Auersperg N,Leung PC.Inhibition of p53 induces inva⁃sion of serous borderline ovarian tumor cells by accentuating PI3K/Akt⁃mediated suppression of E⁃cadherin [ J].Oncogene,2011,30(9):1020-1031.
[19] Riggio M,Polo ML,Blaustein M,et al.PI3K/AKT pathway regu⁃lates phosphorylation of steroid receptors,hormone independence and tumor differentiation in breast cancer[J].Carcinogenesis,2012,33(3):509-518.
[20] Bakirtzi K,hatziapostolou M,Karagiannides I,et al.Neurotensin signaling activates microRNAs⁃21 and ⁃155 and Akt,promotes tumor growth in mice,and is increased in human colon tumors[J].Gastro⁃enterology,2011,141(5):1749-1761.
[21] Shimura T,Kakuda S,Ochiai Y,et al.Acquired radioresistance of human tumor cells by DNA⁃PK/AKT/GSK3β⁃mediated cyclinD1 overexpression[J].Oncogene,2010,29(34):4826-4837.
[22] Pez F,Dayan F,Durivault J,et al.The HIF⁃1⁃inducible lysyl oxidase activates HIF⁃1 via the Akt pathway in a positive regulation loop and synergizes with HIF⁃1 in promoting tumor cell growth[J].Cancer Res,2011,71(5):1647-1657.
[23] Kannaiyan R,Manu KA,Chen L,et al.Celastrol inhibits tumor cell proliferation and promotes apoptosis through the activation of c⁃Jun N⁃terminal kinase and suppression of PI3K/Akt signaling pathways[J].Apoptosis,2011,16(10):1028-1041.
[24] Dey JH,Bianchi F,Voshol J,et al.Targeting fibroblast growth factor receptors blocks PI3K/AKT signaling,induces apoptosis,and impairs mammary tumor outgrowth and metastasis[J].Cancer Res,2010,70(10):4151-4162.
[25] Majewska E,Szeliga M.AKT/GSK3β signaling in glioblastoma[J].Neurochem Res,2017,42(3):918-924.
[26] Chen G,Yue Y,Qin J,et al.Plumbagin suppresses the migration and invasion of glioma cells via downregulation of MMP⁃2/9 expres⁃sion and inaction of PI3K/Akt signaling pathway in vitro[J].J Phar⁃macol Sci,2017,134(1):59-67.
[27] Salphati L,Alicke B,Heffron TP,et al.Brain distribution and effi⁃cacy of the brain penetrant PI3K inhibitor GDC⁃0084 in orthotopic mouse models of human glioblastoma[J].Drug Metab Dispos,2016,44(12):1881-1889.
[28] Schultz CR,Golembieski WA,King DA,et al.Inhibition of HSP27 alone or in combination with pAKT inhibition as therapeutic approa⁃ches to target SPARC⁃induced glioma cell survival[J].Mol Cancer,2012,11:20.
[29] To C,Roy A,Chan E,et al.Synthetic triterpenoids inhibit GSK3β activity and localization and affect focal adhesions and cell migration[J].Biochim Biophys Acta,2017,1864(7):1274-1284.
[30] Chen YG,Li Z,Wang XF.Where PI3K/Akt meets Smads:the crosstalk determines human embryonic stem cell fate[J].Cell Stem Cell,2012,10(3):231-232.
[31] Zhou W,Wang L,Gou SM,et al.ShRNA silencing glycogen syn⁃thase kinase⁃3 beta inhibits tumor growth and angiogenesis in pancre⁃atic cancer[J].Cancer Lett,2012,316(2):178-186.
[32]孙异春.GSK⁃3β在胶质瘤细胞中的表达初步研究[D].广州:广州医学院,2010.
[33]叶元胜,詹仁雅,童 鹰.Cyclin D1在颅脑胶质瘤中表达及细胞周期表达模式的研究[J].浙江临床医学,2005,7(9):899-900.
[34]涂艳阳,祁 婧,张永生.胶质瘤中分子标记物的应用进展[J].转化医学电子杂志,2016,3(7):1-5.
[35] Wenzel ES,Singh ATK.Cell⁃cycle checkpoints and Anenploidy on the path to cancer[J].In Vivo,2018,32(1):1-5.
[36] Casimiro MC,Di Sante G,Di Rocco A,et al.Cyclin D1 restrains oncogene⁃induced autophagy by regulating the AMPK⁃LKB1 signa⁃ling axis[J].Cancer Res,2017,77(13):3391-3405.
[37]官 娟,占昌友.脑胶质瘤诊断的分子遗传学研究进展[J].转化医学电子杂志,2017,4(7):7-10.
[38] Lubanska D,Porter L.Revisiting CDK inhibitors for treatment of glioblastoma multiforme[J].Drugs R D,2017,17(2):255-263.
[39] Yang SF,Chang CW,Wei RJ,et al.Involvement of DNA damage response pathways in hepotocellular carcinoma[J].Biomed Res Int,2014,2014:153867.
