甲状腺癌标志物的研究进展
2018-05-08张凯华杨家慧张慧珊李金泽
李 贺,张凯华,杨家慧,张慧珊,张 明,李金泽,刘 伟
(河北医科大学基础医学院免疫教研室,河北石家庄050017)
0 引言
甲状腺癌是常见的头颈部恶性肿瘤,占全身恶性肿瘤的1.0%~1.5%,且近年的发病率逐步升高。最初临床表现为无痛性的甲状腺结节,而一般良、恶性结节的症状和体征无明显区别,极易误诊。虽然通过临床触诊、超声、核素显像及细针穿刺细胞活检等方法综合评价,在一定程度上可以提高诊断的准确性,但能否早期确诊从而使患者进行早期治疗并估计预后仍是目前存在的主要问题。本文将标志物归为三类:蛋白质类、基因类、其他,并对最新研究的几种甲状腺癌标志物进行阐述,旨在为甲状腺癌的术前判断和预后治疗提供一定依据,并为靶向治疗的发展提供方向。
1 蛋白质类甲状腺癌标志物

表1 甲状腺功能的生物标记物之间的关系和自身免疫甲状腺癌的风险[2]
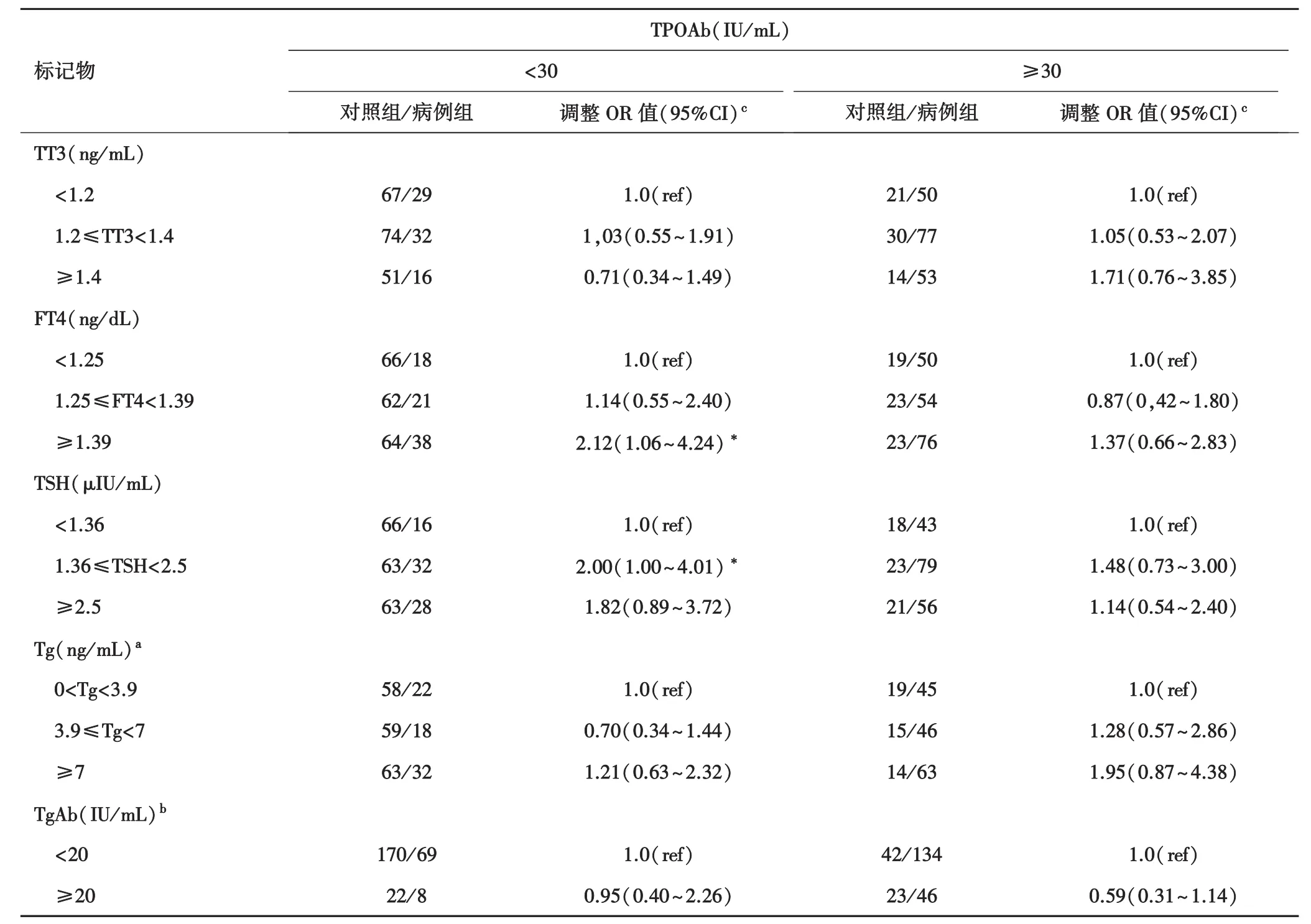
表2 甲状腺功能之间的关系/自身免疫生物标记和甲状腺癌的风险,存在TPOAb分层[2]
1.2 端粒酶与端粒酶反转录酶端粒酶(telomer⁃ase)是能以自身RNA为模板,催化延长端粒末端的核糖核蛋白从而维持细胞分裂时染色体稳定性的一种反转录酶,其激活、表达与细胞的无限增殖密切相关。 朱国献等[3]采用 TRAP(telomefic repeat amplica⁃tion protocal)法检测了73例不同类型甲状腺组织的端粒酶活性,发现良恶性组织的端粒酶活性率差异有统计学意义(P<0.05)。端粒酶是鉴别甲状腺肿瘤良恶性的理想标记物,尤其是对于鉴别滤泡性腺瘤(follicular adenoma,FA)和甲状腺滤泡癌(follicular carcinoma of thyroid,FTC)。 Khorobrykh 等[4]对甲状腺结节进行术前细针穿刺细胞学检查(fine⁃needle aspiration biopsy,FNAB)来检测端粒酶活性,亦发现在恶性甲状腺组织标本中端粒酶活性显著增高,故认为对甲状腺组织进行术前FNAB来检测端粒酶活性是提高甲状腺结节术前诊断准确率的有效手段。但Nagasaka等[5]在体外实验中发现甲状腺球蛋白(thyroglobulin,HTG)呈浓度依赖性地抑制端粒酶的活性,认为甲状腺活检标本中甲状腺滤泡细胞中的HTG可能会影响端粒酶活性的检测,而由HTG引起的端粒酶活性减少可能减慢肿瘤细胞(tumor cell,TC)尤其是高分化的TC的进展,降低其恶性程度。因此,在检测活检组织中端粒酶活性鉴别甲状腺组织良恶性及评估预后时,需注意有无影响端粒酶活性的因素存在,对于TC患者的HTG水平是否应严格控制,体内HTG水平对于端粒酶活性及肿瘤预后的影响则需更进一步的探索。端粒酶反转录酶(human telomerase reverse tran⁃scfiptase,hTERT)是端粒酶的活性催化亚单位,激活hTERT可导致端粒酶的活化,进而使得肿瘤细胞可以长期生存。资料[6]表明hTERT相关蛋白的激活是TC重要的易感因素,Ito等利用免疫组化研究了166例甲状腺肿瘤组织的hTERT表达,发现FTC高表达HTERT的百分比(39.2%)明显高于 FA(9.8%),故 Ito 等认为检测hTERT的表达有助于FTC与FA的鉴别诊断,其特异性和阳性预测值分别高达90.2%和83.3%,但其灵敏度和阴性预测值则较低,且hTERT的检测是否适用于术前诊断的细针穿刺活检标本尚不清楚。此外,Capezzone等[7]研究发现家族性 PTC患者比散发性PTC患者 hTERT mRNA的表达显著增加(P<0.0001),特别是在家族的后代,这说明存在 hTERT扩增的患者更需警惕家族遗传倾向。
1.3 基质金属蛋白酶(matrix metalloproteinases,MMP)MMP是蛋白水解酶,在恶性肿瘤的侵袭和转移中扮演着重要角色。根据作用底物的不同,MMP可分为胶原酶、明胶酶、基质溶解酶、膜型MMP(MT⁃MMP)和其他基质金属蛋白酶类。Mizrachi等[8]通过回顾性病例研究发现基质金属蛋白酶1(MMP⁃1)在侵袭性高分化型甲状腺癌(well differentiated thyroid carcinoma,WDTC)的表达与喉入侵、肿瘤多灶性、局部及远处转移均有相关性,可作为WDTC的一个预后和是否需要更积极手术治疗的指标。Cavalheiro等[8]通过免疫组化染色发现基质金属蛋白酶 2(MMP⁃2)、基质金属蛋白酶9(MMP⁃9)在转移性甲状腺肿瘤细胞(thyroid tumor cell,PTC)较无远处转移的PTC中有过度表达,表明其可作为PTC远处转移诊断的标志。国内文献[10]亦有类似报道 MTI⁃MMP是一个与肿瘤患者的预后效果有关的酶,Cavalheiro等对原发甲状腺髓样癌(medullary thyroid carcinoma,MTC)肿瘤组织进行MT1⁃MMP的免疫组化染色,结果发现染色细胞的比例及染色强度与患者首次手术后治愈生存率存在关联,据此得出MT1⁃MMP在原发MTC标本的免疫染色对于MTC患者预后的预测是一个新的补充指标。
1.4 Ki⁃67Ki⁃67 是人类增殖细胞核中普遍存在的标记性抗原,被广泛用作判断肿瘤细胞增殖活性的指标。Pujani等[11]对100例甲状腺肿瘤进行研究,评估Ki⁃67在甲状腺良恶性肿瘤,尤其是FA与FTC鉴别中的作用。结果显示Ki⁃67标记指数(labeling index,LI)从良性甲状腺结节到恶性甲状腺肿瘤呈逐渐上升趋势,且 Ki⁃67 LI在结节性甲状腺肿瘤与PTC、FA与FTC之间,差异有统计学意义。提示Ki⁃67在区分甲状腺良恶性肿瘤尤其是鉴别FA与FTC中具有参考价值。Ito等[6]对371例PTC进行免疫组化染色,评价Ki⁃67 LI与PTC生物学行为间的关系,研究发现Ki⁃67 LI与PTC患者的年龄、甲状腺外侵犯及远处转移相关,且与LI低的患者相比,LI高的患者无病生存率(disease⁃free survival rate,DFS)及病因特异性生存率(etiological specific survival rate,CSS)均降低,故认为评估Ki⁃67在原发灶的LI可以预测PTC患者的DFS和CSS。Sofiadis等[12]也认为术前FNAB结合评估Ki⁃67 LI能够提高传统的甲状腺结节的细胞学分析诊断准确率,并有助于TC的预后信息评估。因此,作为一种增殖相关标记物,Ki⁃67在鉴别甲状腺良恶性肿瘤中有较高的价值,有利于提高临床甲状腺结节诊断的准确率;而在TC尤其是PTC的预后评估中Ki⁃67亦具有预测价值,对于免疫组化结果提示Ki⁃67 LI较高的甲状腺肿瘤患者,其发生外侵犯及远处转移的风险指数更高,更容易进展,预后也更差。但也有学者提出虽然Ki⁃67在甲状腺恶性肿瘤中增殖活性升高,但升高幅度不显著,在实际使用中尚存在一定局限性[9,11]。
2 基因检测标志物
2.1 CD147CD147为细胞外基质金属酶诱导因子(extracellular matrix metalloproteinase inducer,EMM⁃PRIN),在肿瘤进展、侵袭和转移中也发挥至关重要的作用。Aratake等[14]应用免疫组化染色测定了CD147在不同分化程度的细针穿刺PTC标本中的表达谱,结果表明,随着肿瘤形态从分化良好PTC至未分化PTC的变换,CD147表达强度逐渐增强。故认为CD147的表达与TC的分化程度显著相关,可作为评估TC分化的一个新标准,也证实使用细针穿刺标本测定CD147表达的可行性。同时国内学者亦研究[10]发现CD147在肿瘤包膜不完整的PTC中的免疫组化表达水平明显高于包膜完整者,在有淋巴结转移患者中表达水平明显高于无淋巴结转移者(P<0.05)。可见,MMP及其诱导因子指标的检测在辅助TC的诊断、判断有无远处转移、手术评估及预后评估方面均有较高的应用价值。尤其对于存在隐匿淋巴结转移(即临床未触及肿大淋巴结)的PTC类型,在术前FNAB 联合检测 MMP⁃1、MMP⁃2、MMP⁃9 及 CD147 的表达,可在术前预测肿瘤转移浸润情况,为临床手术术式的选择及术后的进一步治疗提供依据。
2.2 CD15和HBME⁃1PTC是最常见的甲状腺癌变。在一般类型甲状腺癌患者中,对乳头状癌的细胞学检测并不困难,细针吸出术是一种有效的术前检测手段。然而在区分乳头状甲状腺癌的滤泡变异体时,由于与其他滤泡损害的相似性和典型中心特征的不完全性,这种特征通常并不有效。因此,我们调查了在乳头状甲状腺癌细胞变异体的细胞样本中乳头状癌标记物的免疫组化表达,并分析了它们的效用[15]。通过对来自甲状腺乳头癌的50个细胞样本进行切片免疫学分析检查,得到HBME⁃1和CD15的免疫反应性,包括13例变异乳头状甲状腺癌(follicular variant of papillary thyroid carcinoma,FVPTC)。乳头状甲状腺癌细胞变异体HBME⁃1的敏感性和特异性是92和89,它们各自的CD15表达分别为23和100。总而言之,HBME⁃1在细胞学样本中是乳头状癌的一个敏感性标记,包括普通类型和乳头状癌细胞变异体两种类型[13]。 因 此,在 细 针 抽 吸 ( fine⁃needle aspiration,FNA)细胞学中使用HBME⁃1的免疫细胞化学会导致FVPTC的假阴性诊断率的下降。尽管在敏感性方面CD15对于诊断乳头状癌细胞变异体不是那么准确,但它在甲状腺癌变的定义性诊断方面将会提供很好的准确度,包括检测过HBME⁃1后对于乳头状癌细胞的诊断作用[15-16]。
相关企业运用场景完成商务拓展并找到连接点,形成互补的跨界品牌,带动新的用户群,而跨界的深度则很大程度影响着新用户量,也成为创新品牌定价的关键。
2.3 TRβ研究[17]显示,几种类型的人类癌症和体细胞突变的甲状腺激素受体β(thyroid hormone receptor β,TRβ)之间有密切联系,TRβ 表达减少是由于THRB基因的表观遗传失活和/或删除。这些观察表明,TRβ可能有肿瘤抑制作用。然而,TRβ可以抑制肿瘤发生的机制尚不清楚。我们使用了人类甲状腺滤泡癌细胞(ftc⁃133 和 ftc⁃236 细胞)来阐明THRB基因的功能表达如何影响肿瘤发生。研究中使THRB基因在FTC细胞中稳定表达,并且评估TRβ对癌症细胞增殖、迁移,细胞研究和异种移植肿瘤的生长模型的影响。FTC⁃133细胞表达了TRβ,与没有TRβ的控制细胞 FTC相比,通过抑制 AKT⁃mTOR⁃p70 S6K途径可以减少癌症细胞增殖和阻碍肿瘤细胞的迁移。ftc⁃133和 ftc⁃236细胞中表达的TRβ导致异种移植模型中肿瘤生长减少。重要的是,与没有TRβ的FTC细胞相比,TRβ的FTC肿瘤细胞中新血管形成被显著抑制。血管形成的减少是由于在FTC细胞表达TRβ从而使血管内皮生长因子下调。这些发现表明TRβ作为肿瘤抑制基因通过在FTC细胞中下调AKT⁃mTOR⁃p70 S6K途径和减少血管内皮生长因子的表达而发挥作用的。目前的结果提出了这样一种可能性:TRβ可以被认为是一个甲状腺癌的潜在的治疗目标[17-18]。
2.4 PDE5研究[19]表明在正常组织中存在PDE的转录表达,通过对PDE5基因和蛋白分别在两个不同阶段的PTC的PCR分析和蛋白质印迹法(Western blot)检测,发现在肿瘤与非肿瘤组织中PDE5A水平较高。此外,所有肿瘤组织中高水平表达PDE5甲状腺球蛋白[19]。研究表明,特异性利用PDE5抑制剂可能对于PTC的治疗有一定效果。
3 其他特殊标志物
3.1 IMP3IMP3是胰岛素样生长因子Ⅱ类Mrna结合蛋白家族中的成员,在许多器官的癌变以及恶性黑色素瘤和一些肉瘤的诊断中具有提示性意义。有假设说它也许是恶变的标记物[20]。一些前沿的研究结果表明IMP3在区分良恶性甲状腺肿瘤方面具有潜在使用价值。研究人员发现92例甲状腺损害中,包括22例结节性增生,14例滤泡腺癌,9例滤泡癌,37例乳头状瘤(15例滤泡变异体),3例高分化癌⁃未分化癌,4例低分化癌和未分化癌[21]。免疫组化方面,IMP3在细胞质中的表达是通过半定量染色以及在每个试验中获得的免疫组化数据的程度和强度来评价的。大于2的数据被认为是染色呈阳性。数据表明IMP3在区分增生性损害和肿瘤性损害方面是有效的,但不能将良性肿瘤与恶性肿瘤区分出来[21]。
3.2 Trop⁃1Trop⁃1 是保守增长的刺激分子是肿瘤发展早期阶段的标志。Trop⁃1证明了保守与平行结构和启动子区域基因表达模式(其在小肠和结肠高表达;在前列腺癌低表达,在甲状腺、唾液腺、乳腺癌、肾、肺、肝、脾,皮肤和胃均是低表达,在心、肌肉和大脑均没有表达)。不同组织的祖细胞都表达Trop⁃1。因此,在肿瘤发展的各个阶段分析了体外和体内Trop⁃1 的表达和功能作用。 研究[22]结果显示,Trop⁃1表达在肿瘤发展的早期阶段,有显著的表达。
3.3 降钙素降钙素主要由甲状腺滤泡旁细胞分泌,是MTC较敏感且特异的肿瘤标记物。目前临床多采用的血清基础水平降钙素的测定是比较肯定的对MTC高度特异性的诊断方法,但在甲状腺结节患者中常规进行五肽胃泌素兴奋后的降钙素水平测定尚存在争议。Herrmann等[23]对1007例甲状腺结节进行血清基础水平降钙素的测定,对其中降钙素水平≥10 pg/mL而<100 pg/mL的患者进行五肽胃泌素兴奋试验,结果发现进行兴奋试验后降钙素水平升高的患者中有0.2%被组织学确诊为MTC,故认为结合检测血清基础水平降钙素和五肽胃泌素兴奋试验有利于提高MTC早期诊断的敏感度。此外,Bugalho等[24]评估了血清降钙素测定与FNAB在MTC术前诊断的价值,发现前者较后者敏感性更高。降钙素水平还与肿瘤负荷存在一定相关性,可用于监测MTC术后患者体内的肿瘤负荷情况。因此,血清降钙素水平不仅可作为MTC术前较灵敏特异的诊断指标,还可作为监控 MTC术后有无复发的指标。但也有报道[25]提到MTC患者术前血清降钙素水平正常,免疫组化标记却提示弥漫强阳性染色,降钙素在患者血清和肿瘤组织间的表达水平存在较大的差异,故在没有足够证据的情况下,测定血清降钙素水平的同时仍需选择更多明确的指标来提高MTC诊断及预后的准确率。此外,与TC发生发展相关的其他肿瘤标记物还有很多,如结缔组织生长因子(connective tissue growth factor,CTGF)、转铁蛋白受体(cluster of differ⁃entiation 71,CD71)、间皮瘤相关抗体(the mesothelial cell⁃associated antibody,HBME⁃1)、金属硫蛋白(met⁃allothionein,MT)、细胞周期蛋白(cyclin)D1等。
4 结语
近几年来,甲状腺癌的发病率逐渐上升,且趋向年轻化,甲状腺结节良恶性的判断尤为重要,早发现早治疗对获得更好的预后效果具有重要意义。甲状腺癌标志物的发展为这一目标提供了可能,这些标志物在区分甲状腺良恶性病变、术前预测甲状腺肿瘤转移浸润情况、判断甲状腺癌预后等方面均有重要作用。另外,目前甲状腺癌的恶性分层和复发风险分层对于甲状腺癌患者的治疗和预后有重大意义,通过统计和检测标志物在不同恶性度的甲状腺癌中的表达水平也可帮助临床诊断以及评估复发风险。
这些标志物的发现为甲状腺疾病的治疗提供了新思路,相信在不远的未来,通过对这些标志物的进一步研究,将会寻找到更多更好的方法,取得历史性的新突破。
【参考文献】
[1]Caballero Y,López⁃Tomassetti EM,Favre J,et al.The value of thy⁃roperoxidase as a prognostic factor for differentiated thyroid cancer⁃⁃a long⁃term follow⁃up study[J].Thyroid Res,2015,8:12.
[2] Zhu H,Peng YG,Ma SG,et al.TPO gene mutations associated with thyroid carcinoma:Case report and literature review[J].Cancer Biomark,2015,15(6):909-913.
[3]朱国献,朱小兵,李 涛,等.端粒酶活性在甲状腺肿瘤中的表达及意义[J].中华普通外科学文献(电子版),2015,9(5):53-55.
[4] Khorobrykh TV,Glukhov AI,Ippolitov LI,et al.Puncture hystobi⁃opsy with tissue telomerase activity measurement in preoperative thy⁃roid nodes diagnostics[J].Khirurgiia (Mosk),2009(10):38-41.
[5] Nagasaka A,Oda N,Nakai A,et al.Thyroglobulin may affect telomerase activity in thyroid follicular cells[J].J Enzyme Inhib Med Chem,2009,24(2):524-530.
[6] Ito Y,Yoshida H,Tomoda C,et al.Telomerase activity in thyroid neoplasms evaluated by the expression of human telomerase reverse transcriptase (hTERT)[J].Anticancer Res,2005,25(1B):509-514.
[7] Capezzone M,Cantara S,Marchisotta S,et al.Short telomeres,telomerase reverse transcriptase gene amplification,and increased telomerase activity in the blood of familial papillary thyroid cancer patients[J].J Clin Endocrinol Metab,2008,93(10):3950-3957.
[8] Mizrachi A,Koren R,Hadar T,et al.Expression of MMP⁃1 in inva⁃sive well⁃differentiated thyroid carcinoma[ J].Eur Arch Otorhinolar⁃yngol,2011,268(1):131-135.
[9] Cavalheiro BG,Junqueira CR,Brandão LG.Expression of matrix metalloproteinase 2 (MMP⁃2) and tissue inhibitor of metalloprotein⁃ase 2 (TIMP⁃2) in medullary thyroid carcinoma:prognostic implica⁃tions[J].Thyroid,2008,18(8):865-871.
[10] 李艳萍,庚英兰,关宝生,等.MMP⁃2、MMP⁃9、CD147 在甲状腺乳头状癌中的表达[J].黑龙江医药科学,2010,33(2):41-42.
[11] Pujani M,Arora B,Pujani M,et al.Role of Ki⁃67 as a proliferative marker in lesions of thyroid[J].Indian J Cancer,2010,47(3):304-307.
[12] Sofiadis A,Becker S,Hellman U,et al.Proteomic profiling of follicular and papillary thyroid tumors[J].Eur J Endocrinol,2012,166(4):657-667.
[13] Dwivedi SS,Khandeparkar SG,JoshI AR,et al.Study of immuno⁃histochemical markers (CK⁃19,CD⁃56,Ki⁃67,p53) in differentia⁃ting benign and malignant solitary thyroid nodules with special refer⁃ence to papillary thyroid carcinomas[J].J Clin Diagn Res,2016,10(12):EC14-EC19.
[14] Aratake Y,Marutsuka K,Kiyoyama K,et al.EMMPRIN (CD147)expression and differentiation of papillary thyroid carcinoma:implica⁃tions for immunocytochemistry in FNA cytology[J].Cytopathology,2010,21(2):103-110.
[15] Ohta M,Ookoshi T,Naiki H,et al.HBME⁃1 and CD15 immunocy⁃tochemistry in the follicular variant of thyroid papillary carcinoma[J].Pathol Int,2015,65(3):119-125.
[16] Dunđerovic'D,Lipkovski JM,Boricˇic I,et al.Defining the value of CD56,CK19,Galectin 3 and HBME⁃1 in diagnosis of follicular cell derived lesions of thyroid with systematic review of literature[J].Di⁃agn Pathol,2015,10:196.
[17] Selmi⁃Ruby S,Bouazza L,Obregon MJ,et al.The targeted inactiva⁃tion of TRβ gene in thyroid follicular cells suggests a new mechanism of regulation of thyroid hormone production[J].Endocrinology,2014,155(2):635-646.
[18] Kim WG,Zhao L,Kim DW,et al.Inhibition of tumorigenesis by the thyroid hormone receptor β in xenograft models[J].Thyroid,2014,24(2):260-269.
[19] Sponziello M,Verrienti A,Rosignolo F,et al.PDE5 expression in human thyroid tumors and effects of PDE5 inhibitors on growth and migration of cancer cells[J].Endocrine,2015,50(2):434-441.
[20]余 洁,申丽娟.胰岛素样生长因子ⅡmRNA结合蛋白3与肿瘤的关系[J].昆明医科大学学报,2009,30(3B):145-149.
[21] Kulacogˇlu S,Erkilinc G.Imp3 expression in benign and malignant thyroid tumors and hyperplastic nodules[J].Balkan Med J,2015,32(1):30-37.
[22] Zanna P,Trerotola M,Vacca G,et al.Trop⁃1 are conserved growth stimulatory molecules that mark early stages of tumor progression[J].Cancer,2007,110(2):452-464.
[23] Herrmann BL,Schmid KW,Goerges R,et al.Calcitonin screening and pentagastrin testing:predictive value for the diagnosis of medullary carcinoma in nodular thyroid disease[J].Eur J Endocrinol,2010,162(6):1141-1145.
[24] Bugalho MJ,Santos JR,Sobrinho L.Preoperative diagnosis of medullary thyroid carcinoma:fine needle aspiration cytology as com⁃pared with serum calcitonin measurement[J].J Surg Oncol,2005,91(1):56-60.
[25] Alapat DV,Ain KB,Sloan DA,et al.Disparity between tissue and serum calcitonin and carcinoembryonic antigen in a patient with medullary thyroid carcinoma[J].Endocrine,2011,39(2):148-152.
