脑胶质瘤手术边界确认的研究新进展
2018-05-08朱玉辐徐州医科大学徐州医科大学附属医院脑科医院神经外科37病区江苏徐州000
王 勇,徐 强,赵 传,朱玉辐 (徐州医科大学,徐州医科大学附属医院脑科医院神经外科37病区,江苏 徐州000)
0 引言
脑胶质瘤是颅内最常见的呈浸润性生长的恶性肿瘤,占全部颅内肿瘤的 40%~50%[1-2],与正常组织界限不清,使得手术全切除难度较大,而残存肿瘤细胞是复发的基础。研究[3]显示90%肿瘤复发位于肿瘤强化边缘外2~3 cm的区域内。胶质瘤常常有非强化成分侵入到周围正常脑组织中[4]。20世纪80年代,Kelly等[5]通过立体定向活检术发现在胶质瘤外周水肿带内有肿瘤细胞。因此脑胶质瘤边界的确定及全切肿瘤是当今神经外科医生的共同愿望。
1 术前相关影像学辅助检查确认脑胶质瘤边界
1.1 氢质子磁共波谱分析(proton magnetic reso⁃nance spectroscopy,1H⁃MRS)通过检测活体组织内器官能量代谢、生化改变以及化合物定量分析获得脑胶质瘤代谢边界[6]。由于胶质瘤细胞的旺盛增长导致邻近正常神经元破坏或被肿瘤细胞所取代,从而神经元数量绝对或相对减少,表现为NAA峰下降,在胶质瘤的各个级别中均可出现Cho明显升高,反映了胶质细胞密度较正常神经组织高。在胶质瘤中,NAA/Cr值减小,Cho/Cr值增大;而在瘤周水肿区(peritumoral brain edema,PTBE),既无 NAA/Cr值减小,亦无Cho/Cr值增大,因此可将肿瘤与瘤周水肿区区分开来。Croteau等[7]通过对31例胶质瘤的肿瘤组织病理学与1H⁃MRS的比较,总结出1H⁃MRS能够反映胶质瘤的边界范围,并且指出1H⁃MRS将会成为精确估计胶质瘤病变范围的重要手段。Usinskiene等[8]通过系统性的文献分析发现不同级别的所有胶质瘤中 NAA/Cho值均小于 1,Cho/Cr值大于 1,在高级别胶质瘤中Cho/Cr值增大远比在低级别胶质瘤中要大的多(图1)。Li等[9]通过对35例肿瘤组织的研究也发现在所有肿瘤组织中NAA/Cr值均减小,Cho/Cr值均增大,无论肿瘤中心区还是边缘强化区都有这样的特殊现像,但在远离瘤周水肿区均没有发现这种现象。所以,1H⁃MRS可以用来区分胶质瘤的肿瘤浸润区和瘤周的水肿区。
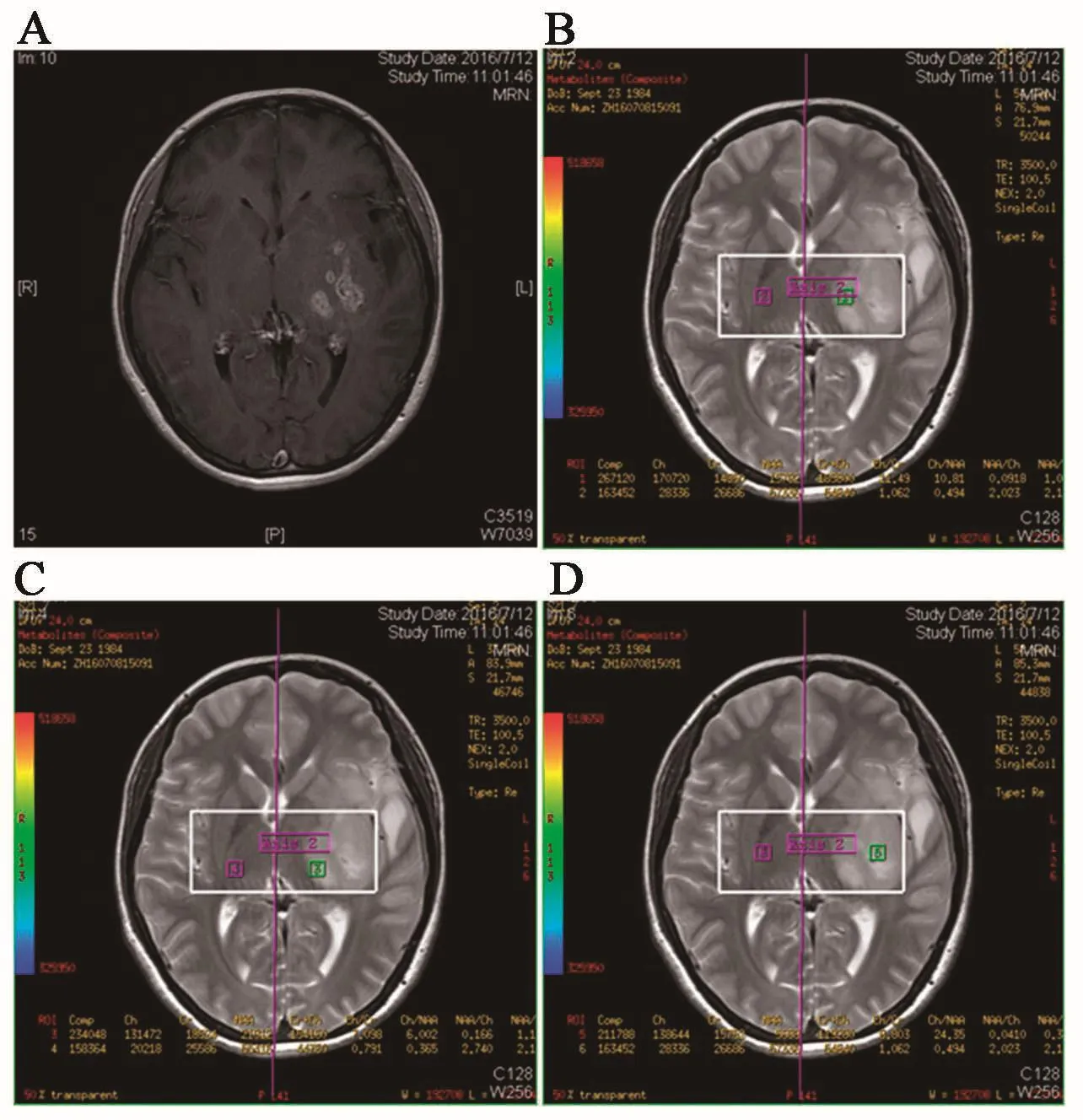
图1 MRS显示肿瘤强化边缘区域近瘤周区未强化部分NAA/Cho<1,Cho/Cr>1,提示存在肿瘤细胞的浸润
1.2 磁共振弥散加权成像(difusion weighted ima⁃ging,DWI)DWI能够显示病理状态下水分子扩散运动的改变,定量计算水分子的扩散速度有助于疾病的诊断。Kang等[10]研究认为:由于脑胶质瘤的级别越高,细胞密度越大,核浆比越大,水分子扩散受限愈明显,表现扩散系数(apparent diffusion coefficient,ADC)值越低,DWI信号越高,ADC图呈相对低信号;反之,则ADC值越高,DWI信号越低,ADC图呈相对高信号。邹启桂等[11]通过对20例胶质瘤的ADC值对比研究发现高级别胶质瘤近瘤周水肿区存在胶质瘤细胞。同时还发现,高级别胶质瘤近瘤周水肿区Cho/Cr值和ADC值之间负相关,结合较高的 Cho/Cr值和较低的ADC值,可以预测高级别胶质瘤近瘤周水肿区(距肿瘤强化边界1 cm以内)存在肿瘤细胞浸润,可以作为常规MRI的补充,确认肿瘤边界。
1.3 磁共振灌注成像(perfusion weighted imaging,PWI)PWI是基于团注对比剂追踪技术,当团注顺磁性对比剂进入毛细血管床时,组织血管腔内的磁敏感性增加,引起局部磁场的变化,通过PWI信号高低来反映组织血液灌注的情况,间接反映组织的微血管分布情况[12]。高级别胶质瘤的瘤体最大灌注血容量值rCBVmax明显高于低级别胶质瘤。 Guzmán⁃De⁃Villoria等[13]通过对120例胶质瘤行 PWI成像证实了高级别胶质瘤的瘤体血流灌注量明显高于低级别胶质瘤。Hakyemez等[14]发现胶质瘤灶周水肿带中存在浸润的肿瘤细胞和新生血管而表现为高灌注,但灶周水肿带内无胶质瘤浸润的正常脑组织细胞,造成周围血管受压从而表现为低灌注,借此,有助于鉴别脑胶质瘤灶周水肿带内是否存在肿瘤组织的浸润。
1.4 磁共振扩散张量成像(diffusion tensor ima⁃ging,DTI)DTI是通过测量生物组织内水分子的弥散程度来评价生物组织结构和生理状态,使用这种方法可以定量评价脑胶质瘤PTBE的弥散改变特点,不但可以检测脑内水分子弥散的程度,而且可以通过ADC描述组织中的水分子扩散运动状况与各向异性值(fractional anisotropy,FA)定量检测水分子弥散的方向性改变特点,可较DWI更准确地了解组织结构的弥散特点,研究[15]发现FA值能够提示白质纤维的损害程度。Goebell等[16]通过对23例星形细胞肿瘤(低级别11例,高级别12例)的FA值行统计学比较后,发现高级别胶质瘤瘤周FA值比低级别胶质瘤瘤周FA值低,这表明在低级别肿瘤周边的纤维束相对完整,而高级别胶质瘤周围的纤维束明显受到肿瘤浸润和破坏。Papageorgiou等[17]通过对38例胶质瘤(低级别11例,高级别27例)的FA值测定后也发现低级别胶质瘤瘤周FA值高,而在高级别胶质瘤瘤周FA值低。Stadnik等[18]通过对11例胶质瘤研究发现在胶质瘤瘤周水肿带外白质处有一环形FA值升高带,而在肿瘤中心、近瘤周水肿区FA值低。所以通过测量FA值的大小也可以区分胶质瘤的肿瘤浸润边界。DTI还可以对白质纤维束的形态进行直观显示。观察肿瘤的直接侵犯破坏和占位效应所致的纤维束的推压移位。结合FA图、方向编码彩色(direc⁃tion encoded color,DEC)图和弥散张量纤维束成像技术(diffusion tensortractography,DTT)图,能够清楚显示瘤周白质的异常位置,更能显示出远距离的白质纤维束因占位效应所致的位置异常。Chen等[19]用DTI对18例胶质瘤的DTT图像分析,发现低级别胶质瘤中邻近的神经纤维束受推移,受侵润程度轻,而神经纤维束的破坏主要出现在高级别胶质瘤中。Chen等[20]通过对10例位于语言区的胶质瘤患者行两张量的无迹卡尔曼滤波(two⁃tensor unscented Kalman filter,UKF)成像和 DTT对比后发现UKF成像能够在胶质瘤瘤周水肿区对白质纤维进行更好的成像(图2),从而能够更加准确地判断胶质瘤瘤周白质纤维受损的程度。从两者的研究中,通过对两种成像技术的联合运用可以更直观地发现瘤周区肿瘤细胞浸润的程度,从而有助于确认胶质瘤瘤周肿瘤细胞浸润区与瘤周水肿区正常组织的界限。
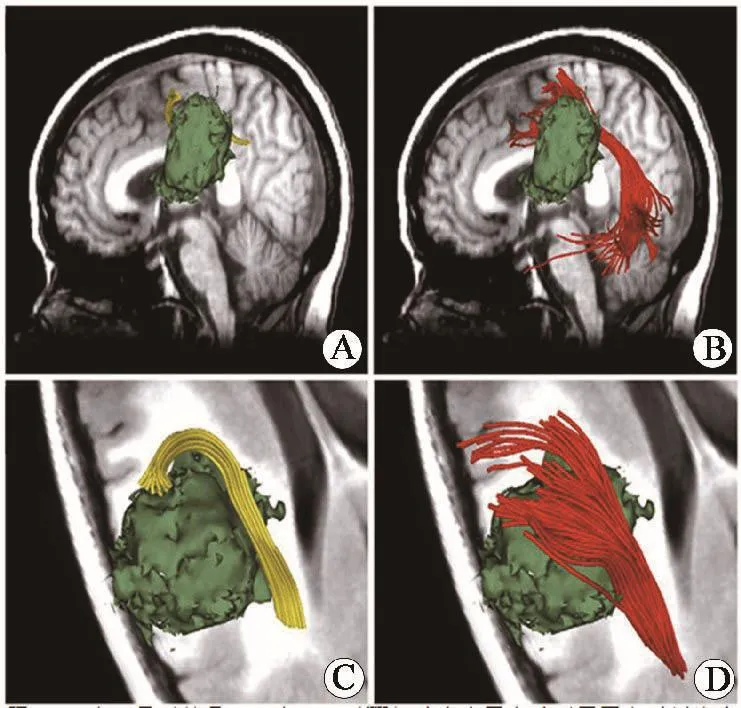
图2 DTT和UKF对胶质瘤瘤周水肿区周围白质纤维束的成像
1.5 血氧水平依赖功能磁共振成像(blood oxygen⁃level dependent functional magnetic resonance ima⁃ging,BOLD⁃fMRI)BOLD⁃fMRI主要是利用血液中内源性氧合血红蛋白与脱氧血红蛋白之间的转换来显示局部脑皮层功能活动的成像技术。BOLD⁃fM⁃RI既能显示运动皮层功能区和感觉功能区,也能区分脑胶质瘤和正常脑组织,尤其是胶质母细胞瘤病变侧的BOLD信号比对侧正常脑组织信号降低;Håberg等[21]通过对25例胶质瘤研究发现,距离肿瘤边缘>10 mm的重要语言区,术后失语的可能性很小。 Kundu等[22]通过对 49例患者的 BOLD⁃fMRI与术中皮质激活图对照分析,同样也发现重要语言区(Broca区和Wernicke区)距离肿瘤边缘≤1 cm范围内,术后失语的可能性很大。皮质运动功能区也有同样类似的结果,距离肿瘤边缘在1 cm以内的,术后功能被破坏的可能性很大[23]。通过上述资料显示,可以发现对皮质功能区的胶质瘤行BOLD⁃fMRI检查有助于辨认胶质瘤的边界。
1.6 11C⁃蛋氨酸⁃PET/CT11C⁃蛋氨酸⁃PET/CT 是利用胶质瘤组织中的肿瘤细胞对其吸收后产生的化学特性,而正常脑组织对其吸收后产生的化学特性可以忽略不计的特点,在PET/CT上红色荧光区域来显示肿瘤及其边界。11C⁃蛋氨酸⁃PET/CT图像可以显示胶质瘤瘤周范围,依据胶质细胞浸润周围正常组织的特点,可以认为胶质瘤真正的边界在T2⁃flair图像上的水肿区外围。Susheela等[24]通过对1例脑胶质瘤患者的行11C⁃蛋氨酸⁃PET/CT和常规 MRI检查对比发现,胶质瘤瘤周范围不仅大于胶质瘤在T1强化上的病灶范围,而且也大于胶质瘤在T2⁃flair图像上的水肿区(图 3)。 Matsuo等[25]通过对 32例胶质瘤患者的放射治疗效果总结,放疗的范围包括胶质瘤周边正常组织范围至少在T2⁃flair图像上的水肿区及T1强化上的病灶外2 cm,这样可以获得很好的放疗效果。

图3 A和 B图像对比(红圈标记为11C⁃Methionine⁃PET大于T2Flair的肿瘤边界);C和D图像对比(胶质瘤细胞被11C⁃Methionine⁃PET标记的绿圈约为T1增强标记的蓝色圈的3倍);B和D图像(淡绿色标记为T2Flair、大于T1增强的肿瘤边界)
2 术中辅助技术协助外科医生确认脑胶质瘤的边界
术前相关检查在一定程度上帮助神经外科医生确定了胶质瘤的边界,术者可以利用 “雕刻式”切除手术的策略和方法。该理念是根据胶质瘤生物学行为和周围脑组织的解剖结构、血供情况等,严格按照肿瘤与周边组织的界面和肿瘤沿白质纤维的走行方向做顺势的“雕花镂空”式切除,争取在保留功能的前提下尽量多的切除肿瘤。术者感受切除肿瘤过程中吸引器吸力、组织的软硬质地、脑组织颜色、血管对双极电凝灼闭的反应等细微变化,可以很好地判断肿瘤的边界。肿瘤和瘤周水肿组织在颜色和质地上有所不同,通常肿瘤组织呈灰白色、灰黄色或灰红色,而正常脑组织颜色较浅,呈白色或黄白色。肿瘤周边的水肿带多质地稀软[26]。在一项Meta分析统计中,在常规白光显微镜下胶质瘤患者的总体全切率约为36%[27]。所以为了能在安全的前提下实现更大限度地全切肿瘤组织需要联合运用多种技术来辅助确认肿瘤组织(图4)。
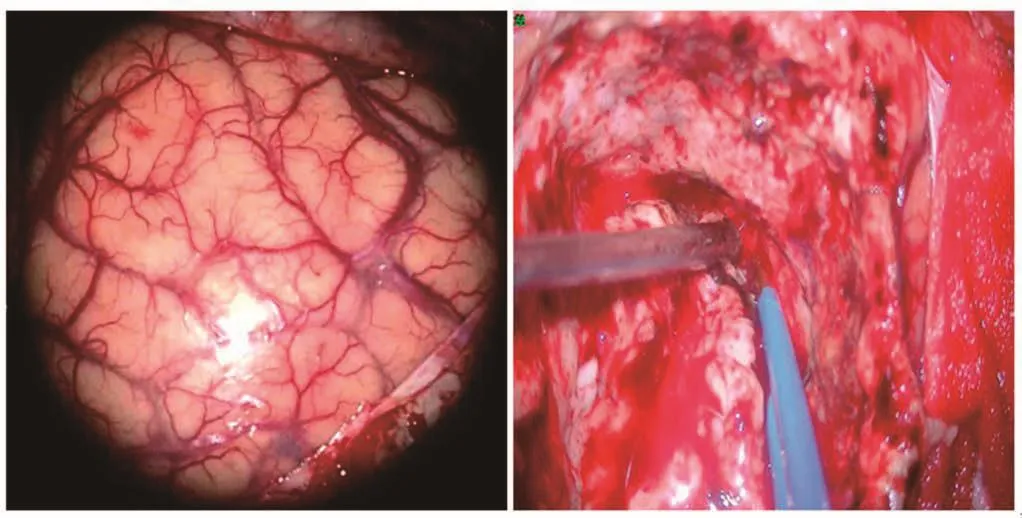
图4 术中黄荧辅助切除肿瘤组织(白光下见肿瘤组织呈灰白色、质韧)
首先在神经立体定向及导航技术的应用下,有助于判断手术涉及部位的重要颅脑结构与肿瘤组织的相互关系,勾画出肿瘤三维轮廓,大大提高了手术的精确度和肿瘤组织的切除率。但是当术中硬脑膜被打开后,随着脑脊液的释放,脑组织的移位给外科医生对肿瘤边界的确认又带来了巨大的挑战。由此,近年来术中超声、超声造影、术中MRI、荧光等辅助技术诞生了。MRI可以在术中对胶质瘤组织进行实时成像,从而指导外科医生更大程度地切除肿瘤组织,在术中MRI的协助下其总体的全切率可达到70%左右[27]。然而术中MRI的应用需要复合手术室,对医院的硬件要求非常高,患者承担的费用较大,一时之间难以实现全面推广。而术中超声及超声造影的应用具有花费少的优点。术中超声在一定程度上可以用来指导手术切除范围,但是残瘤、局部血栓和瘢痕等使其对胶质瘤边界的确认不是那么理想,而术中超声造影可以弥补其不足[28],术中超声造影可以帮助确定肿瘤边界,在术中实时辨别肿瘤组织、胶质增生带、瘤周水肿区组织和正常脑组织,使肿瘤的边界相对清晰。肿瘤切除后行超声造影检查也可协助了解肿瘤的切除情况,判断有无肿瘤残余,大大提高了肿瘤切除率[29],其总体的全切率可达到 73.4%[27]。 黄荧光模式下的荧光素钠标记胶质瘤组织能帮助术者判断高级别胶质瘤的边界,强荧光组织对应的高级别胶质瘤有很好的敏感度和特异度,术中应尽量切除强荧光组织,提高肿瘤的全切率,总体的全切除率可达84.4%[27]。但是对于低级别胶质瘤荧光显影不明显,不能完全依赖黄荧光进行低级别胶质瘤的切除。
相比上述辅助新技术,在2017年5月10日,美国FDA刚批准认可的5⁃aminolevulinic acid hydrochlo⁃ride(5⁃ALA HCL)具有更高的安全性和可行性,可以更准确地评估肿瘤边界,更大程度地减少患者的花费。最终实现真正意义上的全切除肿瘤,延长患者的无进展生存期,提高总体生存率。5⁃ALA荧光引导技术对判断恶性胶质瘤的边界具有较高的准确性,强的红色荧光代表肿瘤中心的实体部分,在不影响神经功能的前提下,术中应该全部切除。弱的粉色荧光或淡粉色荧光代表浸润性的肿瘤,是否应该全切尚存在一定的争议[30]。对于弱的粉色荧光或淡粉色荧光区的实体部分是否应该切除,术中快速病理结果可能弥补其微小的不足之处。5⁃ALA的另一优点是可以区分低级别非强化的胶质瘤中的恶性组织成分,实现早期切除肿瘤组织,降低复发率,延长无进展生存期,提高总体生存率和生活质量。未来研究的热点是如何进一步提高5⁃ALA荧光的敏感性和特异性,以更准确地判断恶性胶质瘤的边界,同时将该技术应用于低级别的胶质瘤手术中。
3 总结与展望
对于位于非重要功能区的胶质瘤,1H⁃MRS可通过对组织代谢物质浓度的监测来区分胶质瘤的肿瘤浸润区和瘤周的水肿区;DWI可以预测高级别胶质瘤近瘤周水肿区(距肿瘤强化边界1 cm以内)存在肿瘤细胞浸润,可以作为常规MRI的补充,确认肿瘤的边界;PWI可以用于区分高级别与低级别的胶质瘤,同时还可以发现鉴别脑胶质瘤周围水肿带中是否存在肿瘤组织的浸润。对位于上下行传导束周围的胶质瘤,DTI更能发挥其作用。DTI通过对FA值的测定可以估计胶质瘤周围水肿带内白质纤维的损害程度。DTI还可通过DTT图和UKF图来直观地显示纤维束的形态,从而更加准确地判断胶质瘤瘤周白质纤维受损的程度。对位于皮质功能区的胶质瘤,BOLD⁃fMRI可以辨认肿瘤的边界与功能区的关系(浸润和或压迫),实现保留重要功能的前提下实现肿瘤的最大切除,提高患者生活质量,降低复发率。最终可认为在高级别脑胶质瘤T1强化边缘外10 mm内存在肿瘤细胞浸润,手术切除1 cm内的胶质瘤瘤周组织是可行的,而对于需要放疗的患者可以把放疗靶区扩大到胶质瘤强化边缘外2 cm,这样可以获得很好的放疗效果。本文通过对大量文献的复习,认为在胶质瘤T1强化边缘外10 mm内存在肿瘤细胞的浸润,10 mm之外是否存在胶质瘤肿瘤细胞的浸润有待大样本的进一步研究。同时在术中辅助技术的协助下,可帮助神经外科医生在术中确认需切除胶质瘤的最大范围,尤其在5⁃ALA和术中病理的广泛应用之后,可以实现肿瘤的全切,减少肿瘤组织的残留,降低肿瘤复发率,延长患者无进展生存期,提高总体生存率和生活质量。
【参考文献】
[1] Wu CX,Lin GS,Lin ZX,et al.Peritumoral edema on magnetic resonance imaging predicts a poor clinical outcome in malignant glioma[J].Oncol Lett,2015,10(5):2769-2776.
[2]李国亮,王选重,田沁森,等.脑胶质瘤综合治疗新进展[J].转化医学电子杂志,2017,4(7):16-20.
[3] Chan JL,Lee SW,Fraass BA,et al.Survival and failure patterns of high⁃grade gliomas after three⁃dimensional conformal radiotherapy[J].J Clin Oncol,2002,20(6):1635-1642.
[4] Ruiz⁃Ontañon P,Orgaz JL,Aldaz B,et al.Cellular plasticity con⁃fers migratory and invasive advantages to a population of glioblasto⁃ma⁃initiating cells that infiltrate peritumoral tissue[J].Stem Cells,2013,31(6):1075-1085.
[5] Kelly PJ,Daumas⁃Duport C,Kispert DB,et al.Imaging⁃based ster⁃eotaxic serial biopsies in untreated intracranial glial neoplasms[J].J Neurosurg,1987,66(6):865-874.
[6] van Dijken BRJ,van Laar PJ,Holtman GA,et al.Diagnostic accu⁃racy of magnetic resonance imaging techniques for treatment response evaluation in patients with high⁃grade glioma,a systematic review and meta⁃analysis[J].Eur Radiol,2017,27(10):4129-4144.
[7] Croteau D,Scarpace L,Hearshen D,et al.Correlation between magnetic resonance spectroscopy imaging and image⁃guided biop⁃sies:semiquantitative and qualitative histopathological analyses of patients with untreated glioma[J].Neurosurgery,2001,49(4):823-829.
[8] Usinskiene J,Ulyte A,Bjørnerud A,et al.Optimal differentiation of high⁃and low⁃grade glioma and metastasis: a meta⁃analysis of perfu⁃sion,diffusion,and spectroscopy metrics[ J].Neuroradiology,2016,58(4):339-350.
[10] Kang Y,Choi SH,Kim YJ,et al.Gliomas: Histogram analysis of apparent diffusion coefficient maps with standard⁃or high⁃b⁃value diffusion⁃weighted MR imaging⁃⁃correlation with tumor grade[ J].Radiology,2011,261(3):882-890.
[11]邹启桂,徐海波,李志勇,等.应用1H⁃MRS和DTI评估胶质瘤患者瘤周水肿区肿瘤细胞浸润[J].华中科技大学学报(医学版),2011,40(2):151-155,159.
[12]黄 伟,任晓辉,林 松.磁共振灌注成像在胶质瘤复发与放射性坏死鉴别诊断中的应用[J].转化医学电子杂志,2017,4(7):80-82.
[13] Guzmczán⁃De⁃Villoria JA,Mateos⁃Pérez JM,Fernández⁃García P,et al.Added value of advanced over conventional magnetic resonance imaging in grading gliomas and other primary brain tumors[J].Cancer Imaging,2014,14(1):35.
[14] Hakyemez B,Erdogan C,Gokalp G,et al.Solitary metastases and high⁃grade gliomas: radiological differentiation by morphometric a⁃nalysis and perfusion⁃weighted MRI[J].Clin Radiol,2010,65(1):15-20.
[15] Mekkaoui C,Metellus P,Kostis WJ,et al.Diffusion Tensor Imaging in Patients with Glioblastoma Multiforme Using the Supertoroidal Model[J].PLoS One,2016,11(1):e0146693.
[16] Goebell E,Paustenbach S,Vaeterlein O,et al.Low⁃grade and ana⁃plastic gliomas: differences in architecture evaluated with diffusion⁃tensor MR imaging[J].Radiology,2006,239(1):217-222.
There are two types of US legislation affecting China-US space cooperation.One kind directly limits cooperation between China and the United States in space.The other is comprised of laws and regulations concerning missile proliferation.
[17] Papageorgiou TS,Chourmouzi D,Drevelengas A,et al.Diffusion Tensor Imaging in brain tumors: A study on gliomas and metastases[J].Phys Med,2015,31(7):767-773.
[18] Stadnik TW,Chaskis C,Michotte A,et al.Diffusion⁃weighted MR imaging of intracerebral masses:comparison with conventional MR imaging and histologic findings[J].AJNR Am J Neuroradiol,2001,22(5):969-976.
[19] Chen F,Zhang X,Li M,et al.Axial diffusivity and tensor shape as early markers to assess cerebral white matter damage caused by brain tumors using quantitative diffusion tensor tractography[J].CNS Neurosci Ther,2012,18(8):667-673.
[20] Chen Z,Tie Y,Olubiyi O,et al.Reconstruction of the arcuate fas⁃ciculus for surgical planning in the setting of peritumoral edema u⁃sing two⁃tensor unscented Kalman filter tractography[J].Neuroim⁃age Clin,2015,7:815-822.
[21] Håberg A,Kvistad KA,Unsgård G,et al.Preoperative blood oxygen level⁃dependent functional magnetic resonance imaging in patients with primary brain tumors: clinical application and outcome[J].Neurosurgery,2004,54(4):902-914.
[22] Kundu B,Penwarden A,Wood JM,et al.Association of functional magnetic resonance imaging indices with postoperative language out⁃comes in patients with primary brain tumors[J].Neurosurg Focus,2013,34(4):E6.
[23] Wood JM,Kundu B,Utter A,et al.Impact of brain tumor location on morbidity and mortality:a retrospective functional MR imaging study[J].AJNR Am J Neuroradiol,2011,32(8):1420-1425.
[24] Susheela SP,Revannasiddaiah S,Madhusudhan N,et al.The demonstration of extension of high⁃grade glioma beyond magnetic resonance imaging defined edema by the use of(11) C⁃methionine positron emission tomography[J].J Cancer Res Ther,2013,9(4):715-717.
[25] Matsuo M,Miwa K,Tanaka O,et al.Impact of[11C]methionine positron emission tomography for target definition of glioblastoma multiforme in radiation therapy planning[J].Int J Radiat Oncol Biol Phys,2012,82(1):83-89.
[26]杨树源,只达石.神经外科学[M].人民卫生出版社,2008:645-650.
[27] Eljamel MS,Mahboob SO.The effectiveness and cost⁃effectiveness of intraoperative imaging in high⁃grade glioma resection; a comparative review of intraoperative ALA,fluorescein,ultrasound and MRI[J].Photodiagnosis Photodyn Ther,2016,16:35-43.
[28] Rahim A,Taylor SL,Bush NL,et al.Physical parameters affecting ultrasound/microbubble⁃mediated gene delivery efficiency in vitro[J].Ultrasound Med Biol,2006,32(8):1269-1279.
[29] Kanno H,Ozawa Y,Sakata K,et al.Intraoperative power Doppler ultrasonography with a contrast⁃enhancing agent for intracranial tumors[J].J Neurosurg,2005,102(2):295-301.
[30]李朝晖,韩 亮,田 宇.5⁃ALA荧光引导技术在脑胶质瘤手术中的临床应用进展[J].世界复合医学,2015,(1):85-90.
