CYP2C19基因多态性与PCI手术患者血小板抑制率的相关性研究
2017-09-06庄金龙邓节喜陈劲松阮发晖林庚海朱健戴增欢陈华
庄金龙 邓节喜 陈劲松 阮发晖 林庚海 朱健 戴增欢 陈华
临床研究
CYP2C19基因多态性与PCI手术患者血小板抑制率的相关性研究
庄金龙 邓节喜 陈劲松 阮发晖 林庚海 朱健 戴增欢 陈华
目的 研究CYP2C19基因多态性对经皮冠状动脉介入治疗(PCI)手术患者血小板抑制率的影响。方法 本研究纳入2014年1月至2016年4月在解放军第一七五医院心内科住院符合入选标准的冠心病患者210例,均需行PCI治疗。所有入选者均采取静脉血标本并提取外周血基因组DNA进行PCR扩增及纯化,进行基因芯片杂交显色,通过生物芯片识读仪检测CYP2C19基因型,根据不同的基因型对患者进行分组。入选者服用负荷量阿司匹林+氯吡格雷24 h后采取静脉血标本,然后用血栓弹力图仪(TEG)检测并自动计算出二磷酸腺苷(ADP)诱导的血小板抑制率。结果 入选的210例患者各基因型比例分别为:(*1/*1)94 例(44.8%)、(*1/*2)79 例(37.6%)、(*1/*3)12 例(5.7%)、(*2/*2)20 例(9.5%)、(*2/*3)4 例(1.9%)、(*3/*3)1例(0.5%),其中快代谢型(EM型)94例(44.8%)、中等代谢型(IM型)91例(43.3%)、慢代谢型(PM型)25例(11.9%),共有43例患者(20.5%)出现氯吡格雷抵抗现象(CR)。不同基因型组患者的血小板抑制率差异均有统计学意义(P<0.01),其中PM型患者的血小板抑制率最低,IM型次之;不同基因型组患者的氯吡格雷抵抗情况差异有统计学意义(P<0.01),其中PM型患者的CR远高于另外两组。结论 CYP2C19不同基因型对氯吡格雷抗血小板作用的影响存在显著差异,其中携带CYP2C19*2或*3突变等位基因的PCI手术患者发生CR的风险明显增加。
CYP2C19; 基因多态性; 血小板抑制率
近年来,氯吡格雷与阿司匹林的双联抗血小板治疗,已经成为急性冠脉综合征和经皮冠状动脉介入术(percutaneous coronary intervention,PCI)后患者的标准抗栓治疗方案[1]。然而部分患者服用常规剂量甚至更大剂量的氯吡格雷仍没有达到预期的抗血小板作用,这种现象被称为氯吡格雷低反应或氯吡格雷抵抗(Clopidogrel resistance,CR)[2],致使部分PCI术后患者即使长期、规律地服用氯吡格雷,仍有支架内血栓形成、支架内再狭窄等严重的心血管不良事件的发生[3,4]。目前氯吡格雷抵抗的机制尚不十分清楚,遗传因素和环境因素在氯吡格雷抵抗发生过程中起重要作用,基因多态性被认为是其最重要的内部因素[5]。相关研究发现,CYP2C19存在多种突变等位基因,而主要变异是CYP2C19*2和CYP2C19*3两型,这两种突变等位基因均能造成CYP2C19酶活性的降低或完全丧失,从而对氯吡格雷的疗效产生重要的影响[6,7]。本研究目的是通过分析CYP2C19不同基因型与血小板抑制率的相关性,为PCI术后患者选择最佳的抗栓治疗方案提供理论基础及实验室依据,降低氯吡格雷抵抗发生率,进而减少心血管不良事件的再次发生。
1 对象与方法
1.1 研究对象 纳入2014年1月至2016年4月在解放军第一七五医院心内科住院,需行PCI手术治疗的冠心病患者210例,其中男性167例、女性43例。入选标准:①不稳定型心绞痛患者;②急性非ST段抬高型心肌梗死患者;③急性ST段抬高型心肌梗死患者;④已行冠脉CTA检查提示罪犯血管病变狭窄>75%的心绞痛患者。排除标准:①阿司匹林和氯吡格雷过敏或不能耐受;②严重肝肾功能损害者;③近期出血性疾病者,如脑出血、消化道出血等;④血液系统疾病,如血小板计数异常<50×109/L或>700×109/L等;⑤抗血小板治疗禁忌证者;⑥长期口服华法林、胺碘酮等药物者;⑦近1个月长期服用氯吡格雷者。本研究方案已通过解放军第一七五医院伦理委员会的审批,全部入选者均为自愿参加,且入组前都已签署知情同意书。
1.2 研究方法 所有入选者均于入院次日晨起采取静脉血标本2 ml,送至我院药学科基因检测室提取外周血基因组DNA。将提取后的DNA进行PCR扩增,扩增产物经纯化后进行基因芯片杂交显色,通过生物芯片识读仪检测CYP2C19基因型,根据不同基因型对患者进行分组。入选者服用300 mg阿司匹林肠溶片(拜耳制药公司,100 mg/片)+300 mg硫酸氢氯吡格雷片(赛诺菲制药公司,75 mg/片),24 h后采取静脉血标本并用血栓弹力图仪(美国Haemoscope公司,TEG 5000型)检测,自动计算出二磷酸腺苷(ADP)诱导的血小板抑制率。
1.3 CYP2C19基因型的检测及分组 所有入选者均用紫色管静脉采血2 ml,由我院药学科专职基因检测员按照全血基因组DNA提取试剂盒说明书(上海百傲科技有限公司)提取基因组DNA,用PCR仪(上海百傲科技有限公司)扩增,使用e-Hyb全自动杂交仪(上海百傲科技有限公司)进行基因芯片杂交显色后,取出芯片放入BaiO BE-2.0生物芯片识读仪(上海百傲科技有限公司),检测CYP2C19基因型,输出检测报告。DNA提取过程,PCR扩增、杂交,基因阵列分析都严格按照BaiO基因分析仪手册(上海百傲科技有限公司)进行。本研究主要检测人类基因组CYP2C19基因两个等位基因位点,即CYP2C19*2(G681A)和CYP2C19*3(G636A)。该基因型分为3种:野生型,636GG/681GG(*1/*1);突变杂合型,636GG/681GA(*1/*2)、636GA/681GG(*1/*3);突变纯合型,636GG/681AA(*2/*2)、636GA/681GA(*2/*3)和 636AA/681GG(*3/*3)。携带野生型基因(CYP2C19*1/*1)的为快代谢型(EM型),突变杂合型(CYP2C19*1/*2、CYP2C19*1/*3)为中等代谢型(IM 型),突变纯合型(CYP2C19*2/*2、CYP2C19*2/*3、CYP2C19*3/*3)为慢代谢型(PM 型)。
1.4 血小板抑制率的测定 所有入选者经负荷量双联抗血小板治疗24 h后,均抽取静脉血分别加入蓝帽枸橼酸管和绿帽肝素管中,急送我院输血科,由专职检验员利用血栓弹力图仪(美国Haemoscope公司,TEG 5000型)进行检测。严格按照说明书操作,采用三通道测试。第一通道:枸橼酸化高岭土激活全血测试(MAth);第二通道:A激活剂激活的样品测试(MAfib);第三通道:二磷酸腺苷(ADP)激活样品测试(MAADP);合成三个测试图。然后TEG自动根据血小板抑制率公式MAADP%=[(MAth-MAADP)/(MAth-MAfib)]×100%,计算出ADP诱导的血小板抑制率MAADP%。血小板抑制率低于50%视为氯吡格雷抵抗或低反应。
1.5 统计学方法 采用SPSS 16.0统计软件分析。计数资料用百分率(%)表示,进行χ2检验;计量资料以±s表示,两组间比较满足正态分布及方差齐性的用t检验,不满足正态分布及方差齐性的用秩和检验,多组间比较用方差分析,组内多个样本之间两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 三种不同基因型组PCI手术患者的基线资料比较 本研究共纳入210例患者,其中男性169例、女性41例,年龄50~78岁。三种不同基因型组患者在年龄、性别、BMI、高血压、糖尿病、吸烟、高脂血症,服用他汀类药物、β受体阻滞剂、ACEI/ARB等冠心病用药方面比较未见统计学差异(P>0.05)。见表 1。
表1 PCI手术患者基线资料的比较[±s,例数及百分率(%)]
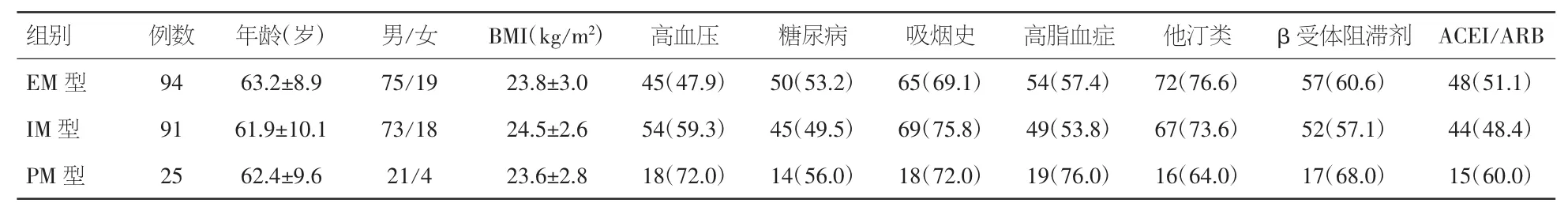
表1 PCI手术患者基线资料的比较[±s,例数及百分率(%)]
注:BMI:体重指数;ACEI/ARB:血管紧张素转化酶抑制剂/血管紧张素受体阻滞剂
组别例数年龄(岁)男/女BMI(kg/m2)高血压糖尿病吸烟史高脂血症他汀类β受体阻滞剂ACEI/ARB EM 型 94 63.2±8.9 75/19 23.8±3.0 45(47.9) 50(53.2) 65(69.1) 54(57.4) 72(76.6) 57(60.6) 48(51.1)IM 型 91 61.9±10.1 73/18 24.5±2.6 54(59.3) 45(49.5) 69(75.8) 49(53.8) 67(73.6) 52(57.1) 44(48.4)PM 型 25 62.4±9.6 21/4 23.6±2.8 18(72.0) 14(56.0) 18(72.0) 19(76.0) 16(64.0) 17(68.0) 15(60.0)
2.2 PCI手术患者CYP2C19基因型分布情况 本研究纳入的210例患者共检测出CYP2C19基因型6 种 :(*1/*1)、(*1/*2)、(*1/*3)、(*2/*2)、(*2/*3)、(*3/*3)(见图 1),分别为 94 例(44.8%)、79 例(37.6%)、12例(5.7%)、20例(9.5%)、4例(1.9%)、1例(0.5%),其中快代谢型(EM型)94例(44.8%)、中等代谢型(IM型)91例(43.3%)、慢代谢型(PM型)25例(11.9%)。见表2。
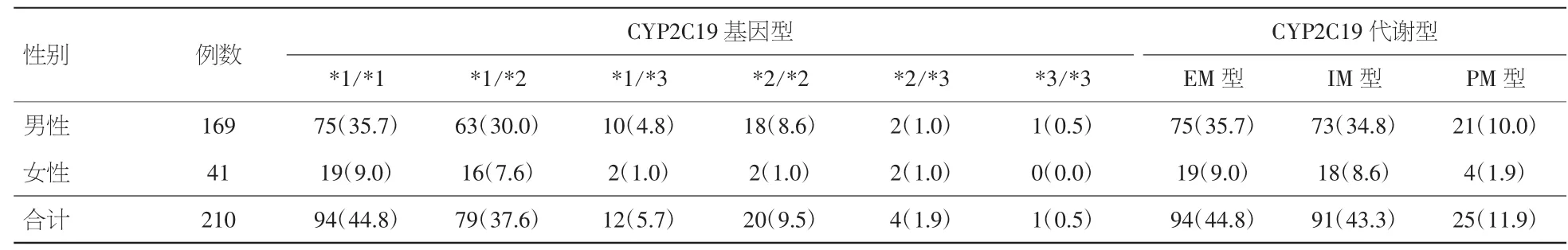
表2 PCI手术患者CYP2C19等位基因及基因型的分布[例数及百分率(%)]
2.3 不同基因型组患者双抗治疗24 h后血小板抑制率比较 PCI手术患者经双联抗血小板治疗24 h后,不同基因型组患者的血小板抑制率差异有统计学意义(P<0.01),其中PM型患者的血小板抑制率最低,IM型次之,见表3。
表3 不同基因型患者血小板抑制率的比较(%,±s)
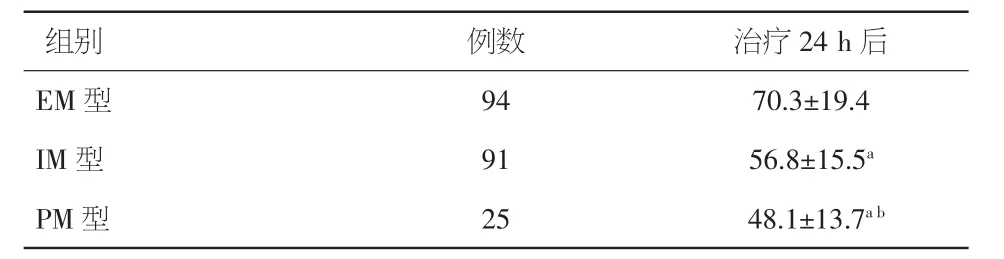
表3 不同基因型患者血小板抑制率的比较(%,±s)
注:与 EM型比较,aP<0.01;与 IM型比较,bP<0.01
组别 例数 治疗24 h后EM 型 94 70.3±19.4 IM 型 91 56.8±15.5aPM 型 25 48.1±13.7ab
2.4 不同基因型组患者氯吡格雷抵抗率比较 本试验中共有43例(20.5%)患者出现氯吡格雷抵抗现象,不同基因型组患者的氯吡格雷抵抗情况差异有统计学意义(P<0.01),其中PM型患者的CR远高于另外两组,见表4。

表4 不同基因型患者氯吡格雷抵抗率的比较[例数及百分率(%)]
3 讨论
冠心病是21世纪严重威胁人类健康的高危疾病,具有高发病率、高死亡率、高致残率等特点。近年来随着PCI在冠心病中的广泛应用,患者临床症状得到明显改善。目前氯吡格雷联用阿司匹林的抗血小板治疗方案已广泛应用于急性冠脉综合征(ACS)和PCI术后,国内外相关指南及专家共识也均推荐PCI术后患者必须维持氯吡格雷与阿司匹林双联抗血小板治疗至少1年,甚至延长到2年。然而许多术后长期、规范使用氯吡格雷抗血小板治疗的患者仍发生支架内血栓形成导致管腔狭窄或闭塞,出现再发ACS甚至死亡等严重的心血管不良事件。现有的大量研究证明这一现象与个体之间的差异使得不同患者对氯吡格雷治疗反应性不同明显相关,部分术后患者即使给予规范剂量甚至倍量的氯吡格雷治疗,其抑制血小板聚集的作用仍明显降低,临床上这种现象被称为氯吡格雷低反应或氯吡格雷抵抗现象[2]。
氯吡格雷是一种前体类药物,本身不具备药物活性,需要通过肝脏CYP450酶的氧化代谢才能产生生物活性。目前认为CYP2C19是人体中参与氯吡格雷活化的主要CYP450酶[8]。现有的大量研究发现CYP2C19基因具有多态性,也证实CYP2C19基因多态性是影响氯吡格雷抗血小板作用的重要内在因素。鉴于CYP2C19基因在不同种群中有着明显差异的突变频率,同时又是多种药物代谢的关键酶,故进行CYP2C19基因检测,进一步了解其基因型后,可个体化治疗,同时避免经同一代谢酶代谢的药物在体内相互竞争而产生的不良反应。周健等[9]在前期的研究中发现,CYP2C19基因快代谢(EM,*1/*1)、中等代谢(IM,*1/*2,*1/*3)和慢代谢(PM,*2/*2,*3/*3,*2/*3) 在人群中的分布频率分别为42.4%、43.4%和14.2%。刘涛等[10]通过对145例行PCI手术的冠心病患者的CYP2C19基因型检测发现,携带野生型等位基因(*1/*1)为39.31%;携带突变杂合型等位基因(*1/*2、*1/*3)为47.59%,其中携带*1/*2等位基因为42.07%、携带*1/*3等位基因为5.52%;携带突变纯合型等位基因(*2/*2、*2/*3、*3/*3)为 13.1%,其中携带 *2/*2等位基因为8.97%、携带*2/*3等位基因为2.76%、携带*3/*3等位基因为1.38%。赵冠人等[11]对176例诊断为ACS并接受PCI手术的患者进行CYP2C19基因检测,结果提示,其各基因型所占比例:*1/*1为 42.05%,*1/*2为 32.95%,*1/*3为9.09%,*2/*2为 9.66%,*2/*3为 6.25%,*3/*3为0%。本研究通过对我院210例行PCI手术的冠心病患者进行CYP2C19基因检测,发现其基因型分布情况是:*1/*1为94例(44.8%)、*1/*2为79例(37.6%)、*1/*3为 12例(5.71%)、*2/*2为 20例(9.52%)、*2/*3为 4例(1.90%)、*3/*3为 1例(0.48%),其中EM型94例(44.8%)、IM型91例(43.3%)、PM型25例(11.9%)。这与上述多项试验研究结果大致相同,说明CYP2C19基因在中国人群中确实存在较高的突变率,其中CYP2C19*2等位基因突变率最高。
目前相关研究表明,CYP450酶系统中CYP2C19酶在氯吡格雷形成代谢活性产物、产生抗血小板作用中扮演重要角色,故在氯吡格雷的代谢过程中,CYP2C19基因多态性起了重要的作用[12]。有关研究显示,CYP2C19*2、CYP2C19*3突变基因与氯吡格雷抵抗有关,应用氯吡格雷后血小板未能得到充分抑制,从而导致严重支架内血栓形成等不良心血管事件[13,14]。Brandt等[5]的研究表明,单次给予300 mg氯吡格雷后,CYP2C19*2变异等位基因携带者(*1/*2或*2/*2基因型)与CYP2C19*2和CYP2C19*3变异等位基因携带者中氯吡格雷的活性代谢物浓度明显低于两种野生型等位基因携带者。Mega等[15]通过对数个临床试验研究分析发现,无论给予何种剂量氯吡格雷,携带1种或2种CYP2C19变异等位基因者与野生型携带者相比,其氯吡格雷活性代谢物的浓度更低,且在PM型、IM型、EM型中存在明显的梯度效应。本研究发现,不同基因型组患者的血小板抑制率差异有统计学意义(P<0.01),其中PM型患者的血小板抑制率最低,IM型次之;不同基因型组患者的氯吡格雷抵抗情况差异有统计学意义(P<0.01),其中PM型患者的CR远高于另外两组。本研究中共有43例(20.5%)患者的血小板抑制率低于50%,即出现氯吡格雷抵抗现象,其中慢代谢型组发生率最高为21例(84%)。这一结果与目前国内外相关研究报道氯吡格雷抵抗的发生率4%~32%基本相似[16]。综上,本研究结果及国外相关研究结果大致相同,均证实携带1种或2种CYP2C19变异等位基因的个体活化氯吡格雷的能力明显降低。2010年3月美国FDA发布氯吡格雷说明书的“黑框警示”,建议临床医师在给患者使用氯吡格雷之前进行CYP2C19基因型检测,便于了解患者氯吡格雷的代谢能力,以及时调整给药剂量[17]。
本研究结果表明,CYP2C19不同基因型对氯吡格雷抗血小板作用的影响存在显著差异,其中携带CYP2C19*2或*3突变等位基因的PCI手术患者发生CR的风险明显增加。因此,临床中对于基因型为IM型患者,应加倍氯吡格雷的负荷剂量及维持剂量,或者加用西洛他唑等第3种抗血小板药;对于基因型为PM型患者应改用新型抗血小板药,如普拉格雷或替格瑞洛。综合目前国内外大量临床试验研究,可明确CYP2C19基因多态性对氯吡格雷抗血小板活性起到内在的关键作用,故在临床治疗过程中,早期通过检测ACS或PCI手术患者的CYP2C19基因多态性及血小板抑制率,筛选出CR的高危人群,根据其基因型资料、血小板抑制率实施个体化治疗方案,以减少支架内血栓形成或再狭窄等心血管不良事件的发生,大大改善患者的预后。
由于本研究受到临床病例数的限制,且氯吡格雷的反应性差异受多种因素的影响,除了CYP2C19基因多态性这一重要的内在因素外,还受到多种药物如地西泮、奥美拉唑、兰索拉唑等,以及糖尿病、肾功能不全等外在因素的影响,故试验结果可能存在一定的偏倚。期待今后设计出更为全面的前瞻性、大样本、多中心的双盲随机对照试验方案,以解决上述问题。
(本文图片见后插一)
[1]Sabatine MS,Cannon CP,Gibson CM,et al.Addition of clopidogrel to aspirin and fibrinolytic therapy for myocardial infarction with ST-segment elevation.N Engl J Med,2005,352:1179-1189.
[2]Kyle JE,George AS,Howard LM,et al.Clopidogrel pharmacogenomics and risk of inadequate platelet inhibition:US FDA recommendations.Pharmacogenomics,2009,10:1799-1817.
[3]Bliden KP,DiChiara J,Tantry US,et al.Increased risk in patients with high platelet aggregation receiving chronic clopidogrel therapy undergoing percutaneous coronary intervention:is the currentantiplatelettherapy adequate? J Am CollCardiol,2007,49:657-666.
[4]Gurbel PA,Bliden KP,Samara W,et al.Clopidogrel effect on platelet reactivity in patients with stent thrombosis:results of the CREST Study.J Am Coll Cardiol,2005,46:1827-1832.
[5]Brandt JT,Close SL,Iturria SJ,et al.Common polymorphisms of CYP2C19 and CYP2C9 affect the pharmacokinetic and pharmacodynamic response to clopidogrel but not prasugrel.J Thromb Haemosta,2007,5:2429-2436.
[6]Fontana P,Senouf D,Mach F.Biological effect of increased maintenance dose of clopidogrel in cardiovascular outpatients and influence of the cytochrome P450 2C19*2 allele on clopidogrel responsiveness.Thromb Res,2008,121:463-468.
[7]夏金喜,肖建民,万德立,等.急性冠脉综合征PCI术后患者CYP2C19*2、CYP2C19*3基因多态性与氯吡格雷抵抗及临床预后的关系.中国心血管病研究,2015,13:731-734.
[8]Frere C,Cuisset T,Morange PE,et al.Effect of cytochrome P450 polymorphisms on platelet reactivity after treatment with clopidogrel in acute coronary syndrome.Am J Cardiol,2008,101:1088-1093.
[9]周健,吕虹,康熙雄.中国汉族人群不同性别、年龄、体重指数之间细胞色素氧化酶CYP2C19基因多态性的检测.中国临床药理学与治疗学,2007,12:208-213.
[10]刘涛,李妍,尹涛,等.CYP2C19基因多态性与冠心病危险因素对氯吡格雷抵抗的影响.现代生物医学进展,2012,12:1265-1269.
[11]赵冠人,冯端浩,李素,等.CYP2C19基因多态性与氯吡格雷ADP抑制率的相关性研究.中国药师,2013,16:479-482.
[12]Goswami S,Cheng-Lai A,Nawarskas J.Clopidogrel and genetictesting:Isitnecessary foreveryone? CardiolRev,2012,20:96-100.
[13]Mega JL,Simon T,Collet JP,et al.Reduced-Function CYP2C19 genotype and risk of adverse clinical outcomes among patients treated with clopidogrel predominantly for PCI:a metaanalysis.JAMA,2010,304:1821-1830.
[14]Price MJ,Murray SS,Angiolillo DJ,et al.Infulence of genetic polymorphismson the effectofhigh-and-standard-dose clopidogrel after percutaneous coronary intervention the GIFT(Genotype Information and Functional Testing) study.J Am Coil Cardiol,2012,59:1928-1937.
[15]Mega JL,Close SL,Wiviott SD,et al.Cytochrome P-450 polymorphisms and response to clopidogrel.N Engl J Med,2009,360:354-362.
[16]柳亚敏,刘乃丰.氯吡格雷反应变异性的临床及基因学研究进展.中华心血管病杂志,2010,38:759-762.
[17]Holmes DR,Dehmer GJ,Kaul S,et al.ACCF/AHA clopidogrel clinical alert:approaches to the FDA"boxed warning":a report of the American College of Cardiology Foundation Task Force on clinical expert consensus documents and the American Heart Association endorsed by the Society for Cardiovascular Angiography and Interventions and the Society of Thoracic Surgeons.J Am Coll Cardiol,2010,56:321-341.
Association between CYP2C19 gene polymorphism and platelet inhibition rate in patients undergoing PCI surgery
ZHUANG Jin-long,DENG Jie-xi,CHEN Jin-song,et al.Department of Cardiology,the 175th Hospital of PLA,Zhangzhou 363000,China
DENG Jie-xi,E-mail:dengjiexi@medmail.com.cn
Objective To evaluate the effect of CYP2C19 gene polymorphism on platelet inhibition rate in patients with percutaneous coronary intervention (PCI).MethodsThis study included 210 patients with coronary heart disease who underwent PCI operation in the Department of Cardiology of the 175th Hospital of PLA In January 2014-2016 April.All patients were taken venous blood samples were extracted from peripheral blood genomic DNA,PCR amplification and purification,gene chip hybridization,by detecting CYP2C19 gene microarray reader,the patients were grouped according to different genotypes.Venous blood samples were taken after taking the load of Aspirin+Clopidogrel 24 h,and then the two platelet phosphate(ADP)-induced platelet inhibition rate was calculated automatically by using TEG.ResultsIn 210 patients the ratio of genotype selected were(*1/*1)94 cases(44.8%),(*1/*2)79 cases(37.6%),(*1/*3)12 cases(5.7%),(*2/*2)20 cases(9.5%),(*2/*3)4 cases(1.9%),(*3/*3)in 1 cases(0.5%),in which a fast metabolism type(EM type)94 cases(44.8%),secondary metabolism type(IM type)91 cases(43.3%),slow metabolism(PM type)25 cases(11.9%),a total of 43 patients(20.5%)appeared the phenomenon of Clopidogrel resistance(CR).Patients with different genotypes showed significant differences in platelet inhibition rate(P<0.01),in which patients with type PM platelet inhibition rate was the lowest,followed by type IM;resistance of different genotype groups of Clopidogrel was statistical-ly significant(P<0.01),the CR of patients with type PM was much higher than the other two groups.ConclusionThere are significant differences in the antiplatelet effects of CYP2C19 with different genotypes,and the risk of CR is significantly increase in PCI operated patients with CYP2C19*2 or*3 mutation allele.
CYP2C19; Gene polymorphism; Platelet inhibition rate
解放军第一七五医院青年苗圃基金(项目编号:13Y011)
363000 福建省漳州市,解放军第一七五医院心内科
邓节喜,E-mail:dengjiexi@medmail.com.cn
10.3969/j.issn.1672-5301.2017.06.011
R541.4
A
1672-5301(2017)06-0518-05
2016-12-27)
