不同时间介入电针治疗对骨癌痛吗啡耐受大鼠的疗效评价
2017-06-21付桃芳杜俊英陈宜恬房军帆梁宜方剑乔
付桃芳 杜俊英 陈宜恬 房军帆 梁宜 方剑乔
浙江中医药大学第三临床医学院杭州310053
不同时间介入电针治疗对骨癌痛吗啡耐受大鼠的疗效评价
付桃芳 杜俊英 陈宜恬 房军帆 梁宜 方剑乔
浙江中医药大学第三临床医学院杭州310053
[目的]观察Walker256乳腺癌细胞所致骨癌痛吗啡耐受大鼠的模型特点及不同时间介入电针治疗对骨癌痛吗啡耐受大鼠的疗效。[方法]清洁级健康雌性SD大鼠53只,随机分为6组:假手术组(Sham)、骨癌痛组(BCP)、骨癌痛-吗啡耐受组(MT)、电针Ⅰ组(EA I)、电针Ⅱ组(EA II)、假电针组(ShamEA)。除sham组外,将10μL Walker256乳腺癌细胞(1×105cell)注入各组大鼠左侧胫骨髓腔内,于术后7d,将MT组、EAⅠ组、EAⅡ组、sham EA组骨癌痛制备成功的大鼠行腹腔注射盐酸吗啡(10mg·kg-1,2次/d)连续11d,诱导骨癌痛-吗啡耐受模型。EA I组于吗啡耐受前(即术后7d)介入电针干预,采用2/100Hz电针,刺激双侧“足三里”和“昆仑”穴,连续刺激18d;EA II组于吗啡耐受后第1d(即术后18d)介入电针治疗,方法同EAⅠ组,连续治疗7d;ShamEA组大鼠仅给予针刺破皮,不予通电治疗,其穴位及治疗时间同EA II组。观察大鼠患侧机械缩足阈(paw withdrawal thresholds,PWT)评价电针治疗效果。[结果]癌细胞接种后第6d(即术后6d),BCP组和MT组大鼠患侧PWT均明显低于Sham组大鼠(P<0.01)。吗啡注射第1d,MT组大鼠患侧PWT显著高于BCP组大鼠(P<0.01);吗啡连续注射11d(术后17d)后MT组大鼠PWT下降至BCP组大鼠同等水平(P>0.05)。吗啡耐受前介入电针干预后第9d~13d(即术后第15d~19d),EA I组大鼠PWT明显高于MT组大鼠(P<0.05或P<0.01);而术后第20d 至24d,EA I组大鼠PWT与MT组比较无统计学差异(P>0.05)。吗啡耐受后介入电针治疗第1d~7d,EA II组大鼠患侧PWT较MT组和ShamEA组均明显升高(P<0.05或P<0.01)。[结论]骨癌痛大鼠给予腹腔连续注射吗啡11d时,即可成功诱导癌痛大鼠吗啡耐受模型;吗啡耐受前给予电针预刺激可延缓骨癌痛大鼠吗啡耐受产生;吗啡耐受后给予电针治疗可部分翻转骨癌痛大鼠吗啡耐受效应。
骨癌痛;吗啡耐受;电针;干预时间;疗效
据统计,骨转移癌的发生率占乳腺癌、肺癌、前列腺癌等原发恶性肿瘤的30%~80%[1],其中乳腺癌骨转移的发生率高达70%~80%[2]。骨转移癌可引起剧烈疼痛,甚至发生病理性骨折,严重影响晚期癌症患者的生存质量。吗啡是临床治疗重度癌痛的“金标准”药物,但长期使用易产生吗啡耐受[3](吗啡镇痛效应减弱,需增加药物剂量才能达到有效的镇痛作用)。吗啡耐受不仅严重限制了吗啡在临床的使用率,而且也是晚期癌痛难以控制的主要原因。目前针灸治疗癌痛已成为美国国立综合癌症网络(national comprehensive cancer network,NCCN)发布的肿瘤临床实践应用指南——NCCN癌症治疗指南,并取得较好的镇痛疗效
[4]。但电针在癌痛大鼠吗啡耐受治疗领域研究甚少,尤其对吗啡耐受有关针刺介入时间与干预效应的研究至今无报道。本研究欲探讨不同时间介入电针刺激对癌痛-吗啡耐受的疗效评估,以期为临床治疗时机提供相应依据并明确电针对癌痛吗啡耐受不同阶段的治疗作用。
1 材料与方法
1.1 实验动物与分组清洁级健康雌性SD大鼠53只,体质量150~180g,购自上海斯莱克实验动物有限公司,由浙江中医药大学实验中心饲养,饲养期间给予啮齿动物标准颗粒饲料和饮水,12h循环灯光,恒温20~24℃,恒湿50%~70%。所有实验大鼠处置均符合科技部2006年颁布的《关于善待实验动物的指导性意见》。动物许可证编号SCXK(沪)2013-0016。将实验大鼠随机分为6组:假手术组(文中用Sham表示),10只;骨癌痛组(文中用BCP表示),8只;骨癌痛-吗啡耐受组(文中用MT表示),8只;电针Ⅰ组(文中用EA I表示),8只;电针Ⅱ组(文中用EA II表示),8只;假电针组(文中用ShamEA表示),11只。
1.2 实验试剂及仪器Walker256大鼠乳腺癌细胞株(北京北纳创联生物技术研究院,3111C0001CCC-000316),盐酸吗啡注射液(东北制药集团沈阳第一制药有限公司,130105-1),RPMI1640培养基(美国Gibco公司,1744359),胎牛血清(美国Gibco公司,1527494),青霉素-链霉素溶液(碧云天生物技术研究所,C0222),0.25%胰酶(美国Gibco公司,1676922),无菌骨蜡(美国强生公司,W810T)。细胞计数仪(美国BioRed公司,TC10),台式低速离心机(上海Anke公司,TDL-60C),二氧化碳培养箱(美国Thermo公司,3111),显微镜(德国徕卡公司,DM2500),动态足底测量仪(意大利UGO BASILE公司,37450),韩式电针仪(北京华卫产业开发公司HANS-200A),针灸针(苏州医疗用品厂,华佗牌,Φ0.25mm×13mm)。
1.3 骨癌痛-吗啡耐受大鼠模型
1.3.1 Walker256大鼠乳腺癌细胞制备将液氮中冻存的Walker256细胞进行复苏、传代培养。将细胞置于RPMI-1640培养基(含10%胎牛血清,1%青-链霉素)培养7d。造模当天对培养瓶中悬浮生长的细胞用无菌PBS液清洗,1200r/min离心3min,收集细胞悬液,细胞计数板读数后配制成浓度为1×107cells/mL的细胞悬液,置于冰上备用。
1.3.2 模型建立所有实验大鼠术前禁食1d,手术当天采用10%水合氯醛溶液以0.35mL/100g腹腔注射麻醉后,左腿备皮消毒,距膝关节下约2cm处切开皮肤,暴露胫骨。除Sham组大鼠外,其余5组大鼠均参照文献[5-6]制备骨癌痛,采用10μL微量注射器将Walker256大鼠乳腺癌细胞悬液10μL(1×105细胞)缓慢注射于左胫骨髓腔内,无菌骨蜡封孔,无菌0.9%氯化钠溶液冲洗,缝合后,肌注0.2 mL青霉素钠溶液。Sham组大鼠仅注入等量的无菌磷酸盐缓冲液(PBS)10μL。于术后7d,将MT组、EAI组、EAII组、Sham EA组骨癌痛制备成功大鼠每日以10mg·kg-1的剂量腹腔注射盐酸吗啡注射液(10mg·mL-1),每12h注射1次(早上9:00,晚上9:00),连续注射11d,以大鼠机械缩足阈(paw withdrawal thresholds,PWT)下降约50%~70%(即机械痛觉过敏)为骨癌痛及癌痛-吗啡耐受成功的指标。
1.4 分组处理Sham组及BCP组:术后不给予任何处理。MT组:骨癌痛-吗啡耐受模型制备成功后,仍给予10mg·kg-1的剂量腹腔注射盐酸吗啡注射液(10mg·mL-1),每12h注射1次(早上9:00,晚上9:00),连续注射至术后第24d。EA I组:于术后第7d开始给予吗啡腹腔注射(10mg·mL-1),每12h注射1次(早上9:00,晚上9:00),且于上午9:00吗啡注射0.5h后介入电针治疗,采用2/100Hz电针,取双侧“足三里”和“昆仑”穴,0.5mA~1.5mA,每10min递增0.5mA,30min/次,1次/d,直至术后第24d。EA II组:于骨癌痛-吗啡耐受模型制备成功之后开始介入电针治疗,即术后第18d仍给予吗啡注射(注射剂量及时间同MT组),且于上午9:00吗啡注射0.5h后介入电针治疗,电针刺激参数同EAI组,连续治疗7d。ShamEA组:于骨癌痛-吗啡耐受模型制备成功之后开始介入假电针治疗,即术后第18d仍给予吗啡注射(注射剂量及时间同MT组),且于上午9:00吗啡注射0.5h后仅给予针刺破皮,不通电治疗,其穴位及治疗时间同EAII组。
1.5 大鼠PWT检测分别在Walker256癌细胞接种前1d(base),术后第6至24d检测各组大鼠PWT(图1)。将大鼠置于铁丝网上11.5×17×14cm大小的透明有机玻璃箱内适应环境,待大鼠安静后(停止理毛和行为探索,约15min),将仪器上的直径约0.5mm的细丝对准大鼠左侧足底(4个足垫空隙之间),以2.5g/sec刺激,最大刺激量为50g,刺激后大鼠快速缩足为阳性反应,大鼠缩足时的力量(单位:g)即为其PWT。每只大鼠测量5次,每次间隔3~5min,去掉最大值和最小值取其平均值即为PWT。

图1 实验操作流程示意图Fig.1 The sketch map of flow of experimental operation
2 结果
2.1 骨癌痛大鼠PWT变化和吗啡耐受出现时点癌细胞接种术前(base),Sham组、BCP组及MT组大鼠之间患侧PWT比较均无统计学差异(P>0.05)。术后第6d,与Sham组大鼠比较,BCP组与MT组大鼠患侧PWT均明显下降,差异有统计学意义(P<0.01),提示骨癌痛手术成功。术后第7d(即吗啡注射第1d),MT组大鼠患侧PWT为48.29±0.97g,均显著高于BCP组和Sham组大鼠,差异有统计学意义(P<0.01)。随着吗啡连续注射,MT组大鼠患侧PWT呈逐渐下降趋势。至术后第17d(即吗啡注射第11d),MT组与BCP组大鼠比较无统计学差异(P>0.05);但MT组、BCP组大鼠患侧PWT分别与Sham组大鼠比较均差异有统计学意义(P<0.01),此时骨癌痛大鼠吗啡耐受产生。见图2。
2.2 电针预刺激可延缓骨癌痛大鼠吗耐受产生课题组观察到术后第17d,MT组大鼠产生吗啡耐受(图2)。吗啡耐受前(术后第7d)进行电针干预刺激,术后第15d~第19d(即电针干预后第9d~第13d)EAI组大鼠PWT开始明显高于MT组大鼠,差异有统计学意义(P<0.05或P<0.01)。术后第20~24d,EA I组大鼠PWT与MT组比较无统计学意义(P>0.05),即EAI组大鼠吗啡耐受产生,说明提前介入电针干预可延缓吗啡耐受的产生。见图3。

图2 骨癌痛-吗啡耐受大鼠PWT变化Fig.2 The change of PWT of bone cancer pain and morphine tolerance rat
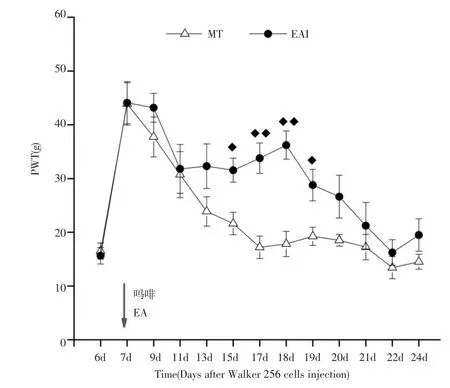
图3 吗啡耐受前电针干预后大鼠的PWT变化Fig.3 The change of PWT of rat with electroacupuncture intervention before morphine tolerance
2.3 电针治疗可部分翻转骨癌痛大鼠吗啡耐受MT组、EA II组、ShamEA组大鼠在接种术前(base)、术后第6d、7d至17d各个时间点PWT,三组间比较均无统计学差异(P>0.05)。电针治疗第1d(术后18d),EA II组大鼠PWT为32.87±4.86g,同MT组和ShamEA组大鼠比较均显著增加,差异有统计学意义(P<0.01);同样电针治疗第2d、5d、7d,EA II组大鼠PWT仍明显高于其他两组大鼠(P<0.01或P<0.05)。而ShamEA组大鼠见各个时间点PWT与MT组比较均无统计学意义(P>0.05)。见图4。
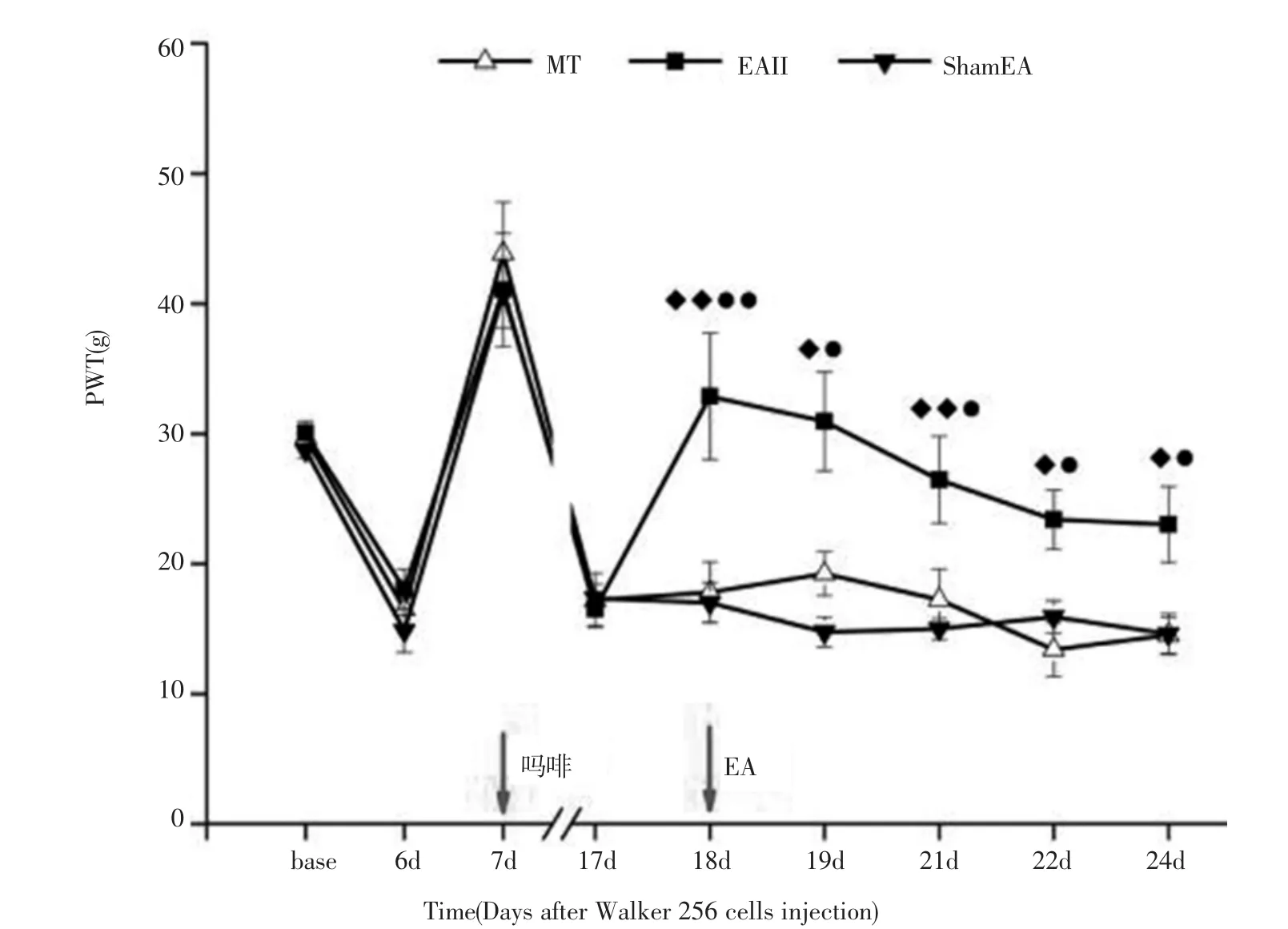
图4 电针对骨癌痛-吗啡耐受大鼠机械缩足阈影响Fig.4 Effect of electroacupuncture on the PWT of bone cancer pain and morphine tolerance rat
3 讨论
目前癌痛患者普遍存在阿片耐受与痛觉过敏现象,以吗啡为代表的阿片类药物依赖及镇痛耐受发生率高达35%~57%[7]。痛觉过敏是一种常见的临床现象,以疼痛阈值降低和伤害性刺激的敏感性增强为特征[8]。最新研究发现,围术期应用阿片类药物可引起机体对正常痛刺激的反应性增高,导致阿片类药物镇痛效应的敏感性降低,出现反常性疼痛,即阿片类药物诱发的痛觉过敏(opioid-induced hyperalgesia,OIH)[9-10]。目前,国内外对阿片耐受形成的验证均采用痛觉过敏的检测[11-12]。
常见骨癌痛模型接种的癌细胞主要集中于溶骨性NCTC2472纤维肉瘤细胞、MRMT-1乳腺癌细胞、AT-3.1前列腺癌细胞、Walker256乳腺癌细胞及Lewis肺癌细胞[13]。本研究将Walker256乳腺癌细胞注入大鼠胫骨髓腔内,制备转移性骨癌痛,结果显示Walker256乳腺癌细胞接种6d后,BCP组大鼠机械缩足阈较Sham组相比显著下降(P<0.01),表明骨癌痛制备成功,与以往研究报道的机械痛敏时间相符[5]。骨癌痛大鼠以每天10mg·kg-1的剂量吗啡腹腔连续注射11d,2次/d,发现吗啡注射第1d时MT组大鼠PWT高达48.29±0.97g,说明吗啡即刻镇痛作用明显,但连续腹腔注射吗啡11d后大鼠机械痛阈下降至同期骨癌痛组水平,此时吗啡镇痛无效,说明大鼠机械痛觉过敏,即癌痛吗啡耐受模型建立,与以往研究结果较为相似[14]。张亚军等[15]采用Walker256乳腺癌细胞注入大鼠胫骨髓腔内后再行鞘内注射吗啡(20μg· kg-1,2次/d)连续9d,同样建立骨癌痛-吗啡耐受模型。由于吗啡给药途径不同,而鞘内给药后诱导的癌痛-吗啡耐受发生的时间点相对较早。但本实验认为鞘内给药直接造成大鼠2次手术伤害,易增加大鼠死亡率,采用腹腔注射方式对大鼠伤害性小。
电针镇痛(electroacupimcture,EA)是一种有效的镇痛方法,可以有效地治疗各种急、慢性炎性痛和癌痛。有研究发现,电针镇痛有着穴位特异性,双侧足三里电针刺激可明显延长缩爪时间,而手三里和内关穴无此类似作用[16]。刺激“足三里”穴而非“肾俞”穴可减缓吗啡镇痛耐受,逆转吗啡行为敏化形成[17],本研究选大鼠双侧“足三里”和“昆仑”穴作为骨癌痛-吗啡耐受大鼠电针镇痛的穴位。此两个穴为具体参照《大鼠穴位图谱研制》[18],足三里穴位于膝关节后外侧,腓骨小头下约5mm处,昆仑穴位于后肢外踝与跟腱之间的凹陷中。
研究认为,电针通过促进内源性阿片肽的释放或激活阿片受体以发挥其镇痛的作用[19],不同的电针频率对电针镇痛效果起不同的作用。研究已表明,2Hz电针主要激活脑啡肽、内啡肽和内吗啡肽,作用于μ 和δ阿片受体而产生镇痛,100Hz电针激活强啡肽作用于κ阿片受体产生镇痛[20-21]。2/100Hz电针均可激活μ、δ及κ三种阿片受体类型发挥镇痛效应[22-23]。有实验证明,2/100Hz经皮刺激于应用吗啡的患者,可以降低其吗啡耐受的发生几率[24]。郑宇欣等[25]采用2/ 100Hz电针可以延缓炎性痛大鼠吗啡耐受的产生。
本实验中,2/100Hz电针刺激双侧足三里和昆仑穴可增强吗啡的镇痛作用。EA I组于术后第7d(吗啡耐受前)给予电针干预刺激,在电针干预后第9d(即术后第15d),EA I组大鼠PWT高于同期MT组大鼠(P<0.05),一直持续至术后第19d。而于术后20d,EAI组与同期MT组大鼠PWT无差异,提示此时,EAI组大鼠吗啡耐受产生,表明电针预刺激可以延缓吗啡耐受出现,但不能完全阻止其出现。于吗啡耐受后(术后18d)介入电针治疗1周,电针治疗后1~7d,EA II组大鼠PWT均显著高于同期MT组和ShamEA组大鼠(P<0.05或P<0.01),说明电针治疗能提高骨癌痛-吗啡耐受大鼠的机械痛阈,具有翻转吗啡耐受作用。
综上所述,提前介入电针干预可延缓骨癌痛吗啡耐受的产生,而吗啡耐受后介入电针治疗能够拮抗吗啡耐受效应,但电针翻转吗啡耐受是否呈持续性或周期性变化及相关机制,还有待进一步研究。
References:
[1]李新经.多发性骨转移癌核素及放射治疗临床疗效[J].医疗装备,2016,29(16):29-30. LI Xinjing.The clinical efficacy of radionuclide therapy for multiple bone metastases[J].Medical Equipment,2016, 29(16):29-30.
[2]栾梅香,杨勇姜,玉秋,等.乳腺癌骨转移的研究进展[J].中国普外基础与临床杂志,2016,23(2):253-256. LUAN Meixiang,YANG Yongjinag,YU Qiu,et al.Research progress in bone metastasis of breast cancer[J]. Chinese Surgery Foundation and clinical journal,2016,23 (2):253-256.
[3]唐淑洁,张佳琦,刘洋,等.洛芬待因与吗啡交替服用减少吗啡在癌痛患者中的耐药性[J].中国医学创新,2016,13(6): 29-31. TANG Shujie,ZHANG Jiaqi,LIU Yang,et al.Codeine and morphine morphine alternate taking reducing drug resistance in cancer patients[J].Chinese medical innovation, 2016,13(6):29-31.
[4]Paley CA,Bennett MI,Johnson MI.Acupuncture for cancer-induced bone pain[J].Evid Based Complement Alternat Med,2011,8(1):1093-1020.
[5]黄宇光,陈雯,王静捷.用Walker256大鼠乳腺癌细胞建立大鼠胫骨癌痛模型[J].协和医学杂志,2011,4(2):350-356. HUANG Yuguang,CHEN Wen,WANG Jingjie.To establish a rat model of tibial cancer pain with the Walker256 breast cancer cells[J].Xiehe Medical Journal,2011, 4(2):350-356.
[6]司马蕾,厉建春,蔡淑呈,等.P物质和降钙素基因相关肽在骨癌痛-吗啡耐受模型中的表达[J].中国癌症杂志,2012,22 (8):561-565. SI Malei,LI Jiangchun,CAI Shuceng,et al.The expression of substance.P and calcitonin gene related peptide in bone cancer pain and morphine tolerance model[J]. China Journal of cancer,2012,22(8):561-565.
[7]Anand KJ,Willson DF,Berger J,et al.Tolerance and Withdrawal From Prolonged Opioid Use in Critically Ill Children[J].PEDIATRICS,2010,125(5):1208-1225.
[8]高强,原大江.痛觉过敏机制的研究新进展[J/CD].中华临床医师杂志:电子版,2016,10(8):1172-1177. GAO Qiang,YUAN Dajiang.Research progress of hyperalgesia mechanism[J/CD].Chinese Journal of clinicians: electronic edition,2016,10(8):1172-1177.
[9]Chapman CR,Lipschitz DL,Angst MS,et al.Opioid pharmacotherapy for chronic non-cancer pain in the U-nited States:aresearch guideline for developing an evidence-base[J].J Pain,2010,11(9):807-829.
[10]Manchikanti L,Vallejo R,Manchikanti KN,et al.Effectiveness of long-term opioid therapy for chronic noncancer pain[J].Pain Physician,2011,14(2):E133-E156
[11]Matsushita Y,Ueda H.Curcumin blocks chronic morphine analgesic tolerance and brain-derived neurotrophic factor upregulation[J].Neuroreport,2009,20(1):63-68.
[12]Powell KJ,Quirion R,Jhamandas K.Inhibition of neu-rokinin-1-substance P receptor and prostanoid activity prevents and reverses the development of morphine tolerance in vivo and the morphine-induced increase in CGRP expression in cultured dorsal root ganglion neurons[J]. Eur J Neurosci,2003,18(6):1572-1583.
[13]梁宜,杜俊英,房军帆,等.常用骨癌痛动物模型的共性特点和特征分析[J].中华肿瘤杂志,2014,36(12):949-951. LIANG Yi,DU Junying,FAN Junfang,et al.Common features and characteristics of the commonly used animal model of bone cancer pain[J].Chinese Journal of oncology,2014,36(12):949-951.
[14]Hassanzadeh K,Khodadadi B,Moloudi MR,et al.A new pharmacological role for thalidomide:Attenuation of morphine-induced tolerance in rats[J].ActaAnaesthesiol Taiwan,2016,54(2):65-69.
[15]张亚军,田玉科,杨承祥,等.大鼠骨癌痛-慢性吗啡耐受模型的建立[J].中华麻醉学杂志,2011,36(1):63-66. ZHANG Yajun,TIAN Yuke,YANG Chenxiang,et al.To establish a rat model of bone cancer pain and chronic morphine tolerance model[J].Chinese Journal of Anesthesiology,2011,36(1):63-66.
[16]李娜,李为民,陈颖波,等.电针对完全弗氏佐剂性小鼠外周慢性炎症痛的缓解作用[J].中国针灸,2008,28(2):122-126. LI Na,LI Weiming,CHEN Yibo,et al.ElectroacupuncturealleviatescompleteFreund'sadjuvantperipheral chronic inflammatory pain in mice[J].China Acupuncture, 2008,28(2):122-126.
[17]王珂,刘惠芬,周文华.“足三里”和“肾俞”穴位埋线对大鼠吗啡镇痛和运动行为敏化的影响[J].中国针灸,2008, 28(7):509-513. WANG Ke,LIU Huifen,ZHOU Wenhua.Influence of" Zusanli"and"Shenshu"acupoint catgut embedding on morphine analgesia and locomotor sensitization in the rat [J].China Acupuncture,2008,28(7):509-513.
[18]华兴邦,周浩良.大鼠穴位图谱的研制[J].实验动物与动物实验,1991(1):1-5. HUA Xingban,ZHOU Haoliang.Development of rat acupointatlas[J].Experimental Animal and Animal Experiment, 1991(1):1-5.
[19]Zhang Y,Li A,Lao L,et al.Rostral ventromedial medulla mu,butnotkappa,opioidreceptorsareinvolvedin electroacupuncture anti-hyperalgesia in an inflammatory pain rat model[J].Brain Res,2011(1395):38-45.
[20]Han JS,Wang Q.Mobilization of specific neuropeptides by peripheral stimulation of identified frequencie[J].New sPhysiolSci(USA),1992(7):176-180.
[21]Han Z,Jiang YH,Wan Y,et al.Endomo rphin-1mediates 2Hz but not 100Hz electroacupuncture analgesia in the rat[J].NeuroscLett,1999(274):75-78.
[22]Chen XH,Han JS.Analgesia induced by electroacupunctureofdifferentfrequenciesismediatedbydifferent types of opioid receptors:another cross-tolerance study[J]. Behavioural Brain Res,1992(47):143-149.
[23]韩济生.针刺镇痛频率特异性的进一步证明[J].针刺研究, 2001(3):224-227. HAN Jishen.Further proof of the specificity of acupuncture analgesia[J].Acupuncture research,2001(3):224-227. [24]Hamza MA,White PF,Ahmed HE,et al.Effect of the frequency of transcutaneous electrical nerve stimulation on the postoperative opioid analgesic requirement and recovery profile[J].Anesthesiology,1999,91(5):1232-1238.
[25]郑宇欣,于泳浩,王国林.电针刺激对炎性痛大鼠吗啡耐受形成影响的研究[J].中国现代医学杂志,2009,19(9):1315-1318. ZHEN Yuxin,YU Yonghao,WANG Guolin.Study on effects of electroacupuncture on formation of morphine tolerance in rats with inflammatory pain[J].Chinese Journal of Modern Medicine,2009,19(9):1315-1318.
Analgesia Effect of Electroacupuncture at Different Time on Morphine Tolerance in Rats with Bone Cancer Pain
FU Taofang,DU Junying,CHEN Yitian,et al The Third Clinical Medical College,Zhejiang Chinese Medicine University,Hangzhou(310053),China
[Objective]Investigating the characteristic of morphine tolerance model in rats with bone cancer pain induced by Walker 256 breast cancer cell and observating the therapeutic effect of electroacupuncture(EA)at different time on morphine tolerance.[Methods]The 53 SD rats were randomly divided into 6 groups:sham group(Sham),bone cancer pain group(BCP),bone cancer pain+morphine tolerance group(MT),EA I group(EAⅠ),EA II group(EAⅡ),ShamEA group(ShamEA).The 10μL Walker 256 breast cancer cells(1×105)were injected into left tibial bone marrow cavity of rat.At 7 days after surgery,the successful preparation of bone cancer pain in rats by intraperitoneal injecting morphine hydrochloride continuous 11d(10mg·kg-1,q12h)to induce morphine tolerance.Before morphine tolerance(Seventh day after operation),rats in EA I group were treated with electroacupuncture,which had been lasted for 18 days.The first day after morphine tolerance,rats in EA II group were involved in EA treatment,continuing for 7 days.EA was applied to bilateral“Zusanli”(ST36)and“Kunlun”(BL60).Rats in Sham EA group were only given acupuncture to break the skin,and no electricity,the acupoint and treatment time were consistent with EA II group.Observing the changes of PWT to evaluate the effect of EA.[Results]After 6 days of the cancer cells were inoculated,the PWT of the BCP group and MT group was significantly lower than that of the Sham group(P<0.01).The first day after morphine injection,the PWT of MT group was significantly higher than those of the BCP group(P<0.01).With morphine for 11 consecutive days(17 days after operation),the PWT of MT group was decreased to the same level of the BCP group(P>0.05).At 9d to 13d after EA intervention,the PWT of EA I group was significantly higher than those of MT group(P<0.05 or P<0.01),before the morphine tolerance established.To 20 days after operation,there was no significant difference between the EA II group and MT group(P>0.05).After the model of morphine tolerance was established,at 1d to 7 days after EA analgesia,the PWT of EA II group was significantly higher than those of MT group and Sham EA group(P<0.05 or P<0.01).[Conclusion]With the intraperitoneal injection of morphine for 14 days,the model of bone cancer pain rat and morphine tolerance can be established.Early intervention of EA stimulation before the formation of morphine tolerance could delay it in rats with bone cancer pain.EA stimulation after the formation of morphine tolerance could partially reverse it in rats with bone cancer pain.
bone cancer pain;morphine tolerance;electroacupuncture;intervention time;therapeutic effect
R245.9
A
1005-5509(2017)06-0447-07
10.16466/j.issn1005-5509.2017.06.001
2016-12-12)
国家自然科学基金(81102643);浙江省自然科学基金(LY14H270016,LQ15H270003);中国博士后基金面上项目(2014M550334);浙江省医药卫生科研项目(2014KYA162)
Fund projects:National Natural Science Foundation of China(81102643);Zhejiang Provincial Natural Science Foundation of China(LY14H270016,LQ15H270003);China Postdoctoral Science Foundation on General Financial Grant Program(2014M550334);Zhejiang Provincial Medical and Health Research Program(2014KYA162)
梁宜,E-mail:liangyiwww@126.com
