Opiorphin在肛肠手术模型大鼠针刺镇痛调节效应中的作用
2017-06-21林玉芳韩薇陈爱文沈卫东
林玉芳韩薇陈爱文沈卫东
1.浙江医院杭州3100132.上海中医药大学3.上海中医药大学附属曙光医院
Opiorphin在肛肠手术模型大鼠针刺镇痛调节效应中的作用
林玉芳1韩薇2陈爱文2沈卫东3
1.浙江医院杭州3100132.上海中医药大学3.上海中医药大学附属曙光医院
[目的]在肛肠手术切口痛模型大鼠中,通过观察各组大鼠的热痛反应时间、血清阿片类物质(opiorphin,OPI)及脑啡肽的表达水平,探索OPI蛋白的镇痛效应机制及其在穴位电针镇痛效应中的调节作用。[方法]将大鼠随机分为空白对照组、模型组、电针组、OPI组、纳洛酮组、纳洛酮+电针组,除空白对照组外,其余5组均建立手术切口痛模型,实施相关干预,于1h后观察各模型大鼠的热痛反应时间,观察结束后将空白对照组、模型组、电针组及OPI组大鼠麻醉猝死后取血清,并用ELISA检测大鼠血清OPI蛋白及脑啡肽的表达水平。[结果]各组大鼠的热痛反应时间在组间比较中差异具有统计学意义(P<0.05);模型组大鼠的热痛反应时间明显短于空白对照组大鼠,差异有统计学意义(P<0.001)。模型组、纳洛酮组和纳洛酮+电针组的热痛反应时间明显短于电针组和OPI组大鼠,差异有统计学意义(P<0.05,P<0.01,P<0.001);模型组大鼠的血清脑啡肽表达较空白对照组显著增加,差异具有统计学意义(P<0.05),电针组血清OPI蛋白较模型组显著增加,差异具有统计学意义(P<0.05)。[结论]电针组及OPI组大鼠的热痛反应时间明显延长,但其镇痛效应可被纳洛酮所阻断,电针干预可能通过促进血清OPI蛋白释放,进而通过阿片受体参与及介导电针对手术切口痛大鼠的镇痛效应,血清脑啡肽在其中的作用有待更进一步的研究确认。
手术切口痛;电针;热痛反应时间;opiorphin;脑啡肽;纳洛酮;针灸
前期针刺麻醉的科研工作已经证明,穴位电针具有减少麻醉药量,镇痛效果明显等作用[1-2]。并且已有研究显示,血清阿片类物质(opiorphin,OPI)、脑啡肽在疼痛调节方面具有重要作用[3-4]。为了研究电针镇痛麻醉在肛肠手术期间的作用机制及OPI的作用效应,先期通过建立肛肠手术切口痛大鼠模型,并观察穴位电刺激在肛肠手术切口痛模型中的镇痛效应和血清OPI、脑啡肽表达的变化情况,探索穴位电刺激可能通过调节OPI、脑啡肽水平发挥镇痛效应的机制,为后续临床试验提供理论基础。
1 材料
1.1 主要试剂OPI ELISA试剂盒(Rapidbio,批号:XSD-20150629);脑啡肽ELISA试剂盒(Rapidbio,批号:XSD-20150607);水合氯醛(上海将来生物科技公司,批号:20150525-0004),其余试剂均为市售分析等级。
1.2 主要设备飞利浦红外线辐射加热灯(功率100W),大鼠固定架(北京创博环球科技公司), “energy”牌无菌针灸针:0.38*40mm(佳健医疗卫生材料有限公司),电针仪:华佗牌SDZ-II型电子针疗仪(苏州医疗用品厂有限公司)。
1.3 实验动物清洁级健康成年雄性SpragueDawley(SD)大鼠30只,7周龄,体质量280-320g,培养于上海中医药大学动物实验中心,室温23土10℃,12小时明暗交替,适应性喂养1周,无不良反应,饮食、饮水正常者,即纳入实验。所有动物处死前8h禁食,自由饮水。
2 方法
2.1 实验动物分组空白对照组:不进行任何干预措施。模型组:固定后只在肛门周围建立手术切口模型,不进行电针干预。电针干预模型组(简称电针组):固定大鼠后,予接通电针针刺内关、神门穴,疏密波,2/100hz,强度以大鼠局部肢体微微抖动,大鼠不嘶叫或不剧烈挣扎甩尾等反应为宜,同时在肛门周围建立手术切口模型,电针干预30min。OPI腹腔注射干预组(简称OPI组):固定大鼠后,用2ml注射器在大鼠右下腹腔注射25ug/ml的OPI注射液,大鼠注射药量为100ug/kg。同时在肛门周围建立手术切口模型。纳洛酮腹腔注射干预组(简称纳洛酮组):固定大鼠后,用2ml注射器在大鼠右下腹腔注射1.5ug/ml的纳洛酮注射液,大鼠注射药量为5ug/kg。同时在肛门周围建立手术切口模型。纳洛酮腹腔注射+电针干预组(简称纳洛酮+电针组):固定大鼠后,用2ml注射器在大鼠右下腹腔注射1.5ug/ml的纳洛酮注射液,大鼠注射药量为5ug/kg,并予接通电针干预,电针干预同电针组。同时在肛门周围建立手术切口模型。
2.2 手术切口痛大鼠模型建立目前用于研究手术疼痛最常用的是足底切口模型,本研究结合前期临床针刺麻醉在肛肠手术过程中的研究结果[5],为进一步探索其临床内在机理,参考足底切口模型建立方法[6],建立了大鼠肛门周围的手术切口痛模型。方法:全程无菌操作。大鼠经固定于特定的大鼠固定架上,呈俯卧位,露出四肢、头、肛门、尾部等部位。碘伏消毒大鼠肛门周围皮肤,用刀片及组织剪在大鼠肛门左右两侧对称做八字形两道手术切口,每个切口1.5cm长,0.5cm深,成功切开后再用带线缝合针将手术切口进行缝合,避免大量流血及切开污染。
2.3 实验动物热痛阈观察光热测痛仪是测定大鼠热痛阈值的常规仪器,本研究参考热痛阈值测定的相关文献[7],使大鼠处于固定后安静的状态,采用飞利浦红外线辐射加热灯做为光热测痛仪,于辐射加热灯的灯罩下再无缝固定链接一锥形铁罩以做聚光调整,于锥形铁罩中央留一直径1cm的圆孔以让红外线通过,光斑直径为1cm,加热灯热源至大鼠肛周的距离为10cm,在模型建立1h后观察大鼠手术切口局部的热痛反应时间,或空白对照组大鼠肛周局部皮肤的热痛反应时间,以反应大鼠热痛阈值。
记录每次辐射热照射到动物手术切口或肛周局部皮肤后出现明显的挣扎行为或嘶叫、甩尾反应的时间。每只测2次,每次相隔约3min,取两次的均值作为该时段热痛阈值。以上所有测痛操作均由同一人完成,测痛过程中防止动物兴奋、抑制或激惹,并注意保持安静的环境。
2.4 实验动物取材观察结束后立即予10%水合氯醛(0.5mL/100g)腹腔注射麻醉,麻醉后空白对照组、模型组、电针组、OPI组予腹主动脉采血,血液静置后离心取上清液,放至-80℃冰箱保存备用。
2.5 酶联免疫吸附测定(ELISA)参照OPI蛋白ELISA试剂盒及脑啡肽ELISA试剂盒的说明书进行操作,以测定血清OPI蛋白和脑啡肽的浓度。根据标准品的浓度及对应的OD值计算出标准曲线的直线回归方程,再根据样品的OD值,在回归方程上计算出对应的样品浓度。每个标本设置两个复孔,重复3次试验。
2.6 统计学方法数据统计采用GraphPad prism 5进行数据分析,结果以“均数±标准差”的形式表示,多组间数据比较采用单因素方差分析,并结合Tukey's Multiple Comparison Test进行两两比较,P<0.05有统计学意义。
3 结果
3.1 OPI及电针干预对手术切口痛大鼠热痛反应时间的影响One-way ANOVA方差分析结果显示:大鼠的热痛反应时间在组间比较中存在统计学差异。模型组大鼠的热痛反应时间明显短于空白对照组大鼠,差异有统计学意义(P<0.001)。模型组、纳洛酮组和纳洛酮+电针组的热痛反应时间明显短于电针组和OPI组大鼠,差异有统计学意义(P<0.05,P<0.01,P<0.001);而模型组、纳洛酮组和纳洛酮+电针组的热痛反应时间之间比较无统计学差异(P>0.05);电针组和OPI组大鼠的热痛反应时间比较亦无统计学差异(P>0.05)。见图1。
3.2 电针干预对手术切口痛大鼠OPI及脑啡肽表达的影响ELISA检测血清指标显示,与空白对照组大鼠比较,模型组大鼠的血清脑啡肽表达增加,差异具有统计学意义(P<0.05),而模型组大鼠的血清OPI蛋白表达无统计学差异(P>0.05)。与模型组相比,电针组血清的OPI蛋白表达呈显著增加,差异有统计学意义(P<0.05),其余组间比较无统计学差异(P>0.05)。见图2。
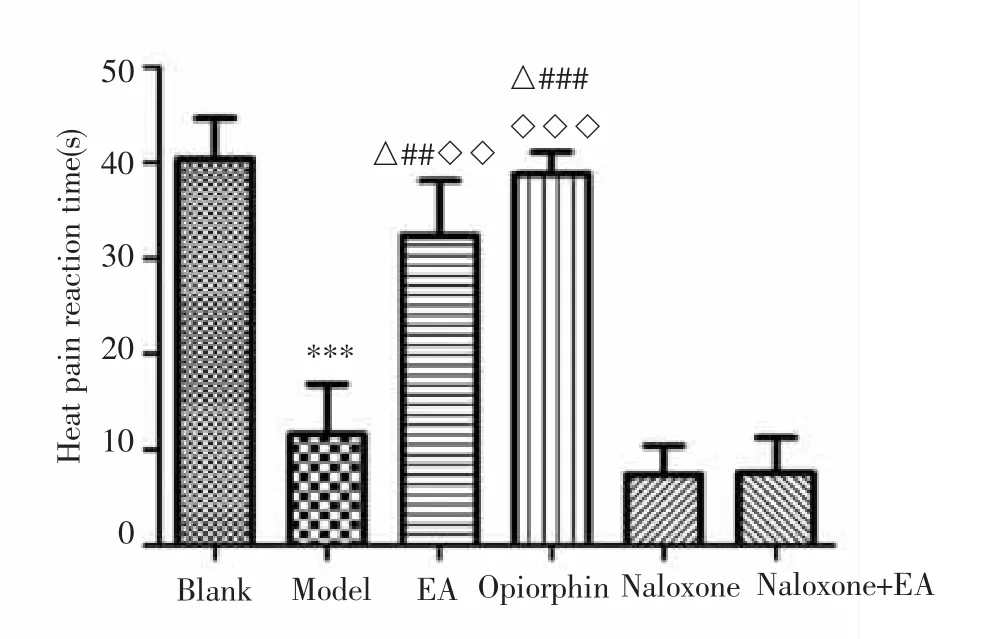
图1 各组大鼠热痛反应时间示意图(mean±SD.secs)Fig.1 Diagrammatic sketch of heat pain response time(mean±SD.secs)
4 分析与讨论

图2 各组大鼠血清OPI、脑啡肽示意图(mean±SD.pg/mL)Fig.2 Diagrammatic sketch of serum opiorphin and enkephalin(mean±SD.pg/mL)
4.1 针刺麻醉镇痛针刺麻醉已应用于临床数十年,具有安全、简便、生理干扰少等优点,临床上被广泛运用于各类外科手术中。国内外对针刺麻醉或镇痛的机理也进行了大量研究,并进行了大量的临床效应研究,取得了显著的临床疗效。本研究在前期临床肛肠手术行针刺麻醉研究的基础上,进一步行动物实验机理研究。
4.2 热痛反应时间一般情况下,当各种刺激达到一定强度时才能够使机体感到疼痛,而能够引起机体感觉到疼痛的最小刺激量即为机体的痛感受阈。痛阈受年龄、性别、性格、心理状态以及致痛刺激的性质所影响。根据刺激性质的不同,又分为机械痛阈、热痛阈、冷痛阈等等类型,本研究所涉及的是大鼠的热痛阈。动物实验研究中,热痛阈值往往以热痛刺激仪刺激后大鼠产生疼痛反应的时间来表示,刺激后引起大鼠疼痛反应的时间越长则热痛阈值越大,反之则越小。本研究中通过观察大鼠被热刺激后引起疼痛样反应的时间即热痛反应时间代表大鼠的热痛阈值情况。
4.3 OPIOPI是由2006年法国巴斯德研究所的Catherine Rougeot小组在人唾液中分离得到一种只有5个氨基酸残基的短肽,也是人体中发现的第一个能够缓解疼痛的天然物质,经ESI质谱检测其相对分子质量为692.5 Da[8]。OPI具有显著的镇痛效应,其主要是通过带动人体自身的阿片系统对抗疼痛。脑啡肽是脑内含量最高的阿片肽,在脑区广泛存在。但是脑啡肽在细胞体内形成后很容易被特殊的锌金属外肽酶裂解,主要的降解脑啡肽的锌金属肽酶包括人中性内肽酶(hNEP)和氨基肽酶N(hAP-N)。OPI作为人体内第一个被发现的天然双重酶抑制剂,主要抑制NAP及NEP对脑啡肽的降解,加强脑啡肽对止痛作用的调节。因此OPI具有良好的镇痛作用,且其镇痛效果比其它非肽类双重酶抑制剂更强。在大鼠物理疼痛和化学疼痛模型中,OPI的止痛效果是相同剂量下单独使用脑啡肽的3-6倍[3]。侧脑室注射OPI也表现出剂量和时间依赖的强镇痛作用,其镇痛作用主要是通过内源性u-片和δ-阿片受体途径实现的。侧脑室注射5微克/公斤OPI产生与注射10微克/公斤吗啡相当的镇痛效果,这表明OPI具有比吗啡更有效的镇痛作用[3]。此外,与外源性阿片受体激动剂吗啡相比,OPI在亚慢性治疗后不产生显著的药物滥用依赖性或镇痛药物耐受性[9]。当OPI重复治疗剂量达3mg/kg也未能产生阿片依赖[10],其机理可能是OPI通过抑制根据疼痛刺激释放的内源性脑啡肽的破坏,限制性激活参与疼痛控制的阿片途径,从而比吗啡更有助于实现镇痛和副作用之间更大的平衡。研究表明OPI天生的灵活性和柔软性结构是其镇痛活性所必需[11],OPI具有成为一种新型镇痛药物的潜能,但是OPI用于临床治疗还有很多的邻域需要探索。
本实验研究结果1显示,模型组大鼠的热痛反应时间明显短于空白对照组大鼠,差异有统计学意义,与模型组、纳洛酮组和纳洛酮+电针组相比,电针组和OPI组大鼠的热痛反应时间则呈显著增加,差异有统计学意义,而模型组、纳洛酮组和纳洛酮+电针组的热痛反应时间之间比较无统计学差异,电针组和OPI组大鼠的热痛反应时间比较亦无统计学差异。说明电针干预和OPI蛋白腹腔注射干预可以明显改善模型大鼠热痛阈值,提高热痛反应时间,缓解大鼠的疼痛水平。但是,电针干预的镇痛作用可以被阿片受体阻断剂纳洛酮所逆转,提示阿片受体介导了电针的镇痛效应。
此外,本实验研究结果2显示,空白对照组大鼠与模型组大鼠血清OPI蛋白表达水平无统计学差异,提示手术切口痛大鼠体内OPI蛋白表达无明显升高。与模型组相比,电针组血清的OPI蛋白表达呈显著增加,差异有统计学意义,提示在1小时内,电针可以提高手术切口痛模型大鼠的血清OPI蛋白表达,结合本实验研究结果1,表明血清OPI蛋白可能参与及介导了电针干预的镇痛效应。
4.4 脑啡肽内源性阿片肽主要通过与体内阿片类受体结合以调控疼痛信息的传递,从而产生镇痛作用[12]。其中脑啡肽家族是脑内含量最高的内源性阿片肽,其按结构分为亮啡肽和甲啡肽。脑啡肽广泛分布于神经系统的各级水平和各个部位,且脑啡肽主要作用于u受体和δ受体参与内源性痛觉调制系统的构成,从而发挥镇痛效应。相关受体主要分布于中枢神经系统和调控疼痛相应的解剖部位。脑啡肽还可以调节机体的内分泌和运动等功能,但在各种生理功能中,以脑啡肽的镇痛作用最突出,研究表明,增加体内脑啡肽的释放可以起到良好的镇痛作用[4]。不仅如此,脑啡肽还参与了针灸的镇痛效应。电针可以促进下丘脑前阿黑皮素、前脑啡肽原mRNA、以及下丘脑脑啡肽的表达来缓解模型大鼠的疼痛水平[13-14]。针灸对大鼠的镇痛作用还与腺垂体脑啡肽的含量呈正相关[15],腺垂体脑啡肽可释放入血液对针刺效应产生调节。针刺在促使脑与脊髓内甲啡肽释放的同时还能促进其与受体的结合来实现镇痛效果[16]。此外,疼痛刺激也可以激活内阿片肽基因表达,疼痛模型大鼠痛阈降低的同时也伴随脊髓与下丘脑中脑啡肽的含量升高,但程度上与针刺效应有差异,针刺后脑内脑啡肽原的含量多于痛刺激组[17]。
本实验研究结果2显示,与空白对照组大鼠比较,模型组大鼠的血清脑啡肽表达呈显著增加,差异有统计学意义,提示疼痛刺激1小时内可以促进体内血清脑啡肽的释放,表明应对疼痛应激血清水平的脑啡肽释放效应较迅速。但对于干预方法,大鼠血清脑啡肽表达组间比较无统计学差异,提示本实验中电针镇痛的干预效应与1小时后血清脑啡肽的含量增加不相关。本研究结果与上述针刺通过促进脑啡肽表达以产生镇痛效应的结果不一致,可能与本研究所采用的电针时间、电针参数以及采血时间点存在差异有关。电针干预后可能促进了血清脑啡肽的即时释放,但血清脑啡肽释放后又被迅速降解,更进一步的研究应该考虑观察针刺半小时后血清脑啡肽的即时变化情况,或针刺干预两小时及更长时间的血清脑啡肽变化情况,或许会有统计学差异。
5 总结
本研究表明,电针干预和OPI蛋白腹腔注射干预可以明显改善模型大鼠热痛阈值,提高热痛反应时间,缓解大鼠的疼痛水平;疼痛刺激1h内可以促进体内血清脑啡肽的释放,在干预1h内,电针则可以提高手术切口痛模型大鼠的血清OPI蛋白表达,应对疼痛应激血清水平的脑啡肽释放效应更迅速,但电针镇痛干预1h后血清脑啡肽的含量与模型组比较未见明显增加,可能与体内脑啡肽释放后又被迅速降解有关,有待进一步的探索和研究。但电针干预和OPI蛋白腹腔注射的镇痛作用可以被阿片受体阻断剂纳洛酮所逆转,提示阿片受体介导了电针及OPI蛋白的镇痛效应。电针干预可能通过促进血清OPI蛋白释放,进而通过阿片受体参与及介导了电针对手术切口痛大鼠的镇痛效应,而脑啡肽在其中的作用和角色有待进一步的研究确认。
References:
[1]余建明,曲丕盛,范皓,等.经皮穴位电刺激在乳腺癌根治手术中镇痛效应的研究[J].针刺研究,2010,35(1):43-46. YU Jianming,QU Pisheng,FAN Hao,et al.Observation on the Analgesic Effect of Transcutaneous Electrical Acupoint Stimulation for Breast Radical Carcinoma Operation [J].Acupuncture Research,2010,35(1):43-46.
[2]严江,林翠勤,张诚章,等.电针辅助对mPCNL快通道麻醉恢复的影响[J].中国针灸,2014,34(4):385-388. YAN Jiang,LIN Cuiqin,ZHANG Chengzhang,et al.Effects of assisted-electroacupuncture on recovery of fast tracking anesthesia in m PCNL[J].Chinese Acupncture&Moxibustion,2014,34(4):385-388.
[3]TIAN Xiaozhu,CHEN Juan,XIONG Wei,et al.Effects and underlying mechanisms of human opiorphin on colonic motility and nociception in rnice[J].Peptides,2009,30(7): 1348-1354.
[4]Slade SC,Keating JL.Unloaded movement facilitation exercise compared to no exercise or alternative therapy on outcomes for people with nonspecific chronic low back pain:a systematic review[J].J Manipulative Physiol Ther, 2007,30(4):301-311.
[5]林玉芳,李寅,万钰茜,等.肛肠手术行穴位经皮刺激复合药物麻醉的抗应激及镇痛效应研究[J].上海中医药大学学报,2015,29(4):30-33. LIN Yufang,LI Yin,WAN Yuxi,et al.Research on antistress effect and analgesic effect of transcutaneous acupoint stimulation combined with drug anesthesia during anorectal operation[J].Acta Universitatis traditionis medicalis sinensis pharmacologiaeque shanghai,2015,29(4):30-33.
[6]ZENG YenJing,TSAI ShihYing,CHEN KuenBao,et al. Comparison of electroacupuncture and morphine-mediated analgesic patterns in a plantar incision-induced pain model [J].EvidBasedComplementAlternatMe,2014,2014: 659343.
[7]贾旺华,迟文英,娄超,等.电针对足底切口痛大鼠下丘脑及脊髓β-内啡肽的影响[J].针刺研究,2016,41(3):225-229. JIAWanghua,CHI Wenying,LOUChao,etal.Effectof electroacupuncture intervention on beta-endorphin levels of hypothalamus and spinal cord tissues in rats with pelmatic incisional pain[J].Acupuncture Research,2016,41(3): 225-229.
[8]周兰霞,达文平,姚佳,等.Opiorphin溶液构象分析[J].兰州大学学报(医学版),2013,39(3):14-17. ZHOU Lanxia,DA Wenping,YAO Jia,et al.Solution conformation of opiorphin[J].Journal of Lanzhou University (Medical Sciences),2013,39(3):14-17.
[9]Rougeot C,Robert F,Menz L,et al.Systemically active human opiorphin is a potent yet non-addictive analgesic without drug tolerance effects[J].J Physiol Pharmacol,2010, 61(4):483-90.
[10]Popik P,Kamysz E,Kreczko J,et al.Human?opiorphin:the lack of physiological dependence,tolerance to antinociceptive effects and abuse liability in laboratory mice[J]. Behav Brain Res,2010,213(1):88-93.
[11]Pinto M,Rougeot C,Gracia L,et al.Proposed Bioactive Conformations of Opiorphin,an Endogenous Dual APN/ NEP Inhibitor[J].ACS Med Chem Lett,2011,3(1):20-4.
[12]Glorioso JC,Fink DJ.Gene therapy forpain:introduction to the special issue[J].GeneTher,2009,16(4):453-454.
[13]郭长青,曹榕娟,孙红梅,等.针刀松解法对第3腰椎横突综合征大鼠下丘脑前阿黑皮素mRNA、前脑啡肽原mRNA表达的影响[J].针刺研究,2010,35(5):354-358. GUO Changqing,CAO Rongjuan,SUN Hongmei,et al.Effect of Acupotomy Lysis on Hypothalamic POMC mRNA and PPE mRNA Expression in Rats with 3rd Lumbar Vertebrae Transverse Process Syndrome[J].Acupuncture Research,2010,35(5):354-358.
[14]王薇钧,卢峻,黄怡然,等.电针对慢性炎症疼痛大鼠下丘脑ENK与脊髓OFQ含量的影响[J].北京中医药大学学报, 2010,33(3):196-199. WANG Weijun,LU Jun,HUANG Yiran,et al.Influences of electroacupuncture on content of hypothalamus ENK and spinal OFQ in rats with chronic inflammatory pain[J]. JournalofBeijingUniversityofTraditionalChinese Medicine,2010,33(3):196-199.
[15]杜宝琮,杜威,董继超,等.超声-中频电治疗后大鼠脑啡肽水平与其镇痛效应[J].中国临床康复,2006,10(6):182-184. DU Baocong,DU Wei,DONG Jichao,et al.pain-relieving effect of ultrasound-medium frequency electrotherapy and changes of enkephalin in rats[J].Chinese Journal of Clinical Rehabilitation,2006,10(6):182-184.
[16]何承敏.中枢阿片肽介导不同频率电针镇痛作用的研究[J].华中医学杂志,1997,21(6):285-286. HE Chengmin.Study on the analgesic effect of Electroacupuncture of different frequencies mediated by central opioid peptide[J].Central China Medical Journal,1997, 21(6):285-286.
[17]笪翠娣,范斌,周敬修.针刺镇痛后大鼠脑中脑啡肽mRNA的基因表达及其与Fos的共存[J].上海医科大学学报,1998, 25(1):19-22. DACuidi,FANBin,ZHOUJingxiu.Preproenkephalin mRNA expression and co-localized with c-Fos in rat brain after acupuncture analgesia[J].J Shanghai Med Univ,1998, 25(1):19-22.
To Study the Regulating Effect of Opiorphin in Acupuncture Analgesia in A Rat Model of Anorectal Surgery
LIN Yufang1,HAN Wei2,CHEN Aiwen2,et al 1.Zhejiang Hospital,Hanzhou(310013),China.2.Shanghai University of Traditional Chinese Medicine(201203),China
[Objective]In rats model of anorectal surgical incision pain,the heat pain reaction time and the expression level of serum OPI and enkephalin were observed,to explore the mechanism of the analgesic effect of OPI proteins and its role in regulating the analgesic effect of electro-acupuncture.[Methods] The rats were randomly divided into control group,model group,electro-acupuncture(EA)group,OPI group,naloxone group,naloxone+EA group,except control group,other 5 groups were established the incision pain model,after an hour of implementation of the relevant intervention,to observe the heat pain reaction time of the rats model,after the observation,the rats of blank control group,model group,electro-acupuncture group and OPI group were anesthetized and given sudden death,the expression of rats’serum OPI protein and enkephalin were detected by ELISA.[Results]The rats’heat pain reaction time had significant differences in the comparison of groups(P<0.05),the heat pain reaction time of rats in model group was significantly shorter than the control group,the difference was statistically significant(P<0.001),the heat pain reaction time of rats in model group,naloxone group and naloxone+EA group was significantly shorter than the acupuncture group and the OPI group,the difference was statistically significant(P<0.05,P<0.01,P<0.001);the expression of serum enkephalin in rats of model group was significantly increased more than control group,the difference had statistical significance(P<0.05), the serum OPI protein increased significantly in EA group than control group(P<0.05),the difference was statistically significant(P<0.05).[Conclusion]The rats’heat pain reaction times of EA group and OPI group were significantly prolonged,but the analgesic effect was blocked by naloxone.EA may promote the release of serum OPI protein which could protect the enkephalin peptides from enzymatic degradation,and then EA participated the analgesia effect on rats’incision pain through the opioid receptor mediated.The role of serum enkephalin needed further study.
surgical incision pain;electroacupuncture;thermal pain response time;opiorphin;enkephalin;naloxone;acupuncture
R245.9
A
1005-5509(2017)06-0518-05
10.16466/j.issn1005-5509.2017.06.017
2016-11-14)
沈卫东,E-mail:shenweidong@163.com
