芍药甘草汤对脂多糖诱导大鼠背根神经节神经元损伤的保护机制研究
2017-06-21马千谢晓燕叶玲尉明洋张娟
马千谢晓燕叶玲尉明洋张娟
1.浙江中医药大学附属第一医院杭州3100062.湖北省十堰市太和医院
芍药甘草汤对脂多糖诱导大鼠背根神经节神经元损伤的保护机制研究
马千1谢晓燕2叶玲1尉明洋1张娟1
1.浙江中医药大学附属第一医院杭州3100062.湖北省十堰市太和医院
[目的]通过脂多糖(lipopolysaccharide,LPS)诱导背根神经节神经元(dorsal root ganglion neuron,DRGn)发生损伤,探讨芍药甘草汤对DRGn炎性损伤的保护作用及机制。[方法]实验分为4组:空白对照(Con)组、LPS(LPS)组、芍药甘草汤(SGD)组、芍药甘草汤+尼克酰胺(SGD+NAM)组。相差显微镜下观察各组DRGn形态的改变;CCK法检测各组DRGn的存活率,并且通过Western blot法检测各组神经元沉默信息调节因子2(silencing information regulator 2,Sir2)相关酶1(silent mating type information regulation 2 homolog 1,SIRT1)、mTOR、p-mTOR和Ac-NF-κB的表达。[结果]LPS组较Con组DRGn的形态发生明显改变,存活率明显降低(P<0.01),SIRT1和p-mTOR表达降低(P<0.05),mTOR和Ac-NF-κB表达增高(P<0.05);SGD组较LPS组DRGn的存活率增加(P<0.01),SIRT1和p-mTOR表达增加(P<0.05),mTOR和Ac-NF-κB的表达降低(P<0.05);SGD+NAM组较SGD组DRGn的存活率降低(P<0.05),SIRT1和p-mTOR的表达降低(P<0.05),mTOR和Ac-NF-κB的表达增高(P<0.05)。[结论]LPS可诱导背根神经节神经元发生损伤。芍药甘草汤可能是通过增加SIRT1的表达,促进mTOR向p-mTOR转化,降低Ac-NF-κB的表达,进而抑制细胞内后续炎症因子的释放从而发挥其神经元保护作用。
芍药甘草汤;神经性病理性疼痛;炎性损伤;DRGn;SIRT1;镇痛;Ac-NF-κB;mTOR
神经病理性疼痛(neuropathic pain,NP)的病理改变主要表现为中枢敏化,具体机制为神经损伤后局部合成和释放的多种炎性疼痛相关因子,作用于脊髓痛觉传递神经元使其处于超敏化状态,同时通过正反馈效应进一步增强初级传入神经末梢伤害性神经递质的释放,参与NP的发生和发展[1-3]。背根神经节神经元(dorsal root ganglion neuron,DRGn)作为躯体初级感觉神经元,被广泛运用于NP的研究中。
沉默信息调节因子2(silencing information regulator 2,Sir2)相关酶1(silent mating type information regulation 2 homolog 1,SIRT1)作为一种核蛋白,是一种依赖于烟酰胺腺嘌呤二核苷酸(NAD+)的组蛋白去乙酰化酶(histone deacetylase,HDAC)。SIRT1在维持神经元的功能、促进神经元轴突的生长以及树突的分支中都发挥着重要的作用[4]。作为SIRT1激动剂的白藜芦醇在各类炎症性和NP中都有镇痛作用,如在脊神经结扎模型中有减轻触觉痛敏作用[5],以及减弱角叉菜胶诱导大鼠的痛觉过敏[6]。
芍药甘草汤(shaoyao-gancao decoraton,SGD)出自《伤寒论》,由芍药和甘草二药组成。该方系仲景为伤寒误汗亡阳、阳复后脚挛急证而设,奏柔肝舒筋、缓急止痛之效。国内外研究已证实本方具有明显的镇痛、抗炎等作用[7]。课题组前期研究也发现SGD能增加坐骨神经慢性损伤(chronic constrictive injury,CCI)大鼠脊髓背角SIRT1的表达,其作用被SIRT1基因沉默所减弱[8]。
本研究通过建立脂多糖(lipopolysaccharide,LPS)诱导激活DRGn模型,了解神经元损伤的炎性相关病理生理机制以及SGD对该损伤的保护作用及机制,为今后NP的治疗及药物开发提供理论依据。
1 材料
1.1 试剂和药品Neurobasal培养基(批号:12348017)、DMEM-高糖培养基(批号:A1443101)、胎牛血清(批号:10100147)、B27(批号:17504044)购自Gibco公司,NGF(批号:11050HNA)购自Invitrogen公司,L-多聚赖氨酸(批号:P0296)、脂多糖(批号:L2880)、胰蛋白酶(批号:T7409)、L-谷氨酰胺(批号:T7309)购自Sigma公司,CCK-8试剂盒(批号:C0038)、RIPA裂解液(批号:P0013)、预染蛋白marker(批号:P0072)购自碧云天公司,Tris(批号:0497)、甘氨酸(批号:0167)购自Amresco公司,化学发光检测试剂(批号:NCI4106)购自Thermo公司。芍药甘草汤(浙江省中医院院内制剂,由浙江中医药大学中药制剂室蒋建平主任鉴定,每1mL相当于生药2g)。
1.2 动物成年雌雄SD大鼠20只,体质量200~250g,浙江中医药大学动物实验中心提供,动物许可证号:SCXK(沪)2013-0016,饲养于SPF级环境。胎鼠孕龄的确定根据雌雄SD大鼠合笼后,次晨在鼠笼下面看到黄白色的阴栓为妊娠第1d,待孕15d取材。
1.3 仪器超净工作间(浙江中医药大学骨研所);移液枪(Eppendorf);酶标分析仪(Biotek);自动电泳凝胶成像系统(Chemi Imager 5500,USA);通用电泳仪(Bio-Rad,USA);倒置显微镜(Olympus,Japan);低温高速离心机(Thermo Forma,USA);-80℃超低温冰箱(Thermo Forma,USA)。
2 方法
2.1 SD胎鼠DRGn的分离培养及纯化参考李全波等[9-10]的方法,腹腔注射麻醉孕15d SD大鼠后,无菌条件下取出胚胎,在体视显微镜下用眼科剪沿背部沿脊椎剪开,暴露脊髓,用显微镊将脊髓两侧呈串珠状的背根神经节(dorsal root ganglion,DRG)取出,剔除神经节被膜后置于预冷的DMEM-高糖液中。眼科剪充分剪碎组织,加入0.25%胰蛋白酶,37°C消化30min。加入胎牛血清终止消化,用吸管小心反复吹打成单细胞悬液,收集细胞悬液后移至15mL离心管中,加入淋巴细胞分离液(淋巴细胞分离液浓度为60%),水平离心2000r/min 20min。用细吸管插入到云雾层吸取细胞,置入另一离心管中,加入5倍以上体积的DMEM-高糖液重悬,离心1500r/min,5min,小心吸出上清液,加入一定体积的贴壁培养基(DMEM-高糖培养基+ 10%胎牛血清),细胞计数后按一定细胞密度接种于预先包被多聚赖氨酸的容器中(96孔板:5×105/孔,6孔板:2×105/孔,T25培养瓶:5×105/瓶)。6h后弃贴壁培养基,换用无血清神经元专用培养基(Neurobasal培养基+2%B27+10ng·mL-1神经生长因子+2mmol·L-1L-谷氨酰胺+双抗)。于37℃、5%CO2条件下培养48h后用于实验。
2.2 芍药甘草汤血清及正常大鼠血清制备将大鼠分为芍药甘草汤组和生理盐水组,灌胃2次/d,每次2mL,连续3d。于末次灌胃后2h内进行腹主动脉采血。室温静置2h后,低温离心4000 r/min,10min分离血清,置-80℃条件下保存备用,使用时56℃水浴灭活30min,0.22μm滤器过滤灭菌。
2.3 分组及给药将培养的DRGn细胞随机分为4组:空白对照(Con)组、脂多糖(LPS)组、芍药甘草汤(SGD)组、芍药甘草汤+尼克酰胺(SGD+NAM)组。给药:SGD+NAM组:SIRT1拮抗剂组尼克酰胺98nM[11]间断24h给予两次,LPS(100ng·mL-1)作用24h后再加入10%芍药甘草汤血清作用24h;SGD组:LPS(100ng·mL-1)刺激作用24h后加入10%芍药甘草汤血清作用24h;LPS组:LPS(100ng·mL-1)作用24h后加入10%正常大鼠血清作用24h;Con组加入10%正常大鼠血清作用24h。
2.4 CCK-8测定细胞活力DRGn分离培养后接种于96孔板,各组均设6个平行孔,100μL/孔,换用无血清神经元专用培养基培养24h后,各组加入不同药物置于37℃、5%的CO2培养箱培养。培养24h后,弃培养液,加90μL神经元专用培养基后各孔加入10μL CCK-8溶液,孵育2h后用酶标仪比色(波长选择570nm),测定各孔的吸光度(A值),记录结果,计算各组细胞活力。备注:A(加药):具有细胞、CCK-8溶液和药物溶液的孔的吸光度,A(空白):具有培养基和CCK-8溶液而没有细胞的孔的吸光度,A(0加药):具有细胞、CCK-8溶液而没有药物溶液的孔的吸光度。
细胞活力(%)=[A(加药)-A(空白)]/[A(0加药)-A(空白)]×100。
2.5 Western Blot检测SIRT1、mTOR、p-mTOR、Ac-NF-κB蛋白的表达分别提取各组细胞的总蛋白制成蛋白样品,将含有目标蛋白(抗原)的样品用5% SDS-PAGE电泳分离蛋白,硝酸纤维素膜转膜,30mA恒流,4°C转移过夜。封闭后先后加入一抗和二抗,室温下分别孵育1.5h和1h。化学发光法检测,与发光底物结合后,经X片曝光显影,存储用ImageJ分析。
3 结果
3.1 芍药甘草汤对LPS诱导DRGn形态学的影响通过倒置显微镜观察各组DRGn的形态(图1),正常培养下DRGn贴壁生长,突起细长,少部分DRGn可聚集在一起,四周有树枝状的神经突起。LPS作用后大部分DRGn死亡,悬浮在培养液中,小部分DRGn突起变小,体积缩小。而加入芍药甘草汤后DRGn的数量增多,细胞突起变大。

图1 倒置显微镜下各组DRGn细胞的形态(×40)Fig.1 Groups of DRGn cell morphology under inverted microscope(×40)
3.2 CCK-8检测各组细胞活性如图2所示:与Con组相比,其他各组DRGn活性均明显降低,差异有统计学意义(P<0.01)。与LPS组相比,SGD组、SGD+NAM组的DRGn活性明显升高,差异有统计学意义(P<0.05)。与SGD组相比,SGD+NAM组细胞活性明显降低,差异有统计学意义(P<0.05)。
3.3 各组SIRT1、mTOR、p-mTOR、Ac-NF-κB蛋白的表达如图3所示:LPS组较Con组SIRT1、pmTOR表达降低,mTOR、Ac-NF-κB的表达增高,差异有统计学意义(P<0.01)。SGD组较LPS组SIRT1、pmTOR表达增加,mTOR、Ac-NF-κB的表达降低,差异有统计学意义(P<0.05)。SGD+NAM组较SGD组SIRT1、p-mTOR的表达降低,mTOR、Ac-NF-κB的表达增高,差异有统计学意义(P<0.05)。
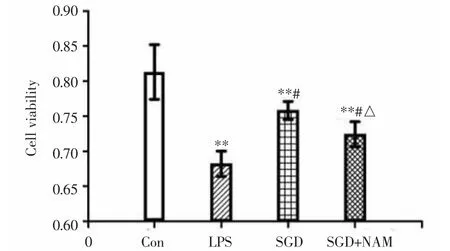
图2 各组细胞活性比较(±s,n=6)Fig.2 Comparison of cell activity in each group(±s,n=6)

图3 各组SIRT1、mTOR、p-mTOR、Ac-NF-κB表达Fig.3 The expression of SIRT1,mTOR,p-mTOR,Ac-NF-κB in each group
4 讨论
NP的病理改变主要表现为中枢敏化,而神经损伤处的免疫反应则在NP的敏化中发挥了重要作用:神经损伤处有免疫细胞浸润和炎性细胞因子释放的增多;胶质细胞的激活;局部应用免疫抑制剂能减轻NP的行为反应等。
LPS是革兰阴性菌细胞壁的的主要成分,是引起各种急慢性炎症损伤的关键介质之一[12]。国内外研究均表明LPS可诱导神经胶质细胞的炎性改变及神经元细胞的炎性损伤。锯齿动物和人类研究表明全身性炎症可诱发痛觉过敏[13]。临床上用芍药甘草汤治疗各种神经病理性疼痛如糖尿病后神经病变、三叉神经痛和带状疱疹后神经痛等均取得良效。故本实验采取LPS诱导激活DRGn,体外模拟中枢神经系统内慢性炎症的发生及探讨SGD缓解NP的可能机制。
SIRT1作为一种核蛋白,是一种依赖于烟酰胺腺嘌呤二核苷酸(NAD+)的组蛋白去乙酰化酶。它通过去乙酰化修饰,抑制转录和诱导基因沉默。近年来研究发现SIRT1在调控细胞衰老、凋亡和氧化应激损伤等过程中扮演重要角色。雷帕霉素靶蛋白(mTOR)是一种非典型丝氨酸/苏氨酸蛋白激酶。参与非神经细胞的增殖、神经元的发育和突触的可塑性。目前发现SIRT1 和mTOR同时在年龄相关性疾病中起到重要作用,激活SIRT1和抑制mTOR可以产生保护作用:包括抑制炎症因子的释放、促进神经细胞的生成等。在大鼠癌痛和脊神经拮扎模型中,脊髓背角和DRGn中p-mTOR表达增加[14]。因此课题组推测SIRT1的激活并抑制mTOR从而减少炎症因子的释放是缓解NP的关键步骤。
NF-κB是一种转录激活因子,促进多种促炎症细胞因子和趋化因子的表达,参与普瑞巴林和加巴喷丁等一线药物的抗NP治疗中。SIRT1敲除小鼠巨噬细胞的NF-κB表现为高乙酰化,增加致炎因子基因的表达[15]。在阿尔茨海默病研究中,高表达SIRT1的小胶质细胞通过NF-κB的去乙酰化,产生神经保护作用。
本实验中倒置相差显微镜下可以观察到LPS组较Con组DRGn的数量明显减少,形态明显改变,CCK-8实验中存活率明显降低,LPS组较Con组SIRT1、pmTOR的表达降低,mTOR、Ac-NF-κB的表达增高,说明LPS诱发的炎症损伤后,SIRT1表达降低,其机制可能和mTOR、Ac-NF-κB的表达增高有关。而SGD含药血清组较LPS组,DRGn的存活率增加,SIRT1、p-mTOR表达增加,mTOR、Ac-NF-κB的表达降低,说明SGD对于LPS诱导的神经炎性损伤具有保护作用,其机制可能同抑制下游炎性因子的表达有关。而这种保护作用可以被SIRT1拮抗剂尼克酰胺所逆转,说明SGD可能是通过增加SIRT1表达,促进mTOR向p-mTOR转化,降低Ac-NF-κB的表达,即通过SIRT1-p-mTOR-Ac-NF-κB通路来发挥其抗炎镇痛作用的。本实验的完成,对NP分子机制的研究提供了一种新思路,为中药治疗NP提供了理论依据,为开发针对NP的中药复方提供了新的靶点和技术平台。
References:
[1]Smith MT,Muralidharan A.Pharmacogenetics of pain andanalgesia[J].Clin Genet,2012,82(4):321-330.
[2]Barcelo AC,Filippini B,Pazo JH.The striatum and pain modulation[J].Cell Mol Neurobiol,2012,32(1):1-12.
[3]FornasariD.Pain mechanisms in patients with chronic pain[J].ClinDrugInvestig,2012,32(1):45-52.
[4]Herskovits AZ,Guarente L.SIRT1 in neurodevelopment and brain enescence[J].Neuron,2014,81(3):471-83.
[5]Pérez-Severiano F,Bermúdez-Ocana DY,López-Sánchez P, et al.Spinal nerve ligation reduces nitric oxide synthase activity and expression:effect of resveratrol[J].Pharmacol Biochem Behav,2008,90(4):742-747.
[6]Pham-Marcou TA,Beloeil H,Sun X,et al.Antinociceptive effect of resveratrol in carrageenan-evoked hyperalgesia in rats:prolonged effect related to COX-2 expression impairment [J].Pain,2008,40(2):274-283.
[7]隋峰,李兰芳,李珊,等.转化理念指导下的芍药甘草汤抗炎止痛实验研究[J].世界科学技术-中医药现代化,2011,13(1):188-192. SUI Feng,LI Lanfang,LI Shan,et al.Experimental Study on Anti-inflammatory and Pain-relieving Effects of Shaoyao Gancao Decoction Based onTranslationalMedicine[J]. ModernizationofTraditionalChineseMedicineand Materia Materia-World Science and Technology,2011,13 (1):188-192.
[8]张娟,马千,吕晨,等.芍药甘草汤对慢性坐骨神经结扎大鼠脊髓SIRT1表达的影响[J].浙江中医药大学学报,2015,39(5):329-334. ZHANG Juan,MA Qian,LV Chen,et al.Role of SIRT1 in the extracts of the Chinese medicine shaoyao and gancao in Chronic Constriction Injury-Induced Neuropathic Pain in Rats[J].Journal of Zhejiang Chinese Medical University, 2015,39(5):329-334.
[9]韩创业,赵春节,刘锦愉,等.高纯度大鼠胚胎背根神经节神经元的培养与鉴定[J].广西医科大学学报,2014,31(3):358-361. HANChuangye,ZHAOChunjie,LIUJinyu,etal.Culture and identification of high purity of embryonic rat dorsal root ganglion neurons[J].Journal of Guangxi Medical University,2014,31(3):358-361.
[10]李全波,马文庭,刘静芷,等.大鼠背根神经节神经元细胞纯化培养的模型建立[J].中国疼痛医学杂志,2011,17(8): 494-497. LI Quanbo,MA Wenting,LIU Jingzhi,et al.Model building of prmary culture and purify ication of rat dorsal root ganglion neurons[J].Chinese Journal of Pain Medicine,2011, 17(8):494-497.
[11]Liu B,Zhang B,Guo R,et al.Enhancement in efferocytosis ofoxidizedlow-densitylipoprotein-inducedapoptotic RAW264.7 cells through Sirt1-mediated autophagy[J].Int J Mol Med,2014,33(3):523-533.
[12]Chen S,Xiong J,Zhan Y,et al.Wogonin Inhibits LPSInducedInflammatoryResponsesinRatDorsalRoot Ganglion Neurons Via Inhibiting TLR4-MyD88-TAK1-Mediated NF-κB and MAPK Signaling Pathway[J].Cell Mol Neurobiol,2015,35(4):523-531.
[13]Karshikoff B,Lekander M,Soop A,et al.Modality and sex differences in pain sensitivity during human endotoxemia [J].Brain Behav Immun,2015,46(5):35-43.
[14]Asante CO,Wallace VC,Dickenson AH.Mammalian target of rapamycin signaling in the spinal cord is required for neuronalplasticityandbehavioralhypersensitivity associated with neuropathy in the rat[J].J Pain,2010,11(12): 1356-1367.
[15]Schug TT,Xu Q,Gao H.Myeloid deletion of SIRT1 induces inflammatory signaling in response to environmental stress[J].Mol Cell Biol,2010,30(19):4712-4721.
The Protective Effect of the Extracts of the Chinese Medicine Shaoyao and Gancao to DRGn Damaged by LPS
MA Qian1,XIE Xiaoyan2,YE Ling1,et al 1.Zhejiang Hospital of Traditional Chinese Medicine,Hangzhou(310006),China;2.Taihe Hospital of Shiyan City,Hubei Provine
[Objective]By establishing the cell model of dorsal root ganglion neuron(DRGn)impaired by lipopolysaccharide(LPS),to explore the extracts of Chinese medicine Shaoyao and Gancao on DRGn protective effect and mechanism of inflammatory damage.[Method]Cells were divided randomly into four groups:Control group(Con),LPS group(LPS),SGD group(SGD),SGD+Nicotinamide(SGD+NAM).The morphology of the DRGn was observed by microscope and the survival rate of DRGn was detected by CCK-8 test.The expression levels of silent mating type information regulation 2 homolog 1(SIRT1),mTOR, p-mTOR and Ac-NF-κB were detected by Western blot.[Results]Compared with the Con group:The morphology in the DRGn of the LPS group significantly changed and the survival rate of it declined with the declining expression levels of SIRT1 and p-mTOR,and the elevating expression levels of mTOR and Ac-NF-κB.In contrast to LPS group:the survival rate of DRGn and the expression of SIRT1 and p-mTOR increased in SGD group,and the expressions of mTOR and Ac-NF-κB were lower.However,the survival rate of DRGn and the expression of SIRT1 and p-mTOR declined in SGD+NAM group,and the expression of mTOR and Ac-NF-κB increased compared with SGD group.[Conclusion]The extracts of the Chinese medicine Shaoyao and Gancao may perform its protective effect through SIRT1-p-mTOR-Ac-NF-κB pathway to DRGn which was impaired by LPS.
Shaoyao Gancao Decoction;NP;inflammatory injury;DRGn;SIRT1;analgesia;Ac-NF-κB;mTOR
R331
A
1005-5509(2017)06-0513-05
10.16466/j.issn1005-5509.2017.06.016
2017-01-06)
国家自然基金(81202823/H2902);浙江省医药卫生科技计划(2014KYA157);浙江省自然基金(LY16H290003)
Fund projects:National Natural Science Fund(81202823/H2902);Zhejiang Medical and Health Science and Technology Plan(2014KYA157);Natural Science Fund of Zhejiang Province(LY16H290003)
张娟,E-mail:zhangjuan8989@hotmail.com
