路路通酸对乳腺癌MCF-7细胞和宫颈癌C-33A细胞增殖的影响
2017-03-28穆晓婷蒋璐璐张东方
穆晓婷,钱 平,蒋璐璐,王 玥,靳 鑫,张东方
路路通酸对乳腺癌MCF-7细胞和宫颈癌C-33A细胞增殖的影响
穆晓婷,钱 平,蒋璐璐,王 玥,靳 鑫,张东方*
目的 研究路路通酸(BTA)对乳腺癌MCF-7细胞及宫颈癌C-33A细胞增殖的影响。方法 采用MTT法检测不同浓度BTA作用不同时间后对MCF-7细胞、C-33A细胞的增殖抑制作用;流式细胞仪检测BTA处理后细胞周期的变化。结果 BTA作用于乳腺癌MCF-7细胞24、48、72 h后的IC50分别为(37.62±1.72)、(27.32±0.99)、(19.19±0.90)μmol/L。BTA作用于宫颈癌C-33A细胞24、48、72 h后的IC50分别为(34.55±0.88)、(27.20±1.03)、(16.74±0.79)μmol/L,BTA对2种细胞增殖有明显抑制作用,且呈浓度时间依赖性(P<0.05),流式结果显示,BTA将MCF-7细胞阻滞在S期,并诱导其凋亡;BTA将C-33A细胞阻滞在G1-S期。结论 BTA对乳腺癌MCF-7细胞和宫颈癌C-33A细胞具有较强的增殖抑制作用,其机制与细胞周期阻滞和诱导细胞凋亡有关。
路路通酸;乳腺癌;宫颈癌;增殖抑制
0 引言
路路通为金缕梅科植物枫香树(LiquidambarformosanaHance)的干燥成熟果实,是临床常用中药,具有祛风活络、利水、通经的功效,用于治疗关节痹痛、麻木拘挛、水肿胀满、乳少经闭等证[1]。现代临床研究表明,路路通用于治疗乳腺炎、卵巢囊肿、痛经、闭经等疾病疗效显著[2-3]。但是否可用于乳腺癌、宫颈癌的治疗尚未见明确报道。路路通酸(Betulonic acid,BTA),又称桦木酮酸,为路路通的主要有效成分[4],近年来研究发现,BTA具有良好的抗肿瘤活性,对卵巢癌、前列腺癌,人肝癌HepG-2细胞、人胃癌SGC-7901细胞和抗动物移植性S180、H22荷瘤细胞等的增殖有明显抑制作用[5-8],对乳腺癌和宫颈癌的研究报道较少。本实验就BTA对乳腺癌MCF-7细胞及宫颈癌C-33A细胞增殖的影响及机制进行研究,为进一步临床应用提供参考。
1 材料与方法
1.1 材料与仪器 路路通酸(BTA)(纯度≥98%),由中国医科大学药学院中药与生药学教研室提供;人乳腺癌(MCF-7)细胞、人宫颈癌(C-33A)细胞由中国医科大学细胞生物学教研室提供。BTA溶解于二甲基亚砜(DMSO)后配制成10 mmol/L储备液于-20 ℃保存备用。
CO2细胞培养箱(MODEL 3111,美国Thermo);垂直层流洁净工作台(HCB-1300V,中国海尔);酶标仪(14495,日本BIO-RAD);流式细胞分选仪(FACSCAN,美国BD);DMEM细胞培养基(AAJ307791,美国GE);RPMI-1640细胞培养基(AAK308935,美国GE);胰酶(03050-1A,以色列Bioind);胎牛血清(TBD31HB,天津灝洋);溴化四氮唑蓝(MTT)(JT343-250MG,美国Genview);二甲基亚砜(DMSO)(MB-D4253,杭州柯氏);PI染液(CF0031,北京鼎国);其余有机试剂为分析纯。
1.2 实验方法
1.2.1 细胞培养 人乳腺癌MCF-7细胞用含10%胎牛血清和1%双抗的DMEM培养基,人宫颈癌C-33A细胞用含10%胎牛血清和1%双抗的RPMI-1640培养基,在37 ℃、5% CO2饱和湿度的细胞培养箱内培养传代。
1.2.2 MTT法检测BTA对细胞生长活性的影响 取培养至对数生长期的MCF-7细胞和C-33A细胞接种于96孔板内,每孔4 000~5 000个细胞,培养12 h使细胞贴壁。向每孔内加入用对应培养基稀释后的BTA储备液,使终浓度分别为2、4、6、8、10、15、20、25、30、40 μmol/L,每个浓度设5个平行孔。同时设阴性对照孔(含DMSO的培养基溶液)和空白对照孔(只含培养基溶液)。共同培养24、48和72 h后,分别于每孔加入MTT溶液10 μL,继续培养4 h后,吸净上清液并弃掉,每孔加入DMSO 200 μL,37 ℃培养20 min后震荡使结晶完全溶解。酶标仪检测490 nm波长处各孔的光密度值(OD值),绘制生长曲线,并按以下公式计算细胞生长抑制率(Inhibition rate,IR):IR=(阴性对照组OD值-加药组OD值)/阴性对照组OD值×100%。以IR值对药物浓度的对数值进行Sigmoidal拟合,计算半数抑制浓度(IC50)值,实验重复进行3次。
1.2.3 流式细胞仪检测BTA对细胞周期的影响 取对数生长期MCF-7细胞和C-33A细胞接种于6孔板内,37 ℃、5% CO2饱和湿度下培养12 h使细胞贴壁。加入BTA溶液,使药物终浓度达到40 μmol/L,每组设3个对照孔。培养24 h后胰酶消化细胞并收集,加入PBS混匀,1 000 r/min离心5 min后弃去上清,重复2遍后移入1.5 mL离心管,注入0.8 mL预冷的70%乙醇溶液,4 ℃过夜固定细胞。PBS冲洗细胞2次除净乙醇,将细胞重悬于1 mL PI染液,37 ℃避光孵育30 min染色后,上机检测细胞周期,实验重复3次。
1.3 统计学分析 采用SPSS 17.0统计学软件,三次独立实验组间比较采用单因素方差分析,两组比较采用双样本t检验,P<0.05为差异有统计学意义。
2 结果
2.1 BTA对2种细胞增殖的影响 MTT法检测结果显示,BTA作用MCF-7细胞24、48、72 h的IC50分别为(37.62±1.72)、(27.32±0.99)、(19.19±0.90)μmol/L。BTA作用C-33A细胞24、48、72 h的IC50分别为(34.55±0.88)、(27.20±1.03)、(16.74±0.79)μmol/L,随着BTA浓度的增加和作用时间的延长,肿瘤细胞受到的抑制作用逐渐增强,差异有统计学意义(P<0.01),结果见图1、图2。
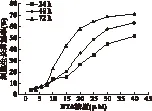
图1 BTA对MCF-7细胞的增殖抑制率曲线
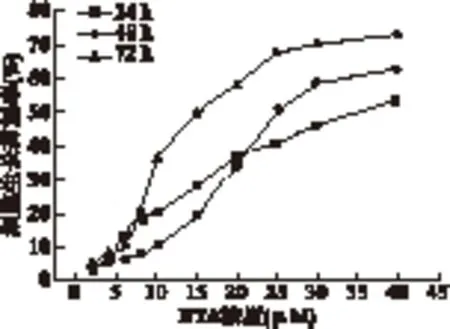
图2 BTA对C-33A细胞的增殖抑制率曲线
2.2 流式细胞仪检测BTA对2种肿瘤细胞周期的影响 从图3可见,实验组与对照组G1期细胞分布分别为(44.17%±1.32%) vs.(54.75%±3.23%);S期分别为(45.32%±3.56%) vs.(31.46%±3.78%);G2期分别为(10.5%±2.87%) vs.(13.79%±2.37%);用BTA处理MCF-7细胞后,G1期的细胞比例减少,S期细胞比例增加,细胞阻滞在S期,并且在G0/G1峰前出现凋亡峰。相同浓度下,BTA对C-33A细胞周期抑制情况与MCF-7细胞不同,由图4可见,实验组与对照组G1期细胞分布分别为(83.74%±1.49%) vs.(79.53%±2.18%);S期分别为(6.55%±0.57%) vs.(12.8%±1.65%);G2期分别为(9.71%±1.19%) vs.(8.33%±0.89%),与对照组相比,G1期细胞比例增加,S期细胞比例减少,G1-S期进程受阻,差异有统计学意义(P<0.05)。
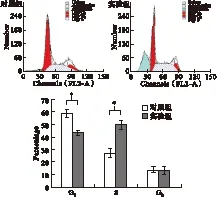
图3 流式检测BTA作用MCF-7细胞24 h后细胞周期的变化
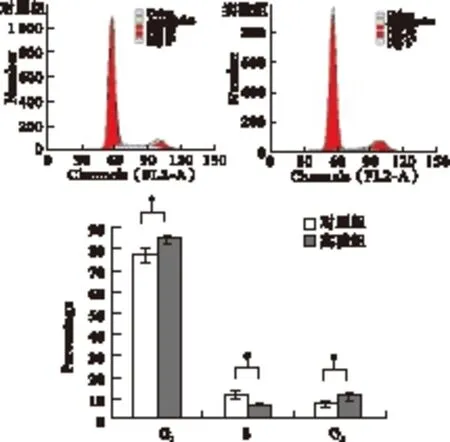
图4 流式检测BTA作用C-33A细胞24 h后细胞周期的变化
3 讨论
乳腺癌和宫颈癌是常见的恶性肿瘤,位居全球女性发病和死亡的前2位,治疗多以手术和放化疗为主,对患者不良反应较大[9]。近年来,随着对中医中药抗肿瘤治疗的深入研究,对肿瘤细胞有抑制作用的中药成分逐渐受到人们的重视[10]。BTA是从中药路路通中分离得到的天然产物,文献报道BTA对人鼻咽癌HONE-1细胞、人口腔表皮样癌细胞KB、人结肠癌HT29细胞有细胞毒作用[11]。体内外研究发现,BTA能抑制人肝癌HepG-2细胞和人胃癌SGC-7901细胞的生长,并可促进小鼠肝癌H22细胞凋亡[12]。本研究结果表明,BTA对MCF-7细胞及C-33A细胞的增殖均有较强的抑制作用,并能诱导MCF-7细胞凋亡。
细胞凋亡是细胞在一定的生理或病理条件下自动结束生命的过程,受内在遗传机制调控,主要通过外源性途径、内源性途径和内质网应激触发[13-14]。研究发现,BTA可以诱导多种肿瘤细胞凋亡,Yang等[10]报道,BTA对胃癌MGC-803细胞和前列腺癌PC3细胞有显著的细胞毒活性。进一步研究发现,BTA通过激活p53蛋白,上调Bax,Caspase-3、Caspase-9蛋白的活性,触发线粒体凋亡通路引起MGC-803细胞凋亡,从而抑制肿瘤细胞增殖。张秀娟等[11]通过对H22荷瘤小鼠的研究发现,BTA可能通过上调p53蛋白的表达诱导H22细胞凋亡,并能阻断G2期、S期细胞向M期的进程,其机制可能与通过抑制PI3K/Akt存活通路有关。细胞周期调控机制的破坏与肿瘤的发生、发展密切相关,本研究结果显示,BTA可引起MCF-7细胞凋亡,使其S期阻滞,与文献报道BTA对H22细胞作用结果一致,推测BTA可激活凋亡蛋白,使细胞停滞在有丝分裂开始之前,从而产生增殖抑制作用;而BTA作用于C-33A细胞后,将其阻滞于G1-S期,使其DNA复制过程受阻,BTA作用于不同细胞系所引起的相关基因或周期蛋白表达的不同,表现在细胞周期被阻滞在不同的阶段,以及是否有凋亡的发生[15]。目前,BTA的抗肿瘤机制研究尚不全面,其对不同成因和发病部位的肿瘤细胞作用靶点不同,由此带来的影响和内在机制有待进一步研究。
综上所述,BTA可以抑制MCF-7细胞以及C-33A细胞增殖,其机制与诱导细胞凋亡、影响细胞周期有关,具体机制还需深入研究,以期为BTA应用于临床治疗提供依据。
[1] 刘秀娟,彭亚南.路路通临床新用[J].内蒙古中医药,2010,29(8):46-47.
[2] 卢元美,沈红云.路路通治疗产后乳胀44例观察[J].临床军医杂志,2007,35(6):951-952.
[3] 殷飞,倪毅.中医分期治疗哺乳期乳腺炎46例[J].广西中医药大学学报,2016,19(2):37-38.
[4] 商洪杰,王文静,李丹毅,等.路路通中1个新的三萜类化合物[J].中草药,2014,45(9):1207-1210.
[5] 张秀娟,李宏伟,季宇彬,等.桦木酮酸对肿瘤细胞SGC-7901、HepG-2及S_(180)荷瘤小鼠肿瘤细胞的影响[J].天然产物研究与开发,2009,21(5):766-770.
[6] 张秀娟,李国媛,季宇彬,等.桦木酮酸对人肝癌细胞及对动物移植性肿瘤H22细胞的影响[J].林产化学与工业,2009,29(1):46-50.
[7] Symon AV,Veselova NN,Kaplun AP,et al.Synthesis and antitumor activity of cyclopropane derivatives of betulinic and betulonic acids[J].Bioorg Khim,2005,31(3):320-325.
[8] Yang S,Zhao Q,Xiang H,et al.Antiproliferative activity and apoptosis-inducing mechanism of constituents from Toona sinensis on human cancer cells[J].Cancer Cell Int,2013,13(1):12.
[9] 王维民,贺媛,冯丹,等.应用体检套餐对女性乳腺癌、宫颈癌筛查结果的分析[J].中国食物与营养,2013,19(8):73-77.
[10]杨志杰,李秀丽.中医药诱导细胞凋亡治疗恶性肿瘤的研究进展[J].中医学报,2013,28(1):18-20.
[11]Chiang YM,Chang JY,Kuo CC,et al.Cytotoxic triterpenes from the aerial roots of Ficus microcarpa[J].Phytochemistry,2005,66(4):495-501.
[12]张秀娟,韩磊,季宇彬,等.桦木酮酸对H22荷瘤小鼠肿瘤细胞周期及相关蛋白表达的影响[J].中国中药杂志,2008,33(14):1739-1743.
[13]Gottesman MM,Fojo T,Bates SE.Multidrug resistance in cancer:role of ATP-dependent transporters[J].Nat Rev Cancer,2002,2(1):48-58.
[14]Xu C,Bailly-Maitre B,Reed JC.Endoplasmic reticulum stress:cell life and death decisions[J].J Clin Invest,2005,115(10):2656-2664.
Effect of betulonic acid on proliferation of human breast cancer MCF-7 cells and human cervical cancer C-33A cells
MU Xiao-ting,QIAN Ping,JIANG Lu-lu,WANG Yue,JIN Xin,ZHANG Dong-fang*
(Department of Pharmacognosy,School of Pharmacy,China Medical University,Shenyang 110122,China)
Objective To study the effect of betulonic acid on proliferation of human breast cancer MCF-7 cells and human cervical cancer C-33A cells.Methods MTT assay was used to observe the effect of BTA on growth of cell MCF-7 and cell C-33A in various concentrations for different time periods.Cell cycle and cell apoptosis of these cells were assessed by flow cytometry.Results MTT results showed that the IC50on MCF-7 cells were (37.62±1.72),(27.32±0.99) and (19.19±0.90) μmol/L after being cultured for 24 h,48 h,and 72 h,while on C-33A cells they were (34.55±0.88),(27.20±1.03) and (16.74±0.79)μmol/L.BTA could significantly inhibit the proliferation of MCF-7 cells and C-33A cells in a dosage-and time-dependent manner (P<0.05).Flow cytometry analysis showed that BTA could induce MCF-7 cells arrest at S phase,and induce apoptosis,while it induced MCF-7 cells arrest at G1-S phase.Conclusion BTA can inhibit the proliferation of MCF-7 cells and C-33A cells;the change of cell cycle and apoptosis may be involved in the process of inhibition.
Betulonic acid;Breast cancer;Cervical cancer;Proliferation inhibition
2016-09-19
中国医科大学药学院中药与生药学教研室,沈阳 110122
*通信作者
10.14053/j.cnki.ppcr.201703004
