右美托咪定对全脑缺氧缺血损伤大鼠海马内星形胶质细胞VEGF表达的影响
2017-03-28谭秀华
陈 戟,谭秀华,庞 韬,詹 鸿
·论著·
右美托咪定对全脑缺氧缺血损伤大鼠海马内星形胶质细胞VEGF表达的影响
陈 戟1,谭秀华1,庞 韬2*,詹 鸿1
目的 探讨右美托咪定对全脑缺氧缺血损伤大鼠海马内星形胶质细胞中血管内皮细胞生长因子(Vascular endothelial growth factor,VEGF)表达的影响。方法 取SD大鼠24只,体重250~280 g,采用随机数字表法将其分为3组(n=8):假手术组(S组)、常规复苏组(C组)和右美托咪定组(D组)。C组和D组采用窒息后心跳骤停法建立大鼠全脑缺氧缺血损伤模型,S组大鼠仅行气管插管不夹闭窒息,D组于气管夹闭前尾静脉注射负荷剂量右美托咪定4 μg/kg,S组和C组分别给予等容量生理盐水。各组大鼠于自主循环恢复后12、24、48及72 h进行神经功能缺失评分(Neuropathy disability score,NDS),于72 h测定NDS后处死大鼠,取海马组织,采用TUNEL法标记检测海马神经元凋亡情况,采用免疫荧光双标法测定各组大鼠海马内星形胶质细胞VEGF的表达情况。结果 与S组比较,C组各时点NDS评分均显著升高(P<0.05);D组大鼠在12 h时NDS评分与C组比较差异无统计学意义(P>0.05),D组大鼠在24、48和72 h三个时点NDS评分显著低于C组(P<0.05)。与S组比较,C组大鼠海马内神经元凋亡率和星形胶质细胞VEGF的表达均升高;与C组比较,D组大鼠海马内神经元凋亡率降低,星形胶质细胞VEGF的表达升高(P<0.05)。结论 右美托咪定可减轻全脑缺氧缺血损伤大鼠脑损伤,降低海马内神经元的凋亡率,其机制可能与促进海马内星形胶质细胞上VEGF的表达有关。
右美托咪定;血管内皮生长因子;星形胶质细胞;脑缺血;脑保护
0 引言
右美托咪定作为一种高选择性α2肾上腺素受体激动剂,在脑保护方面具有积极作用。在大鼠大脑缺血再灌注损伤的研究中发现,右美托咪定可减少海马区神经元凋亡的数量[1],在大脑缺血后,脑组织氧供和血糖严重不足,谷氨酸蓄积引起细胞骨架破坏,右美托咪定通过还原机制增加谷氨酰胺在神经细胞中的代谢,减少脑内兴奋性神经递质的释放[2-3],然而上述机制不能完全解释右美托咪定的脑保护作用。血管内皮细胞生长因子(Vascular endothelial growth factor,VEGF)是血管内皮细胞特异性的有丝分裂原,其激活血管内皮细胞上的受体,并诱导内皮细胞上的磷脂酶C释放Ca2+,刺激细胞内三磷酸肌醇积聚,促进内皮细胞的分裂、迁移和增殖,提高血管通透性,并且诱导大量新生血管形成,增加缺血缺氧组织的血流灌注,减少组织的损伤程度[4-7]。右美托咪定是否通过影响脑内VEGF的表达,对缺血缺氧损伤的脑组织产生保护作用鲜有报道。因此,本研究旨在探讨右美托咪定对全脑缺氧缺血损伤大鼠海马内星形胶质细胞VEGF的作用。
1 材料与方法
1.1 动物选择与分组 健康清洁级雄性SD大鼠24只,体重250~280 g,由广州医科大学医学动物实验中心提供。于室温24 ℃、湿度55%~65%的环境中饲养,自由摄食和饮水。采用随机数字表法,将其分为3组(n=8):假手术组(S组)、常规复苏组(C组)和右美托咪定预处理组(D组)。
1.2 主要仪器与试剂 右美托咪定200 μg/2 mL(江苏恒瑞医药股份有限公司,中国);兔抗大鼠星形胶质细胞GFAP抗体(Abcam公司,美国);小鼠抗大鼠VEGF抗体(Santa公司,美国);多功能生理监护仪(成都泰盟科技有限公司,中国);动物呼吸机(淮北正华生物仪器设备有限公司,中国)。
1.3 大鼠全脑缺氧缺血损伤模型的制备 参考文献[8]的方法,采用窒息后心跳骤停法建立大鼠全脑缺氧缺血损伤模型。C组和D组大鼠腹腔注射10%水合氯醛3.5 mg/kg麻醉后,将大鼠仰卧固定于手术台上。用橡皮筋把大鼠上门齿向后拉牵引固定,用一小棉签轻擦其喉部,清理呼吸道分泌物,无呛咳反射即可行气管插管操作,维持大鼠自主呼吸。使用多功能生理监护仪连续监测无创动脉压和心电图,连接动物呼吸机辅助通气,呼吸频率70次/min,潮气量8 mL/kg,吸呼比为1∶2。待生命体征稳定10 min,于气管夹闭前5 min经尾静脉注射右美托咪定4 μg/kg,S组和C组分别给予等容量生理盐水。30 s后夹闭气管导管致大鼠窒息后心脏骤停,判断大鼠心跳骤停的标准为心电图示心电静止、室颤、心电机械分离以及MAP≤20 mmHg。于心跳骤停后2 min开始心肺复苏,调整呼吸机参数,呼吸频率90次/min,潮气量10 mL/kg,并进行快速胸外心脏按压,频率100次/min,幅度1~2 cm,同时经尾静脉注射肾上腺素0.02 mg/kg。当大鼠出现自主心律及脉搏波、收缩压≥60 mmHg,并持续10 min以上判定为自主循环恢复,即心肺复苏成功,心肺复苏操作超过10 min无效则放弃复苏。自主呼吸恢复后撤离呼吸机,咽反射恢复,吸空气无缺氧表现时拔除气管导管,放回饲养笼中。S组大鼠仅行气管插管但不夹闭窒息。
1.4 神经功能缺陷评分 参照文献[9]的方法,实验前行神经功能缺陷评分(Neuropathy disability score,NDS),排除原发性神经功能缺陷大鼠。各组实验大鼠于自主循环恢复后(C组在拔管后)12、24、48和72 h进行神经功能评分,评分由同一名不清楚分组的研究者完成,从而实现双盲。评分内容包括意识、视觉、听力、嗅觉、呼吸、神经及角膜发射、运动及定向力、对新环境的适应力、饮食及有无癫痫发作等方面,神经功能完全正常为0分,脑死亡为100分。
1.5 脑组织取材及处理 各组大鼠分别在72 h进行神经功能评分后,10%水合氯醛3.5 mg/kg腹腔注射麻醉大鼠,将其固定于手术台后经左心室插管灌注。先用生理盐水200 mL快速灌注,再用4 ℃ 4%多聚甲醛200 mL缓慢灌注后,迅速开颅取脑并分离海马组织。将脑组织置于4%多聚甲醛溶液中固定24 h。
1.6 TUNEL法标记检测凋亡细胞 随机取各组大鼠的4个海马组织,海马延冠状方向做石蜡包埋后连续切片,片厚5 μm。切片常规二甲苯脱腊,梯度酒精脱水后,蒸馏水冲洗。3% H2O2室温处理10 min,蒸馏水冲洗3 min×3次。标本片加TBS 1∶200新鲜稀释ProteinaseK 37 ℃消化15 min,TBS洗1 min×3次。标本片加标记缓冲液(Labeling,buffer),20 μL/片,以保持切片湿润,并置样品于湿盒中,37 ℃标记2 h,TBS洗3 min×3次。用1%的TBS稀释SABC,均匀后50 μL/片加至切片,37 ℃反应60 min,TBS洗5 min×4次。DAB显色10 min,蒸馏水冲洗5 min。苏木素复染1 min。TBS洗,蒸馏水洗。梯度酒精脱水、二甲苯透明、中性树脂封片。应用Image-pro plus 6.0医学图像分析系统分析处理,各组每只大鼠选取5张切片,每张切片在损伤区随机釆集5个高倍(400倍)视野。高倍视野下计算凋亡指数=凋亡细胞数/总细胞数×100%。
1.7 星形胶质细胞和VEGF免疫荧光双染 取各组大鼠剩余的4个海马组织,30%蔗糖溶液脱水,经OCT包埋剂包埋后冰冻,连续切片制成厚度10 μm捞片,漂洗后封闭。分别加入VEGF(1∶500)一抗及GFAP一抗(1∶200)孵育,再分别加入FITC荧光二抗(1∶200)孵育,继之以驴抗兔AlexaFluor 536荧光二抗(1∶200)孵育,经染核、贴片、封片后,于激光共聚焦显微镜下扫描。应用Image-pro plus 6.0医学图像分析系统分析处理,各组每只大鼠选取5张切片,每张切片随机釆集5个高倍(400倍)视野。
2 结果
2.1 不同时点NDS评分的比较 与S组比较,C组各时点NDS评分均显著升高(P<0.05)。D组大鼠在12 h时NDS评分与C组相比差异无统计学意义(P>0.05),D组大鼠在24、48和72 h 3个时点NDS评分与C组相比显著降低(P<0.05),见表1。

表1 各组大鼠不同时点NDS评分比较
注:与S组比较,*P<0.05;与C组比较,#P<0.05
2.2 神经元凋亡率和星形胶质细胞VEGF表达比较 与S组比较,C组大鼠海马内神经元凋亡率和星形胶质细胞VEGF的表达均升高(P<0.05)。与C组比较,D组大鼠海马内神经元凋亡率降低,星形胶质细胞VEGF的表达升高(P<0.05),见图1、图2和表2。

表2 各组大鼠神经元凋亡率和星形胶质细胞VEGF 表达的比较(n=4)
注:与S组比较,*P<0.05;与C组比较,#P<0.05
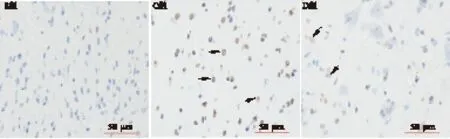
图1 TUNEL染色结果(×400)

图2 免疫荧光双标染色结果(×400)
3 讨论
本研究采用夹闭气管窒息法制备大鼠全脑缺氧缺血损伤模型,是目前研究全脑缺氧缺血损伤常用的动物模型,窒息后机体经历了循环停止、低氧血症、酸中毒、缺血再灌注、应激反应、代谢紊乱等一系列过程,很好地模拟了临床上心源性休克心跳停止后复苏过程可能引起的脑损伤。本研究结果显示,夹闭大鼠气管窒息后均出现心跳停止,复苏后出现了不同程度的神经功能障碍,证实模型制备成功。
右美托咪定是一种高选择性肾上腺素能受体激动剂,具有镇静、镇痛、遗忘、抗焦虑等作用,且无呼吸抑制作用。有研究通过动物脑损伤模型研究发现,右美托咪定能改善脑缺血损伤,明显减轻皮质的损伤,并减少神经元凋亡的数量和脑梗死面积[10-11]。本研究结果表明,右美托咪定可有效降低缺血缺氧脑损伤大鼠的神经功能缺失评分,降低海马内神经元的凋亡率,证实右美托咪定在一定时间范围内具有较好的脑保护作用。
右美托咪定通过参与调节脑血流与脑氧供需产生神经保护作用。Iida等[12]研究发现,心肺复苏时,使用右美托咪定后,脑动脉直径和脑氧摄取保持不变,但减少了心肺复苏期间用于维持血压的去氧肾上腺素的剂量及之后异位心室起搏心率的数量。Chi等[13]通过动物实验证实,出血时使用右美托咪定,可减少局部的脑血流和脑氧耗,保持了一个理想的氧供需平衡状态,从而产生神经保护作用。上述研究均提示右美托咪定的脑保护作用得益于其调控脑血流作用。VEGF作为一种强效的促血管生成因子,具有促进毛细血管再生、保护血管内皮细胞、刺激神经元轴突生长、抑制神经细胞凋亡、调节血管干细胞分化等生物学功能,在缺血缺氧性疾病中发挥着重要作用[14-16]。在脑缺血损伤后,缺血缺氧不仅可以激活血管内皮细胞VEGF表达,还可诱导神经元和星形胶质细胞胞浆表达VEGF,同时激活缺血损伤处血管内皮细胞上的VEGF受体,诱导大量新生血管形成,增加缺氧缺血组织的血流灌注,减少脑组织的损伤程度[17]。本研究证实,对脑缺氧缺血损伤大鼠给予右美托咪定干预治疗后,可显著提高VEGF在海马内星形胶质细胞的表达,提示右美托咪定部分脑保护作用是通过进一步上调VEGF的表达完成的。
综上所述,右美托咪定可减轻全脑缺氧缺血损伤大鼠的脑损伤,降低海马内神经元的凋亡率,其机制可能与促进海马内星形胶质细胞上VEGF的表达有关。
[1] Lin J,Pang H,Guo X,et al.Lentivirus-Mediated RNAi Silencing of VEGF Inhibits Angiogenesis and Growth of Renal Cell Carcinoma in a Nude Mouse Xenograft Model[J].DNA Cell Biol,2015,34(12):717-727.
[2] Lee KH,Lee CH,Jeong J,et al.Neutrophil Elastase Differentially Regulates Interleukin 8 (IL-8) and Vascular Endothelial Growth Factor (VEGF) Production by Cigarette Smoke Extract[J].J Biol Chem,2015,290(47):28438-28445.
[3] Dragoni S,Reforgiato M,Zuccolo E,et al.Dysregulation of VEGF-induced proangiogenic Ca2+oscillations in primary myelofibrosis-derived endothelial colony-forming cells[J].Exp Hematol,2015,43(12):1019-1030.
[4] Greenberger S,Boscolo E,Adini I,et al.Corticosteroid suppression of VEGF-A in infantile hemangioma-derived stem cells[J].N Engl J Med,2010,362(11):1005-1013.
[5] Fornaro M,Rocchi G,Escelsior A,et al.VEGF plasma level variations in duloxetine-treated patients with major depression[J].J Affect Disord,2013,151(2):590-595.
[6] Eichmann A,Simons M.VEGF signaling inside vascular endothelial cells and beyond[J].Curr Opin Cell Biol,2012,24(2):188-193.
[7] Gupta B,Chiang L,Chae K,et al.Phenethyl isothiocyanate inhibits hypoxia-induced accumulation of HIF-1α and VEGF expression in human glioma cells[J].Food Chem,2013,141(3):1841-1846.
[8] Ding XD,Zheng NN,Cao YY,et al.Dexmedetomidine preconditioning attenuates global cerebral ischemic injury following asphyxial cardiac arrest[J].Int J Neurosci,2016,126(3):249-256.
[9] Brambfink AM,Kocrner IP,Diehl K,et al.The antibiotic erythromycin induces tolerance against transient global cerebral ischemia in rats (pharmacologic preconditioning)[J].Anesthesiology,2006,104(6):1208-1215.
[10]Sanders RD,Sun P,Patel S,et al.Dexmedetomidine provides cortical neuroprotection:impact on anaesthetic-induced neuroapoptosis in the rat developing brain[J].Acta Anaesthesiol Scand,2010,54(6):710-716.
[11]Goyagi T,Nishikawa T,Tobe Y,et al.The combined neuroprotective effects of lidocaine and dexmedetomidine after transient forebrain ischemia in rats[J].Acta Anaesthesiol Scand,2009,53(9):1176-1183.
[12]Iida H,Iida M,Ohata H,et al.Effects of dexmedetomidine on cerebral circulation and systemic hemodynamics after cardiopulmonary resuscitation in dogs[J].J Anesth,2006,20(3):202-207.
[13]Chi OZ,Hunter C,Liu X,et al.The effects of dexmedetomidine on regional cerebral blood flow and oxygen consumption during severe hemorrhagic hypotension in rats[J].Anesth Analg,2011,113(2):349-355.
[14]Chiu AP,Wan A,Lal N,et al.Cardiomyocyte VEGF regulates endothelial cell GPIHBP1 to relocate lipoprotein lipase to the coronary lumen during diabetes mellitus[J].Arterioscler Thromb Vasc Biol,2016,36(1):145-155.
[15]Zhou ZC,Gu SZ,Wu J,et al.VEGF,eNOS and ABCB1 genetic polymorphisms may increase the risk of osteonecrosis of the femoral head[J].Genet Mol Res,2015,14(4):13688-13698.
[16]Piotrowski WJ,Kiszakiewicz J,Górski P,et al.Immunoexpression of TGF-β/Smad and VEGF-A proteins in serum and BAL fluid of sarcoidosis patients[J].BMC Immunol,2015,16:58.
[17]Gonçalves FT,Cezario SM,Calastri MC,et al.Influence of VEGF-C936T genetic variant on age-related macular degeneration[J].Arq Bras Oftalmol,2015,78(5):290-294.
Influences of dexmedetomidine on VEGF expressions of hippocampal astrocytes in rats with hypoxic-ischemic brain damage
CHEN Ji1,TAN Xiu-hua1,PANG Tao2*,ZHAN Hong1
(1.Department of Anesthesiology,the Third Affiliated Hospital of Guangzhou Medical University,Guangzhou 510150,China;2.Family Planning Special Hospital of Guangdong,Guangzhou 510600,China)
Objective To explore the influences of dexmedetomidine on expressions of vascular endothelial growth factor (VEGF) of hippocampal astrocytes in rats with hypoxic-ischemic brain damage.Methods Totally 24 SD rats,weighting from 250~280 g,were divided into 3 groups (n=8) with a random number table methods:sham-operation group (group S),the routine cardiopulmonary resuscitation group (group C) and dexmedetomidine group (group D).Hypoxic-ischemic brain damage models in rats were established with asphyxia-induced cardiac arrest method in group C and group D,while rats of group S were given tracheal intubation only rather than occlusion asphyxia.Group D was given load dosage of dexmedetomidine (4 μg/kg) via caudal vein injection before occlusion of trachea,while group S and group C were given same volume of normal saline.Neuropathy disability scores (NDS) were determined at 12 h,24 h,48 h and 72 h after recovery of spontaneous circulation in each group of rats.After determination of NDS at 72 h,the rats were sacrificed to sample hippocampus.TUNEL was used to detect the apoptosis of hippocampal neuron.Immunofluorescence double staining was used to determine VEGF expression in hippocampal astrocytes of rats.Results Compared with group S,NDS scores were significantly increased in group C at each time point (P<0.05).There was no difference between group D and group C in NDS at 12 h (P>0.05);however,rats of group D had significantly decreased NDS at 24 h,48 h and 72 h compared with group C (P<0.05).Apoptosis rate of hippocampal neuron and astrocytes VEGF expressions of group C were higher than those of group S (P<0.05).Compared with group C,apoptosis rate of hippocampal neuron was decreased and astrocytes VEGF expression was increased in group D (P<0.05).Conclusion Dexmedetomidine can reduce hypoxic-ischemic brain damage in rats,and reduce the apoptosis rate of hippocampal neurons.The mechanism may be related to the stimulation of VEGF expression in hippocampus astrocytes.
Dexmedetomidine;VEGF;Astrocyte;Brain ischemia;Cerebral protection
2016-08-09
1.广州医科大学附属第三医院麻醉科,广州 510150;2.广东省计划生育专科医院,广州 510600
*通信作者
10.14053/j.cnki.ppcr.201703001
