L精氨酸对牛肉糜保水性的影响
2017-03-14尚校兰许洪力杨风帆暴彦淮
尚校兰,许洪力,杨风帆,暴彦淮,杨 月
(廊坊师范学院生命科学学院,河北廊坊 065000)

尚校兰,许洪力,杨风帆,暴彦淮,杨 月
(廊坊师范学院生命科学学院,河北廊坊 065000)
本文研究了不同含量L-精氨酸(0、0.15%、0.20%、0.25%、0.30%、0.35%)处理对牛肉糜保水性的影响。扫描电镜(SEM)图谱表明,L-精氨酸有利于牛肉糜组织形成良好状态的三维网状凝胶。随着L-精氨酸添加量的增大,牛肉糜的蒸煮损失先显著降低(p<0.05)后升高(p>0.05),pH升高而肌浆蛋白溶解度降低;当添加0.25% L-精氨酸时,牛肉糜具有最小的蒸煮损失及最高含量的巯基及表面疏水基团,0.25% L-精氨酸处理能使巯基及表面疏水基团的含量分别增大11倍和1.5倍。
L-精氨酸,牛肉糜,保水性
牛肉在热加工过程中会有50%甚至以上的蒸煮损失,这不仅会降低企业的利润,还会造成营养成分的损失(如水溶蛋白流失)及食用时口感的下降(如嫩度下降)。因此,如何保持牛肉肌肉组织中的水分,是牛肉制品加工过程中首要解决的问题之一。市场上常用的保水方法是向牛肉制品中添加磷酸盐,但磷酸盐添加量大于0.5%时,不仅会使肉制品组织结构粗糙、产生不良风味,而且会对人体造成一定的危害,如短时间内可能会导致腹痛与腹泻,长期则会导致机体的钙磷比失衡,并有可能造成亚硝酸盐残留量的升高[1-2]。因此,越来越多的人开始对物理保水方法和无磷的化学保水方法进行研究。尚校兰等[3]利用超高压处理海鲈鱼肌肉组织,并和磷酸盐的保水作用进行了对比,发现使用400 MPa的压力处理和加入1.0 g/kg磷酸三钠、2.0 g/kg三聚磷酸钠、1.0 g/kg焦磷酸钠、1.5 g/kg六偏磷酸钠处理海鲈鱼肌肉组织的蒸煮损失均能达到25%左右。李雪姣等[4]制备了一种无磷保水剂:苹果酸钠4%、醋酸钠1.5%、氯化钠1.5%、水93%,能使牛肉的蒸煮损失降低14.79%。Alvarez等[5]研究了糯玉米淀粉对沙丁鱼糜凝胶结构、保水性和微观结构的影响,发现2~8 g/100 g淀粉可保持78%的水分。
精氨酸是一种碱性氨基酸[6],能提高肉制品的pH,使肉制品的pH远离其等电点。近几年有学者对添加精氨酸提高肉糜保水性进行了报道。李俊[7]认为添加0.6%精氨酸和0.8%赖氨酸能提高猪肉肠的保水性,改善质构;秦浩[8]研究了不同NaCl浓度下精氨酸高添加量(>0.35%)对鸡肉肠保水性的影响,但两人均未从巯基含量、表面疏水性及蛋白质溶解度方面对保水性进行深入研究。本研究拟将不同浓度(0%~0.35%)的L-精氨酸添加到牛肉糜中,通过蒸煮损失法测定牛肉糜的水分损失,通过扫描电镜观察肌肉组织的空间网格状结构,通过分光光度法测定巯基含量、表面疏水性的变化,并通过研究添加L-精氨酸前后牛肉糜的pH、蛋白质溶解度的变化,分析L-精氨酸对牛肉糜保水性的影响,该研究结果将会为牛肉精深加工提供一定的理论参考。
1 材料与方法
1.1 材料与仪器
新鲜牛肉 购于廊坊元辰超市;L-精氨酸 郑州升达食品添加剂有限公司;5,5′-二硫代-2-硝基苯甲酸(DTNB)、N-苯基-8-萘胺-1-磺酸(ANS) 美国Sigma公司;牛血清白蛋白、戊二醛、乙醇、醋酸异戊醋等 均为国产分析纯。
ZB-40型斩拌机 沈阳吉祥食品机械有限公司;CTH2050R冷冻离心机 美国Thermo Fisher科技有限公司;RF-5301荧光分光光度计 日本岛津公司;SP-2102UV紫外-可见分光光度计 上海光谱仪器有限公司;JMS-6380LV扫描电子显微镜 日本电子公司;PH-3CW微机型酸度计 上海理达仪器厂;高速均质机 上海世赫机电设备有限公司等。
1.2 实验方法
1.2.1 牛肉糜生产工艺流程 新鲜牛肉(当天宰杀)→切碎(使用斩拌机斩拌3 min)→牛肉糜。
1.2.2 指标测定
1.2.2.1 蒸煮损失的测定 牛肉糜分别加入不同含量(0、0.15%、0.20%、0.25%、0.30%、0.35%)的L-精氨酸,混合均匀后,放入蒸煮袋后于80 ℃恒温水浴中加热10 min,取出后于室温下冷却,剪开蒸煮袋,用纸巾拭干样品表面的水分,称重,按照以下公式计算蒸煮损失(Cooking Loss,CL)检测重复3次。
式中:m1为蒸煮前的质量,m2为蒸煮后的质量。
1.2.2.2 肉糜微观结构 将牛肉糜制成灌肠[9],80 ℃下煮制30 min,切取小块(3 mm×3 mm×1 mm),以3%戊二醛固定过夜,然后用生理盐水漂洗和25%~100%乙醇梯度脱水,再使用50%~100%醋酸异戊醋梯度置换出乙醇后,真空干燥,喷金,扫描电子显微镜观察[10]。
1.2.2.3 肌原纤维蛋白的提取及含量的测定 肌原纤维蛋白的提取参照胡永金等[10]的方法。将添加不同含量L-精氨酸(0、0.15%、0.20%、0.25%、0.30%、0.35%)的牛肉糜中加入5倍(m/V)0.05 mol/L KCl-20 mmol/L Tris-HCl缓冲液(pH7.0),混匀,4 ℃、9000 r/min离心10 min,弃去上清液,重复洗涤1次。沉淀加入4倍(m/V)0.6 mol/L KCl-20 mmol/L Tris-HCl缓冲液,10000 r/min匀浆90 s。过滤结缔组织,静置30 min以充分溶解蛋白,4 ℃、9000 r/min离心20 min,所得上清液即为肌原纤维蛋白溶液。肌原纤维蛋白浓度采用双缩脲法测定,以牛血清白蛋白(BSA)作为标准蛋白。
1.2.2.4 牛肉糜肌原纤维蛋白巯基含量的测定 巯基(-SH)含量测定参考Benjakul等的方法[11]。计算公式如下:
式中:CO,巯基的摩尔浓度,mol/105g;A,412 nm处的吸光值;D,稀释倍数;ξ,分子吸光系数,13600(mol-1·cm-1);C,蛋白质浓度,mg/mL。
1.2.2.5 牛肉糜肌原纤维蛋白溶液表面疏水性的测定 参考Benjakul等的方法[12],使用ANS作为探针。使用0.6 mol/L NaCl溶液提取牛肉糜肌原纤维蛋白,并用10 mmol/L磷酸缓冲液(pH6.0)稀释,使肌原纤维蛋白的浓度分别达到0.1、0.2、0.3、0.4和0.5 mg/mL。向4 mL的蛋白溶液中加入20 μL浓度为8 mmol/L的ANS探针(pH7.0)。使用荧光分光光度计测定其荧光强度,激发波长380 nm,发射波长475 nm。空白用磷酸钾缓冲液替代,按下式计算肌原纤维蛋白溶液的相对荧光值。
式中:R-相对荧光值;F-Pro-ANS的荧光值;F0-ANS的荧光值。
以肌原纤维蛋白溶液的浓度(mg/mL)为横坐标,相对荧光值R为纵坐标作图,初始斜率即为肌原纤维蛋白蛋白溶液的表面疏水性S0ANS。
1.2.2.6 牛肉糜pH的测定 10 g牛肉糜加入90 mL蒸馏水,12000 r/min下均质20 s,于室温放置20 min。过滤取上清液,用pH计测定酸度。
1.2.2.7 牛肉糜蛋白溶解度的测定 参照Joo等[13]的方法测定牛肉糜总可溶蛋白、肌浆蛋白和肌原纤维蛋白的溶解度,溶解度用蛋白含量表示,采用双缩脲法测定,表述方式为mg/g牛肉。
肌肉总可溶蛋白的提取:准确称取1.00 g牛肉,绞碎后加入20 mL含1.1 mol/L KI的0.1 mol/L磷酸盐缓冲液(4 ℃,pH7.2),于冰浴条件下高速均质(8000 r/min,20 s×3),然后置于4 ℃条件下振荡混匀12 h,冷冻离心(1500×g,20 min),上清液即为总可溶蛋白溶液,溶解度用蛋白含量表示,采用双缩脲法测定,表述方式为mg/g牛肉。
肌浆蛋白的提取:准确称取1.00 g牛肉,绞碎后加入10 mL预冷的0.025 mol/L磷酸钾缓冲液(pH7.2),于冰浴条件下高速均质(8000 r/min,20 s×3),然后置于4 ℃条件下振荡混匀12 h,冷冻离心(1500×g,20 min),上清液即为肌浆蛋白溶液,溶解度用蛋白含量表示,采用双缩脲法测定,表述方式为mg/g牛肉。
肌原纤维蛋白溶解度=肌肉总可溶蛋白溶解度-肌浆蛋白溶解度
1.3 数据处理
采用Excel和SPSS 16.0软件进行统计学处理,n=3,p<0.05具有显著性差异,p<0.01具有极显著性差异。
2 结果与分析
2.1 L-精氨酸含量对牛肉糜蒸煮损失的影响
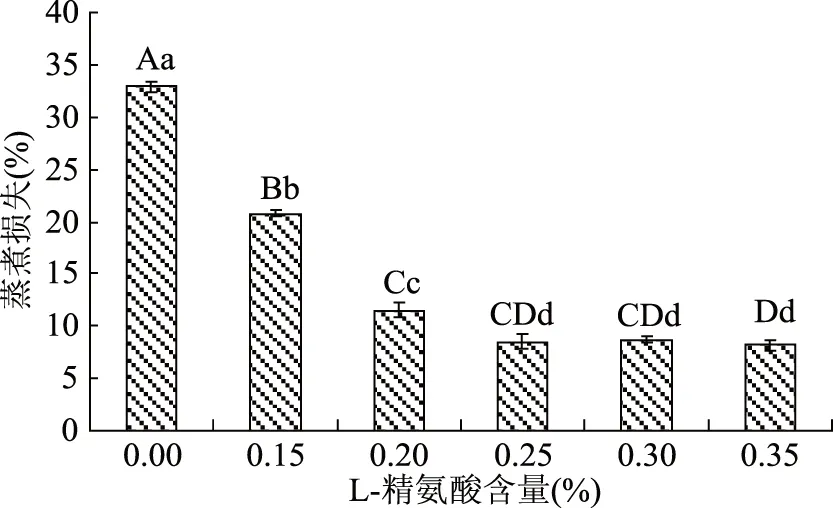
图1 不同浓度L-精氨酸处理对牛肉糜蒸煮损失的影响Fig.1 Effect on cooking loss of miced beef with different concentration L-arginine
图1为不同浓度L-精氨酸处理对牛肉糜蒸煮损失的影响。实验结果表明:随着L-精氨酸添加量的升高,蒸煮损失逐渐降低,至0.25%以后蒸煮损失基本维持在8%左右;与未添加L-精氨酸的牛肉糜(空白对照组,蒸煮损失为32.9%)相比,所有添加L-精氨酸的牛肉糜的蒸煮损失均极显著降低(p<0.01);与添加0.2% L-精氨酸的相比,添加0.25%、0.30%、0.35% L-精氨酸的牛肉糜蒸煮损失显著降低(p<0.05);与添加0.25% L-精氨酸的牛肉糜相比,添加0.30%和0.35%的牛肉糜的蒸煮损失无显著性变化(p>0.05)。
这和Zhou等[14]研究发现0.2% L-精氨酸不能有效地降低猪肉肠的蒸煮损失,当L-精氨酸添加量达到0.6%时,才能有效降低猪肉肠蒸煮损失的结论不一致,具体原因有待进一步研究。
2.2 扫描电镜(SEM)下牛肉糜结构
图2为5000倍的放大倍数下牛肉糜的SEM图。新鲜牛肉组织为有规则的纤维状结构,本实验牛肉经过了斩拌、加热处理,肌球蛋白头部和尾部发生聚集,热诱导促使形成凝胶网格结构[15]。由图2可知:未添加L-精氨酸的牛肉糜组织呈现凝胶状三维网格结构[16],孔隙较大;而0.25% L-精氨酸能促使牛肉糜组织更加紧密,孔隙明显减小,形成更为致密的凝胶网格结构,使水分更多的锁嵌入组织中,从而提高其保水性,这和前面蒸煮损失测定的结果一致。

图2 扫描电镜观察L-精氨酸处理的牛肉糜超微结构(5000×)Fig.2 Microstructure of miced beef by SEM with L-arginine(5000×)
2.3 牛肉糜中肌原纤维蛋白含量
根据双缩脲法测定的肌原纤维蛋白含量为(42.6±1.1) mg/g,通过凯氏定氮法测得的牛肉糜中粗蛋白含量为(200.2±3.6) mg/g,故牛肉糜肌原纤维蛋白含量占其粗蛋白含量的21.28%。
2.4 L-精氨酸含量对牛肉糜肌原纤维蛋白巯基含量的影响
巯基是蛋白质结构的重要功能基团,对其功能性质的发挥起着非常重要的作用。图3为L-精氨酸含量对牛肉糜肌原纤维蛋白中巯基的影响。
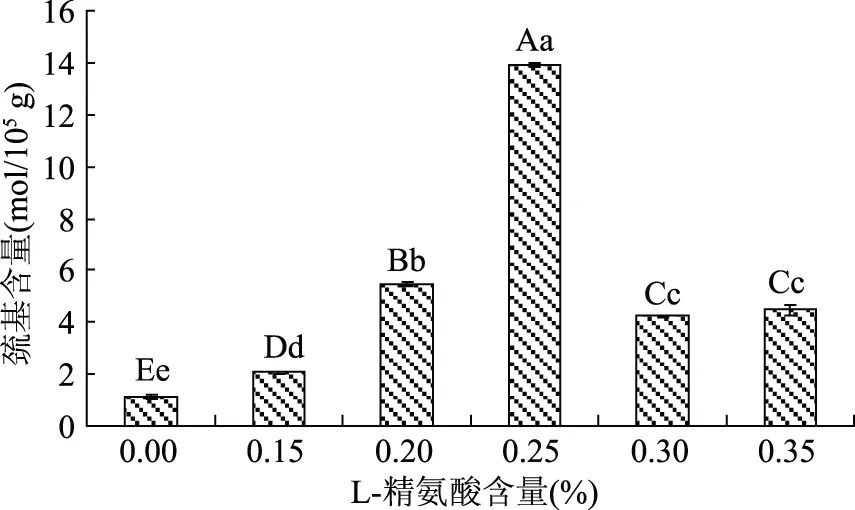
图3 L-精氨酸处理后牛肉糜肌原纤维蛋白巯基含量的变化Fig.3 Changes in sulfhydryl content of miced beef with different concentration L-arginine
由图3可以看出,不同浓度L-精氨酸处理后,肌原纤维蛋白巯基含量相差很大,空白对照组的巯基含量为(1.14±0.09)mol/105g,而经过L-精氨酸处理后,巯基含量均极显著升高(p<0.01),0.25% L-精氨酸处理时达到最大(13.9±0.07) mol/105g,与空白对照组相比,增加了11倍,随后下降并维持稳定。这可能是因为,L-精氨酸使肌球蛋白的活性位点发生变化,隐藏于蛋白结构内部的巯基暴露于蛋白表面[17],当L-精氨酸添加量继续增大时,蛋白质的变性程度过大,蛋白质聚集的更加坚实,使巯基暴露的面积减少,同时形成的凝胶结构不利于水分的保持[18]。
2.5 L-精氨酸含量对牛肉糜肌原纤维蛋白表面疏水性的影响
在蛋白质中具有疏水相互作用的基团为芳香族残基,均匀地分布在肌球蛋白分子尾部,包埋于α-双螺旋之间的界面内,主要包括酪氨酸(Tyr)、色氨酸(Trp)和苯丙氨酸(Phe),与大多数内源光吸收和荧光有关[12]。当肌原纤维蛋白分子发生变性时,内部的疏水性氨基酸暴露于表面,能与ANS(1-苯氨基萘-8-磺酸)探针结合,呈现荧光,且肌原纤维蛋白的相对荧光强度与其表面疏水性成正相关。本实验采用ANS作为非极性荧光探针,并以肌原纤维蛋白与ANS反应产生的相对荧光强度的变化来研究L-精氨酸处理对牛肉糜肌原纤维蛋白表面疏水性的变化,结果见图4。
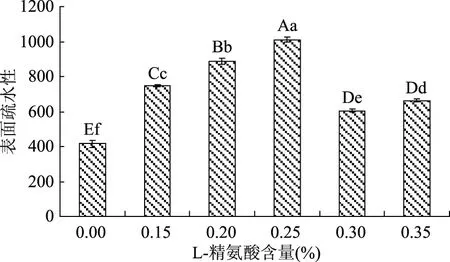
图4 不同浓度L-精氨酸处理后牛肉糜肌原纤维蛋白表面疏水性的变化Fig.4 Changes in surface hydrophobicity of miced beef with different concentration L-arginine
图4表明经过L-精氨酸处理,肌原纤维蛋白的表面疏水性增加,且随着L-精氨酸添加量的升高,表面疏水性上升,0.25%时达到最大(和空白对照组相比,增加了1.5倍)。但L-精氨酸添加量超过0.25%后,表面疏水性下降,且各精氨酸添加处理组肌原纤维蛋白表面疏水性均极显著高于空白对照组(p<0.01)。这可能是因为蛋白质的过度变性使肌球蛋白分子尾部过度聚集[19],引起牛肉组织的结构过于紧密,使亲水基团和疏水基团总量的下降,从而使表面疏水性降低。
2.6 牛肉糜pH变化
牛肉宰后1 h内pH为6.2,随着宰后时间的延长,乳酸积累,pH下降。L-精氨酸为碱性氨基酸[6],加入L-精氨酸能增加牛肉糜的pH。图5表明,随着L-精氨酸添加量的升高,牛肉糜的pH升高;和空白对照组相比,加入L-精氨酸的牛肉糜pH均极显著升高(p<0.01)。pH的增加能使肌原纤维蛋白偏离其等电点[20],提高其保水性,这和费英[21]的研究结果相一致。本研究中当pH为6.54时(此时L-精氨酸添加量为0.25%),牛肉糜蒸煮损失最少。
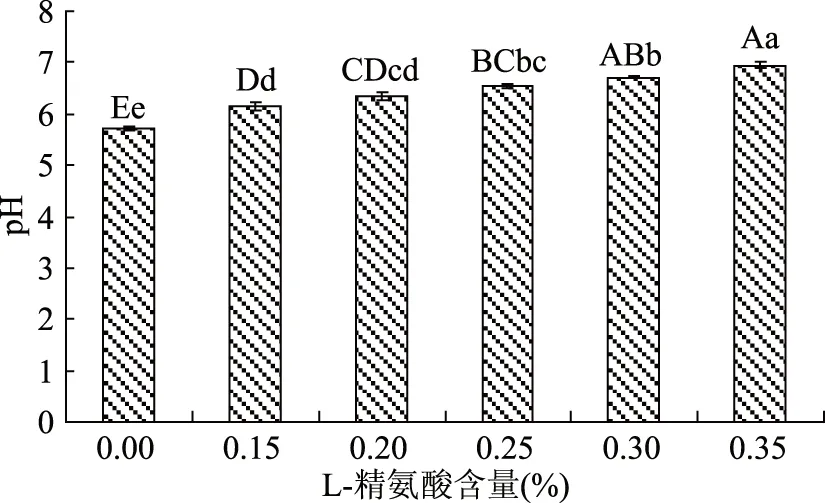
图5 不同浓度L-精氨酸处理后牛肉糜pH的变化Fig.5 Changes in pH of miced beef with different concentration L-arginine
2.7 L-精氨酸处理对牛肉糜蛋白溶解度的影响
图6表明,随着L-精氨酸添加量的增加,牛肉糜总可溶性蛋白的溶解度逐渐降低,和空白对照组相比,经过L-精氨酸处理后总可溶蛋白的溶解度均极显著降低(p<0.01)。添加0.15% L-精氨酸和0.20% L-精氨酸相比,溶解度变化不显著(p>0.05);添加0.15%、0.20%、0.25%、0.30% L-精氨酸样品的溶解度均极显著(p<0.01)高于0.35% L-精氨酸处理组。
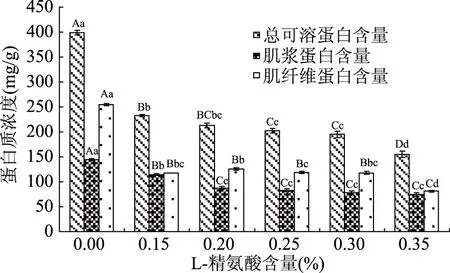
图6 不同浓度L-精氨酸处理对牛肉糜蛋白溶解度的影响Fig.6 Changes in protein solubility of miced beef with different concentration L-arginine
对于肌浆蛋白来说,和空白对照组相比,经过L-精氨酸处理的牛肉糜肌浆蛋白溶解度均极显著降低(p<0.01)。添加0.20%、0.25%、0.30%、0.35% L-精氨酸的肌浆蛋白相比,溶解度变化不显著(p>0.05);与添加0.15% L-精氨酸的相比,添加0.20%、0.25%、0.30%、0.35%的肌浆蛋白溶解度均极显著降低(p<0.01)。研究认为,肌浆蛋白溶解度和保水性呈现很强的负相关[22],因此肌浆蛋白溶解度的降低意味着保水性的提高。本实验表明,适当的L-精氨酸含量有利于牛肉糜保水性的提高,但当L-精氨酸添加量超过0.20%后,牛肉糜保水性的提高不显著。
对于肌原纤维蛋白来说,和空白对照组相比,经过L-精氨酸处理的牛肉糜肌原纤维蛋白均极显著降低(p<0.01)。添加0.15%、0.30% L-精氨酸的肌原纤维蛋白相比,溶解度变化均不显著(p>0.05)。和添加0.35%的相比,添加0.15%、0.20%、0.25%、0.30%的溶解度均极显著升高(p<0.01)。这表明,肌原纤维蛋白的溶解度的变化和保水性并无规律的相关性。但添加L-精氨酸后肌原纤维蛋白的溶解度为何会显著降低,有待于今后深入探讨。
3 结论
添加L-精氨酸有利于牛肉糜保水性的提高,当L-精氨酸添加量为0.25%时,牛肉糜具有最小的蒸煮损失(8.5%)。扫描电镜图谱表明,L-精氨酸有利于牛肉组织形成良好状态的三维网状凝胶。这可以从以下三点解释:L-精氨酸会引起牛肉肌原纤维蛋白巯基含量和表面疏水性含量的变化,0.25% L-精氨酸处理能使巯基及表面疏水基团的含量分别增大11倍和1.5倍。巯基暴露面积增大、表面疏水基团增多,均有利于蛋白质三维网状结构形成,从而有利于水分锁在牛肉组织中。L-精氨酸有利于提高牛肉糜pH,使肌原纤维蛋白偏离其等电点,从而提高其保水性。肌浆蛋白溶解度和保水性呈负相关,L-精氨酸有利于降低肌浆蛋白溶解度,从而提高牛肉糜保水性。
[1]李俊,韩卓,檀胜江,等. 磷酸盐在肉制品加工中作用及替代物研究进展[J]. 肉类研究,2013,27(2):25-28.
[2]吴晓梅,许月季,王晓妮,等. 低磷饮食干预对维持性血液透析患者钙磷代谢的影响[J]. 上海护理,2013,13(5):35-36.
[3]尚校兰,刘安军. 超高压处理与添加复合磷酸盐对海鲈鱼保水性的比较[J]. 食品科学,2013,34(6):56-59.
[4]李雪姣,马悦培,谌徽,等. 无磷酸盐制剂对牛肉嫩度和保水性的影响[J]. 食品工业科技,2010,31(3):109-111.
[5]Alvarez C,Couso I,Solas M,et al. Waxy corn starch affecting texture and ultrastructure of sardine surimi gels[J]. Zeitschrift für Lebensmitteluntersuchung und-Forschung A,1997,204(2):121-128.
[6]Witte M B,Barbul A. Arginine physiology and its implication for wound healing[J]. Wound Repair and Regeneration,2003,11(6):419-423.
[7]李俊. 赖氨酸和精氨酸分别对猪肉肠品质特性影响的研究[D]. 合肥:合肥工业大学,2013:15-31.
[8]秦浩. L-精氨酸在改善鸡肉肠持水与质构中的应用研究[D]. 合肥:合肥工业大学,2015:11-25.
[9]王文艳,彭增起,周光宏. 中式香肠的制作[J]. 肉类工业,2006(6):5-6.
[10]胡永金. 淡水鱼糜发酵及其凝胶形成机理研究[D]. 无锡:江南大学,2007:56-68.
[11]Benjakul S,Seymour T A,Morrissey M T,et al. Physicochemical changes in Pacific whiting muscle proteins during iced storage[J]. Journal of Food Science,1997,62(4):729-733.
[12]Benjakul S,Visessanguan W,Thongkaew C,et al. Comparative study on physicochemical changes of muscle proteins from some tropical fish during frozen storage[J]. Food Research International,2003,36(8):787-795.
[13]Joo S T,Kauffman Rg,Kim Bc,et al. The relationship of sarcoplasmic and myofibrillar protein solubility to colour and water-holding capacity in porcine longissimus muscle[J]. Meat Science,1999,52(3):291-297.
[14]Zhou C L,Li J,Tan S J,et al. Effects of L-Arginine on Physicochemical and Sensory Characteristics of Pork Sausage[J]. Advance Journal of Food Science and Technology,2014,6(5):660-667.
[15]Samejima K,Lshioroshi M,Yasui T. Relative roles of the head and tail of the molecule in heat-induced gelation of myosin[J]. Journal of Food Science,1981,46(5):1412-1418.
[16]Mao R,Tang J,Swanson B G. Water holding and microstructure of capacity gellan gels[J]. Carbohydrate Polymers,2001,46(4):365-371.
[17]Hofmann K,Hamm R. Sulfhydryl and Disulfide Groups in Meats[J]. Advances in Food Research,1978,24:1-111.
[18]郑捷,尚校兰,刘安军. 超高压处理对海鲈鱼鱼肉凝胶形成作用[J]. 食品科学,2013,34(19):88-92.
[19]罗晓玲. 马鲛鱼鱼糜超高压凝胶化工艺研究[D]. 无锡:江南大学,2010:11-35.
[20]Puolarme E,Halonen M. Theoretical aspects of water-holding in meat[J]. Meat Science,2010,86(1):151-165.
[21]费英,韩敏义,杨凌寒,等. pH对肌原纤维蛋白二级结构及其热诱导凝胶特性的影响[J]. 中国农业科学,2010,43(1):164-170.
[22]Lopez-Bote C,Warriss P D,Brown S N. The use of muscle protein solubility measurements to assess pig lean meat quality[J]. Meat Science,1989,26(3):167-175.
Effect of L-arginine on water holding capacity of miced beef
SHANG Xiao-lan,XU Hong-li,YANG Feng-fan,BAO Yan-huai,YANG Yue
(College of Life Science,Langfang Teachers College,Langfang 065000,China)
The effect of different content of L-arginine(0,0.15%,0.20%,0.25%,0.30%,0.35%)on water holding capacity of miced beef was investigated. Scanning electron microscopic(SEM)observations indicated that L-arginine was beneficial to the formation of good gel networks. With the increase of the amount of L-arginine,cooking loss was significantly decreased then not significant increased,pH value was increasing and sarcoplasmic protein solubility was decreasing. It had the lowest cooking loss and highest contents of sulfhydryl groups and surface hydrophobic groups while adding 0.25% L-arginine,which could induce the contents of sulfhydryl and surface hydrophobic groups increase 11 times and 1.5 times,respectively.
L-arginine;miced beef;water holding capacity
2016-08-09
尚校兰(1985-),女,博士研究生,讲师,研究方向:肉制品和水产品加工,E-mail:iris381@163.com。
河北省教育厅青年基金项目(QN2016164);廊坊师范学院博士基金项目(LSLB201602)。
TS251.5+<2 class="emphasis_bold">2 文献标识码:A2
A
:1002-0306(2017)04-0306-05
10.13386/j.issn1002-0306.2017.04.049
