扩散张量成像对浸润性乳腺癌新辅助化疗疗效评估*
2016-08-01刘亚婷范光明黄曌殊张飘层阮志兵聂红昉
刘亚婷, 范光明, 黄曌殊, 张飘层, 阮志兵, 聂红昉
(贵州医科大学附院 放射科, 贵州 贵阳 550001)
扩散张量成像对浸润性乳腺癌新辅助化疗疗效评估*
刘亚婷, 范光明, 黄曌殊, 张飘层, 阮志兵, 聂红昉
(贵州医科大学附院 放射科, 贵州 贵阳550001)
[摘要]目的: 探讨磁共振扩散张量成像(DTI)对浸润性乳腺癌新辅助化疗(NAC)早期疗效评估的可行性。方法: 根据NAC第1周期结束时表观扩散系数(ADC)值和各向异性指数(FA)值的变化幅度,将30例患者(共有38个病灶)分为反应组和相对无反应组,比较两组患者NAC前及第1周期结束时肿瘤的最大径线、ADC值及FA值。结果: 30例患者中反应组23例,共29个病灶,相对无反应组7例,共9个病灶;反应组NAC第1周期结束时肿瘤最大径较NAC前减小,ADC值较NAC前升高,FA值较NAC前明显下降(P<0.05);而相对无反应组NAC前及第1周期结束时肿瘤最大径、ADC、FA值变化不显著(P>0.05),反应组NAC前ADC值低于相对无反应组(P<0.05);反应组NAC前FA值略低于相对无反应组,差异无统计学意义(P>0.05)。结论: 乳腺癌新辅助化疗早期ADC值和FA值的变化可作为化疗疗效的评价指标。
[关键词]乳腺肿瘤; 磁共振成像; 扩散张量成像; 新辅助化疗; 疗效
乳腺癌已成为我国女性最常见的恶性肿瘤之一,对浸润性乳腺癌患者术前行新辅助化疗(neoadjuvant chemotherapy,NAC)可有效缩小原发肿瘤的体积,降低乳腺癌的分期,使手术切除肿瘤灶甚至保乳手术成为可能[1]。如何在化疗早期准确判断肿瘤对化疗药物是否敏感,对于乳腺癌患者个体化治疗方案的制订具有重要意义。近年来MRI动态增强(dynamic contrast enhanced MRI,DCE-MRI)及弥散加权成像(diffusion weighted imaging,DWI)已较广泛应用于乳腺癌的诊断及NAC疗效的评估中。与之相比,扩散张量成像(diffusion tensor imaging, DTI)在乳腺癌NAC疗效评估上的研究少有报道[2]。目前,大部分学者对于DTI的研究主要致力于乳腺病变的定性和DTIb值的优化[3-4]。因此,本文旨在通过分析乳腺癌NAC早期DTI各向异性指数(fractional anisotropy,FA)的变化,为临床早期判断肿瘤对化疗药物的敏感性提供一定帮助。
1对象与方法
1.1对象及分组

1.2检查方法和图像分析
30例患者术前均采用多西紫杉醇联合表柔比星方案治疗,每14 d为1个治疗周期。分别于化疗前1周内、化疗第1周期结束7 d内行DTI和DCE-MRI或T2WI脂肪抑制检查。采用Philip Achieva 3.0T超导型磁共振扫描仪,患者俯卧位,双乳自然悬垂于专用乳腺线圈洞穴内。扫描参数如下, DTI为TR=7 711 ms,TE=70 ms,层厚2 mm,间隔0 mm,激励次数3,视野340 mm×340 mm×158 mm,b值600 s/mm2,梯度方向数6。DCE-MRI为TR=4.5 ms,TE=2.3 ms,层厚2 mm,间隔0 mm,激励次数1,视野340 mm×340 mm×158 mm。T2WI脂肪抑制为TR=7 990 ms,TE=70 ms,层厚4 mm,间隔0,激励次数1,视野340 mm×340 mm×158 mm。采用扎喷替酸葡甲胺(Gd-DTPA 0.1 mmol/kg)以2.0 mL/s由高压注射器从手背静脉推注,并同时注入等量生理盐水。采用常规感兴趣区(region of interest, ROI)方法测量ADC和FA的平均值,选择病变中心层面,手动勾画ROI,通常ROI区域小于病灶直径,位于病灶中央,避开坏死、出血、囊变区及钙化。肿瘤最大径的测量:选取肿瘤中心层面,测量NAC前和第1周期化疗结束时肿瘤的最大直径。若病灶为多发结节,则肿瘤的最大径为各个结节最大径之和(最大径 <0.1 cm的病灶忽略不计)。
1.3观察指标
记录2组患者NAC前ADC值和FA值,第1周期化疗结束时ADC值和FA值,同时比较NAC第1周期前后肿瘤中心层面的最大径值。
1.4统计学方法

2结果
2.1患者基本情况及分组
30例患者NAC前ADC为(1.18×10-3±0.186)mm2/s,NAC前FA为0.395±0.083。30例患者共有38个病灶,其中反应组23例,共29个病灶;相对无反应组7例,共9个病灶。
2.2肿瘤最大径
反应组NAC第1周期结束时肿瘤的最大径较化疗前减小,差异有统计学意义(P<0.05);相对无反应组NAC第1周期前后肿瘤的最大径变化不显著,差异无统计学意义(P>0.05),见表1。
2.3ADC和FA值
反应组NAC第1周期结束时ADC值较化疗前升高,差异有统计学意义(P<0.05);反应组NAC第1周期后FA值较化疗前下降,差异有统计学意义(P<0.05)。相对无反应组NAC第1周期结束时ADC和FA值较化疗前均无明显变化,差异无统计学意义(P>0.05)。见表1。
2.4NAC前ADC和FA值
反应组NAC前ADC值低于相对无反应组(P<0.05),反应组NAC前FA值略低于相对无反应组,差异无统计学意义(P>0.05),见表1。
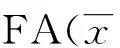
表1 两组患者NAC前和化疗第1周期结束时肿瘤最大径、ADC及±s)
(1)与NAC前无反应组比较,P<0.05
3讨论
传统的影像学方法,如乳腺钼靶、超声、DCE-MR和DWI等,主要是通过观察肿瘤大小、形态及血流动力学的变化来判断化疗疗效,但肿瘤化疗后细胞或分子水平的变化要明显早于肿瘤体积的变化。DTI利用水分子各向异性的弥散特征,对多个方向水分子的自由弥散各向异性进行量化[5],从细胞或分子水平评价肿瘤对化疗药物是否敏感,可为乳腺癌新辅助化疗疗效的早期监测和评估提供依据[6]。
有研究显示,任何参数若大于均值的2~3个SD,可以用来区分正常与非正常组或反应组与相对无反应组,这是因为均值加减2~3个SD可覆盖95%或99%的可能情况[7-8],所以本研究以此为分组依据。结果显示NAC第1周期结束时反应组肿瘤最大径稍减小,而ADC值明显升高,FA值明显下降,说明NAC早期ADC值和FA值的变化要先于肿瘤形态学的改变。与之相比,相对无反应组肿瘤最大径、ADC值和FA值均无明显变化,提示新辅助化疗早期ADC值和FA值的变化可用于预测肿瘤对化疗药物的敏感性。ADC值反映体内水分子的扩散速度和范围,与扩散方向无关,水分子弥散运动越明显,ADC值则越高[9]。应用DTI技术测得的ADC值,可较真实地反映肿瘤细胞内水分子的运动情况[10]。研究表明,ADC值与病灶内肿瘤细胞密度呈负相关,而与其内间质成分的含量呈正相关[11]。化疗药物进入病灶后,破坏肿瘤细胞,改变了细胞膜的完整性和通透性,使得细胞膜对水分子的限制明显降低,ADC值增加。随着肿瘤细胞的死亡,癌灶区细胞密度逐渐下降,细胞外间隙增加,因而有更多的空间让水分子扩散,这也致使ADC值增加。Lee KC等[12]在对接种MX-1细胞株的乳腺癌动物模型进行研究时发现,接受环磷酰胺治疗的动物模型,在第4天和第7天所测得的ADC值均有明显升高,而这种改变出现在肿瘤形态学变化之前。FA值为水分子在组织内扩散各向异性成分与整个扩散张量的比值,反映水分子在弥散过程中方向和速度的不均匀性,FA值越大反映组织内水分子扩散的各向异性越大[4,13]。NAC第1周期结束后,反应组FA值较化疗前明显减低,相对无反应组FA值则无明显变化。这可能是因为化疗药物破坏肿瘤细胞膜的完整性和细胞内微观结构的正常顺序,导致有序的各向异性结构丧失,FA值下降。Kinoshita等[14]的研究结果也表明,FA值与肿瘤实质区细胞密度呈正相关,与ADC值呈负相关。化疗后乳腺癌灶内细胞凋亡、坏死,细胞密度下降,这可能是FA值下降的另一原因。
本研究还发现,反应组化疗前ADC值较低于无反应组,反应组化疗前FA值略低于相对无反应组,差异无统计学意义。原因可能是化疗前ADC值低的乳腺癌灶细胞密度较大,血供丰富,化疗药物在病灶内分布更多。因此,该类患者通常对化疗的反应较好。相反,化疗前ADC值较高的相对无反应组由于细胞排列疏松,血管密度低,化疗药物进入癌灶较少,致使该类患者的化疗效果欠佳。马智军等[15]对乳腺恶性肿瘤及对侧正常乳腺的FA值进行测量发现,乳腺恶性肿瘤的FA值(0.20±0.08)低于健侧正常乳腺组织(0.29±0.17)[16]。由于肿瘤FA值与细胞密度呈正相关[17],乳腺癌灶内细胞密度较健侧乳腺大,FA值也应较大,但结果却相反,提示肿瘤内细胞密度的增加和细胞外间隙的减小并不能主导扩散各向异性的改变。肿瘤FA值的减低可能更多来源于乳腺癌灶内腺泡、导管及间质结构的紊乱以及肿瘤细胞的低分化和不均匀生长导致的细胞外间液增多及微小坏死灶等。由于反应组和相对无反应组乳腺癌灶内细胞分化程度和腺泡、导管及间质成分结构紊乱程度不同,所测得反应组的化疗前FA0值不是全部高于或低于相对无反应组,二者的差异无统计学意义。以上结果提示化疗前ADC值低的乳腺癌患者可能对化疗药物的敏感性更高,化疗效果更好,这可为乳腺癌新辅助化疗适用人群的选择提供依据,而FA值则不具备这样的功能。
DTI在乳腺方面的临床应用研究尚处于起步阶段,一些问题还有待于进一步探索。本研究亦存在不足,如本次研究所有病例的病理类型均为浸润性乳腺癌,而没有对其他亚型的乳腺癌病例进行分析、研究,在今后的研究工作中,笔者会进一步增加病例数,并按照病理类型和恶性程度的不同进行分组研究,不断探讨DTI在乳腺病变中的应用价值。
4参考文献
[1] Chen JH,Feig BA,Hsiang DJ,et al.Impact of MRI-evaluates neoadjuvant chemotherapy response on change of surgical recommendation in breast cancer[J].Ann Surg, 2009(3):448-454.
[2] 安超,娄明武.磁共振扩散张量成像在乳腺肿物中的研究[J].实用放射学杂志, 2015(6):1029-1031.
[3] 马智军,蒋瑞生,冯强,等.扩散张量成像各向异性参数对乳腺恶性肿瘤的鉴别诊断价值[J].中华放射学杂志, 2014(48):180-183.
[4] Wang Y, Zhang XP, Li YL, et al. Optimization of the parameters for diffusion tensor mafnetic resonance imaging data acquisition for breast fiber tractography at 1.5T[J].Clinical Breast Cancer, 2014(1):61-67.
[5] 王海燕,赵斌,于富华.DTI常用扫描序列原理及比较[J].医学影像学杂志, 2006(4):402-404.
[7] Kurhanewicz J,Vigneron DB,Hricak H,et al.Three-dimensional H-1 MR spectroscopic imaging of the in situ human prostate with high(0.24~0.7 cm3)spatial resolution[J].Radiology, 1996(3):795-805.
[8] Sharma U,Danishad KK,Seenu V,et al.Longitudinal study of the assessment by MRI and diffusion-weighted imaging of tumor response in patients with locally advanced breast cancer undergoing neoadjuvant chemotherapy[J].NMR Biomed, 2009(1):104-113.
[9] 金光韦,蔡幼铨,安宁豫,等.表观扩散系数预测乳腺癌新辅助化疗反应初探[J].中华放射学杂志, 2008(3):289-293.
[9] 李瑞利,李宏军.DTI评价不同期HIV相关性痴呆脑白质微细结构损害[J].放射学实践, 2011(10):1036-1039.
[10]Ginat DT,Mangla R,Yeaney G,et al.Diffusion-weighted imaging for differentiating benign from malignant skull lesions and correlation with cell density[J].AJR Am J Roentgenol, 2012(198):597-601.
[11]孙冬,杜勇,杨汉丰.MRI评价乳腺癌新辅助化疗疗效的研究进展[J].实用放射学杂志, 2014(6):1050-1052.
[12]Lee KC,Moffat BA,Schott AF,et al.Prospective early response imaging biomarker for neoadjuvant breast cancer chemotherapy[J].Clin Cancer Res, 2007(13):443-450.
[13]Cakir O,Arslan A,Inan N,et al.Comparison of the diagnostic performances of diffusion parameters indiffusion weighted imaging and diffusion tensor imaging of breast lesions[J].Eur J Radiol, 2013(12):801-806.
[14]Kinoshita M,Hashimoto N,Goto T,et al.Fractional anisotropy and tumor cell density of the tumor core show positive correlation in diffusion tensor magnetic resonance imaging of malignant brain tumors[J].Neuro Image, 2008(1):29-35.
[15]马智军,蒋瑞生,冯强,等.扩散张量成像各向异性参数对乳腺恶性肿瘤的鉴别诊断价值[J].中华放射学杂志, 2014(3):180-184.
[16]Partridge SC,Ziadloo A,Murthy R,et al.Diffusion tensor MRI:preliminary anisotropy measures and mapping of breast tumors[J].J Magn Reson Imaging, 2010(31):339-347.
[17]刘影,王昌新,牛朝诗,等.3.0T弥散张量成像FA值和ADC值在颅脑恶性星形细胞瘤中的运用[J].医学影像学杂志, 2009(3):517-519.
(2016-03-25收稿,2016-05-28修回)
中文编辑: 周凌; 英文编辑: 赵毅
[中图分类号]R445.2
[文献标识码]A
[文章编号]1000-2707(2016)07-0840-04
DOI:10.19367/j.cnki.1000-2707.2016.07.024
Evaluation on Diffusion Tensor Imaging on Neoadjuvant Chemotherapy Curative Effect in Patients with Znvasive Breast Cancer
LIU Yating, FAN Guangming, HUANG Zhaoshu, ZHANG Piaoceng, RUAN Zhibing, NIE Hongfang
(DepartmentofRadiology,theAffiliatedHospitalofGuizhouMedicalUniversity,Guiyang550004,Guizhou,China)
[Abstract]Objective: To investigate the feasibility of diffusion tensor imaging (DTI) for early efficacy of neoadjuvant chemotherapy (NAC) in patients with invcsive breast cancer. Methods: According to the change range of ADC value and FA value at the end of the first neoadjuvant chemotherapy cycle, 30 patients (a total of 38 lesions) were divided into reaction group and relatively non-reaction group; comparing the ADC value, FA value and the breast cancer's largest diameter of both groups before and at the end of the first neoadjuvant chemotherapy cycle. Results: There were 23 cases in reaction group, with a total of 29 lesions; there were 7 cases in relatively non-reaction group, with a total of 9 lesions. The largest diameter of breast cancer in reaction group at the end of the first neoadjuvant chemotherapy cycle is slightly smaller than before neoadjuvant chemotherapy, the ADC value increased obviously before neoadjuvant chemotherapy, and the FA value decreased obviously before neoadjuvant chemotherapy (P<0.05). The breast cancer largest diameter, ADC value and FA value of relatively non-reaction group had no significant change before and at the end of the first neoadjuvant chemotherapy cycle (P>0.05). The ADC value of reaction group was lower than relatively non-reaction group before neoadjuvant chemotherapy (P<0.05). The FA value of reaction group was slightly lower than relatively non-reaction group before neoadjuvant chemotherapy, there was no statistically significant difference (P<0.05). Conclusion: The changes of ADC value and FA value in early neoadjuvant chemotherapy could be used as the evaluation index of chemotherapy curative effect.
[Key words]breast cancer; magnetic resonance imaging; diffusion tensor imaging; neoadjuvant chemotherapy; curative effect
*网络出版时间:2016-07-17网络出版地址:http://www.cnki.net/kcms/detail/52.5012.R.20160717.1318.060.html
