p21基因在野生型斑马鱼胚胎发育过程中的表达*
2016-08-01姬牧远吴西军周艳华舒莉萍1何志旭1
宋 锦, 姬牧远, 吴西军, 周艳华, 舒莉萍1,,4*** , 何志旭1,,3***
(1.贵州医科大学 免疫学教研室, 贵州 贵阳 550004; 2.贵州医科大学 干细胞与组织工程实验中心, 贵州 贵阳 550004; 3.贵州医科大学附院 儿科学教研室, 贵州 贵阳 550004; 4.贵州医科大学 实验动物中心, 贵州 贵阳 550004)
p21基因在野生型斑马鱼胚胎发育过程中的表达*
宋锦1,2**, 姬牧远2,3, 吴西军2, 周艳华2, 舒莉萍1,2,4***, 何志旭1,2,3***
(1.贵州医科大学 免疫学教研室, 贵州 贵阳550004; 2.贵州医科大学 干细胞与组织工程实验中心, 贵州 贵阳550004; 3.贵州医科大学附院 儿科学教研室, 贵州 贵阳550004; 4.贵州医科大学 实验动物中心, 贵州 贵阳550004)
[摘要]目的: 探究p21基因在斑马鱼早期发育过程中的表达。方法: Trizol法提取野生型斑马鱼胚胎总RNA,RT-PCR法扩增p21基因片段,与pCS2+载体重组构建p21-pCS2+重组质粒,以T3 RNA 聚合酶制备地高辛标记的反义mRNA 探针,通过斑马鱼全胚胎原位杂交检测p21 基因在野生型斑马鱼胚胎早期发育过程中的表达。结果: 成功构建了p21-pCS2+重组质粒,并制备反义mRNA 探针;原位杂交结果显示野生型斑马鱼0.5~18 hpf的胚胎均未发现p21 基因阳性杂交信号,24~36 hpf 胚胎可在脊索部位观察到阳性信号,48~72 hpf 胚胎可在头部胸腺附近观察到阳性信号,表达量均较低。结论: 成功制备了p21-pCS2+重组质粒及斑马鱼p21 基因反义mRNA 探针,p21 基因在野生型斑马鱼胚胎不同发育时相中表达水平不同。
[关键词]p21; 斑马鱼; 胚胎; 发育; 探针; 质粒
p21 基因表达产物是细胞周期的一种抑制因子,是细胞周期蛋白依赖性激酶抑制因子CKI 中细胞因子诱导的蛋白/激酶相互作用蛋白Cip/Kip (cytokine-inducible protein/kinase inhibition protein,Cip/Kip) 家族的一员。当在细胞接受到接触抑制、DNA损伤、低氧及某些细胞因子等信号后产生P21基因表达产物,参与细胞的生长、分化、衰老及死亡过程,同时P21基因表达产物又与肿瘤发生密切相关,在细胞的生理、病理过程中发挥重要作用[1-3]。斑马鱼作为一种新兴的模式生物,具有成鱼体积小,适宜在较小空间里大量养殖,生命力强,成熟周期短,繁殖能力强,在体外受精发育,胚胎透明,便于在四维领域即其前后、上下、左右及时间上进行观察,可进行高通量基因筛查,全基因组测序工作已完成等优点。同时斑马鱼与哺乳动物在分子途径调控造血上高度保守,提供了几乎与哺乳动物和其他高级脊椎动物一致的造血系统[4]。因此,利用斑马鱼作为模式生物来研究造血系统功能和疾病有着广阔的前景。本实验以斑马鱼为对象,构建p21-pCS2+重组质粒,制备p21反义mRNA探针,以全胚胎原位杂交法观察斑马鱼胚胎发育中p21的表达情况,为下一步以斑马鱼作为模型研究p21奠定基础。
1材料和方法
1.1材料
Tuebingen品系斑马鱼参照Westerfield[5]方法养殖在28.5℃的循环水系统中。根据Kimmel等[6]文献中提供的斑马鱼生长发育图谱,区分其发育阶段,收集时相为受精后0.75 h(0.75 hours post-fertilization,hpf)、3.7 hpf、6 hpf、12 hpf、18 hpf、24 hpf、30 hpf、36 hpf、48 hpf以及72 hpf。
1.2方法
1.2.1获取p21 cDNA收集野生型斑马鱼胚胎,每个时相10 枚,用Trizol方法提取总RNA,使用Transgene公司TransScript First-Strand cDNA Synthesis SuperMix试剂盒反转录获取p21 cDNA,操作按说明书。
1.2.2体外克隆p21根据NCBI数据提供的斑马鱼p21基因全长cDNA,设计引物序列p21-F,5′-CC ATCGAT GG CAGCTCTTGCAGAAGCTC-3′;p21-R,5′-GCTCTAGACTGGCCGG ATTTGCGCGG-3′;引物序列包含ClaⅠ、XbaⅠ酶切位点。利用KOD-plus扩增p21基因,为保证PCR产物的特异性,将上述体系以降落PCR法完成体外扩增。PCR程序如下:94 ℃ 8 min,94 ℃ 40 s,68 ℃ 30 s,72 ℃ 60 s,以后每2个循环降低退火温度1 ℃至退火温度降至60 ℃,94 ℃ 40 s,60 ℃ 30 s,72 ℃ 60 s(20个循环),72 ℃ 10 min。
1.2.3构建p21-pCS2+重组质粒将pCS2+质粒及p21 基因的PCR 产物分别用ClaⅠ、XbaⅠ双酶切,酶切后进行电泳分析,回收目的条带,将回收的经酶切的pCS2+质粒及p21 基因PCR 产物进行连接。将连接产物转入EcoliDH5α 感受态菌,通过AMP 抗性筛选,挑选阳性克隆,扩增后用Axygen 质粒小抽试剂盒抽提p21-pCS2+重组质粒。
1.2.4p21-pCS2+重组质粒鉴定 以ClaⅠ及XbaⅠ双酶切p21-pCS2+重组质粒,通过琼脂糖电泳判断酶切产物大小,鉴定是否有插入序列DNA 及pCS2+质粒DNA。并将p21-pCS2+重组质粒委托北京诺赛基因公司进行测序。
1.2.5制备p21 基因反义mRNA 探针将p21-pCS2+重组质粒用ClaⅠ单酶切进行质粒DNA 线性化,将线性化p21-pCS2+重组质粒加入地高辛标记的寡核苷酸,利用T3RNA 聚合酶完成体外转录,得到地高辛标记的p21 基因反义mRNA 探针,置于-70 ℃保存备用。
1.2.6斑马鱼p21全胚胎原位杂交分别收集0.75~72 hpf时相的野生型斑马鱼胚胎,去除卵膜,4%多聚甲醛(PFA)固定24 h,用1×PBST 洗3次,然后依次用25%甲醇(PBS)、50%甲醇(PBS)、75%甲醇(PBS)和100%甲醇洗涤,-20 ℃保存过夜。体视显微镜下挑选已脱水的完整胚胎,每个时相挑选20~30 枚,依次用75 %甲醇(PBST)、50%甲醇(PBST)、25%甲醇(PBST) 溶液洗涤1次。24 hpf之后的斑马鱼胚胎需用蛋白酶K 处理,以利于探针渗透。将胚胎移入68 ℃杂交炉,加入预热的预杂交液HYB(-), 15 min。吸出HYB(-),加入HYB(+),68℃ 1 h;再加入地高辛标记的p21反义mRNA 探针,68 ℃过夜。在杂交炉中,用50%甲酰胺(2×SSCT)1mL洗涤两次,每次68 ℃ 30 min。再用2×SSCT 1 mL洗涤1次,68 ℃ 15 min。最后用0.2×SSCT 1 mL洗涤两次,每次68 ℃ 30 min。将胚胎移至十二孔板中,用MABT 2.5 mL洗3次,每次室温轻摇5 min。加入阻滞液2.5 mL于室温下轻摇1 h。加入抗地高辛抗体至终浓度为1∶5 000,4 ℃轻摇过夜。吸去抗体,用阻滞液 lml洗涤1次,室温轻摇30 min,再用MABT 2 mL洗涤两次,室温轻摇1 h及30 min,用染色缓冲液洗涤3次。加入NBT/BCIP染液染色,并在体视显微镜下观察,直至染色成功。将胚胎用1×PBST洗涤后,用4%的多聚甲醛固定,4 ℃保存,在体视显微镜(Nikon-SMZ150)下拍照。
2结果
2.1重组质粒p21-pCS2+及反义p21 基因反义mRNA 探针
PCR 产物经凝胶电泳分析显示500 bp 附近可见一特异扩增带,大小与预期525 bp 结果相符(图1);重组质粒p21-pCS2+电泳结果显示,在4 000 bp 附近可见两条条带,525 bp 附近可见1条条带(图2),提示重组质粒构建成功。p21 基因反义mRNA 探针电泳结果显示,在500 bp位置有明显条带,重组质粒测序结果通过Genbank 比对显示与所需p21 基因片段完全一致,提示p21 基因反义mRNA 探针制备成功(图3、图4)。2.2p21 基因在野生型斑马鱼全胚胎原位杂交结果
0.75~18 hpf 胚胎未见p21 基因阳性杂交信号(图5 A-F),24~36 hpf 胚胎部分脊索可观察到p21 基因阳性杂交信号(图5 G-I红色箭头所示),但表达量并不高;48~72 hpf 胚胎在头部可见阳性信号(图5 J-K绿色箭头所示),两侧对称出现。0.75~72 hpf在斑马鱼胚胎造血区如ICM 区、AGM 区未观察到阳性杂交信号,提示野生型斑马鱼造血系统无p21 基因表达或p21 基因表达极低(图5)。

注:1为DNA marker Ⅲ,2为PCR产物,3为GAPDH,4为空白对照图1 p21 基因PCR 扩增产物电泳Fig.1 Electrophoresis of PCR products of p21

注:1为DNA marker Ⅲ,2为Enzyme digested p21-pCS2+,3为Linearity p21-pCS2+,4为Linearity plasmid pCS2+,5为空白对照图2 p21-pCS2+限制性内切酶酶切鉴定Fig.2 The restriction enzymes digest p21-pCS2+with ClaⅠand XbaⅠ

注:1为DNA marker Ⅳ,2和3为反义p21 mRNA探针,4为空白对照图3 p21 基因反义mRNA 探针电泳Fig.3 Electrophoresis of the anti-sense p21 mRNA probe
3讨论
p21基因最初是通过酵母双杂交及消减杂交等方法得到,主要参与DNA损伤的细胞应答反应[7-8]。Harpeer等在研究CDK2的调节蛋白时发现,p21作为CDK2及其他CDK的抑制物,在细胞分裂过程中起着关卡作用[9]。Vogelstein等在寻找受p53转录调控的基因中发现了p21基因,将其称为WAFl(wild-type p53-activated fragment1),将其导入肿瘤细胞时,可发现其与p53有同样的抑瘤效应[10]。目前,有关p21基因的结构功能的认识逐渐增多,许多研究表明其与细胞终末分化、损伤、衰老有着重要的功能意义,并参与癌症的发生[11-13]。因此对p21基因相关功能的研究可能成为治疗癌症的新靶点。
p21基因最核心的功能是其参与调节细胞周期的功能,可影响细胞的自我更新、分裂、分化及凋亡等。当DNA损伤时,一系列蛋白激酶被激活、核苷酸的耗竭、氧供不足和过剩等可激活p53,p21基因编码区上游2.4 kb和约8 kb处有2个p53共有的结合区,因而p53基因激活会导致其靶基因p21基因的迅速转录。转录出的p21蛋白可与CDK2 等因子结合,抑制其活性,使受到损伤的细胞停滞于G1期,不能进一步进行DNA复制和有丝分裂,从而使受损的细胞有充分的时间修复, 不能修复的则发生凋亡[10,14]。研究发现,在血清供给量不足、接触性抑制和衰老等条件下,通过肿瘤坏死因子、组织型纤溶酶原激活剂等因素的作用,p21基因可以快速发生反应,使受损的细胞发生细胞周期阻滞,在正常组织细胞的发育、分化中非依赖p53途径的p21基因的调节同样存在[15]。p21基因可以与增殖细胞核抗原(proliferating cell nuclear antigen ,PCNA)相互作用,在S期发生DNA损伤,通过p21 C端竞争性抑制DNA聚合酶和PCNA的结合,阻断PCNA活化DNA聚合酶的活性从而抑制DNA的合成,使细胞周期停滞[16]。
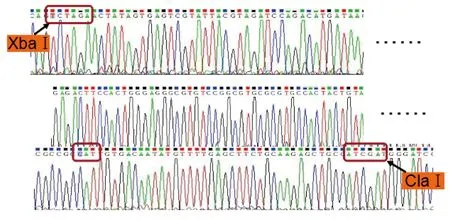
图4 p21-pCS2+重组质粒测序Fig.4 DNA Sequence of the recombinant plasmid of p21-pCS2+
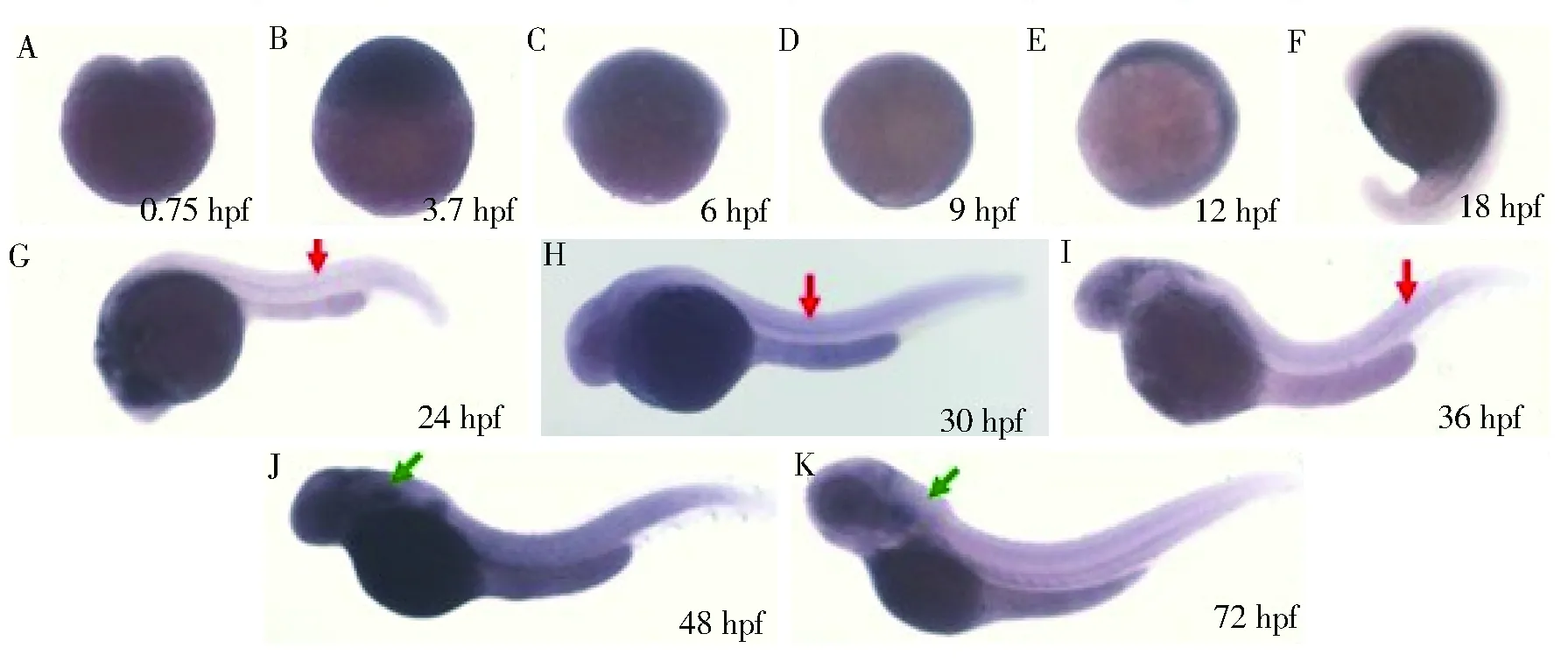
注:红色箭头为脊索,绿色箭头为胸腺图5 p21基因在野生型斑马鱼胚胎发育过程中的表达Fig.5 Expression of p21 gene in wild-type zebrafish embryos
目前斑马鱼作为一种模式生物已广泛应用于各种疾病的研究。对致癌化合物引起的斑马鱼肿瘤的研究显示,其在基因组学及组织病理等方面与人类肿瘤高度相似[17-18]。2003年,Langenau等[19]创建了首个斑马鱼白血病模型,并且将该白血病模型斑马鱼的血细胞转入亚致死量射线照射过的野生型斑马鱼,同样可以引起白血病症状,这进一步引起了通过斑马鱼来研究造血系统疾病的热潮。p21基因是一个高度保守的基因,在氨基酸水平上人的p21基因与斑马鱼有87%的同源性。因此本研究选择斑马鱼为模式生物,有利于对p21基因的功能的研究,也是国内外首次报道p21基因在野生斑马鱼中的表达情况。
在本研究中,通过对野生型斑马鱼胚胎进行全胚胎原位杂交,在胚胎发育早期(0.75~18 hpf)未观察到p21基因表达,p21基因为细胞周期中与G1/S检查点相关的关键调节因子,与细胞增殖的机制相关;当有错误的DNA复制时,p21基因表达增加,限制细胞周期的进程,使其进行DNA修复后再继续分裂。故对此推测在细胞增殖受阻的部位p21基因呈高表达,而在细胞分裂、分化旺盛的部位其表达降低,早期斑马鱼胚胎生长发育旺盛,细胞大量分化,所以p21基因表达量低,通过原位杂交方法不能观测到其表达,但具体机制有待于进一步的研究。24~36 hpf胚胎可在脊椎部位观察到阳性信号,表明p21基因与斑马鱼早期胚胎发育过程中可能与神经系统发育相关。48~72 hpf胚胎可在头部观察到阳性信号,两侧对称出现,考虑该部位为胸腺。下一步可通过胸腺发育相关的基因进行进一步认证p21是否在斑马鱼胸腺内表达,利用斑马鱼优势模式生物,可能揭示T细胞的发生和分化与p21的关系。
4参考文献
[1] Arthur LM, Heber-Katz E. The role ofp21 in regulating mammalian regeneration[J]. Stem Cell Res Ther, 2011(3):30.
[2] Ronald Van OS,Leonie M, Kamminga, et al. A Limited Role forp21Cip1/Waf1 in Maintain- ing Normal Hematopoietic Stem Cell Functioning[J]. Stem Cells, 2007(4):836-843.
[3] Andrea V, Francesca DF, Annette O,et.al.Cell-cycle restriction limits DNA damage and maintains self-renewal of leukaemia stem cells[J].Nature, 2009(7225):51-56.
[4] Mushtaq MY, Verpoorte R,Kim HK. Zebrafish as a model for systems biology[J]. Biotechnol Genet Eng Rev, 2013(29):187-205.
[5] Runft DL, Mitchell KC, Abuaita BH, et al. Zebrafish as a natural host model for Vibrio cholerae colonization and transmission[J]. Appl Environ Microbiol, 2014(5):1710-1717.
[6] Shinya M,Sakai N. Generation of highly homogeneous strains of zebrafish through full sib-pair mating[J]. G3 (Bethesda), 2011(5):377-386.
[7] Hoeferlin LA, Oleinik NV, Krupenko NI, et al.Activation ofp21-Dependent G1/G2 arrest in the absence of DNA damage as an antiapoptotic response to metabolic stress[J]. Genes Cancer, 2011(9):889-899.
[8] Armstrong MJ, Stang MT, Liu Y, et al. Interferon regulatory factor 1 (IRF-1) inducesp21(WAF1/CIP1) dependent cell cycle arrest andp21(WAF1/CIP1) independent modulation of survivin in cancer cells[J]. CancerLett, 2012(1):56-65.
[9] Sun X, Liu B, Wang J, et al. Inhibition ofp21-activated kinase 4 expression suppresses the proliferation of Hep-2 laryngeal carcinoma cells via activation of the ATM/Chk1/2/p53 pathway[J]. Int J Oncol, 2013(2):683-689.
[10]Russo A, Esposito D, Catillo M, et al. Human rpL3 induces G(1)/S arrest or apoptosis by modulatingp21 (waf1/cip1) levels in a p53-independent manner[J]. Cell Cycl, 2013 (1):76-87.
[11]Graham K, Moran-Jones K, Sansom, et al. FAK deletion promotes p53-mediated induction ofp21, DNA-damage responses and radio-resistance in advanced squamous cancer cells[J]. PLoS One, 2011(12):e27806.
[12]Chiang YT,Jin T.p21-Activated protein kinases and their emerging roles in glucose homeostasis[J].Am J Physiol Endocrinol Metab, 2014(7):E707-722.
[13]Hu Z, ZhangD, Hao J,et al. Induction of DNA damage andp21-dependent senescence by Riccardin D is a novel mechanism contributing to its growth suppression in prostate cancer cells in vitro and in vivo[J]. Cancer Chemother Pharmacol, 2014(2):397-407.
[14]Tarakji B. Baroudi K, Hanouneh S, et al. Expression ofp21 is dependent on or independent of p53 in carcinoma ex pleomorphic adenoma (undifferentiated and adenocarcinoma types)[J]. Pol J Pathol, 2012(4):286-291.
[15]Zhang Y,Yan B. Cell cycle regulation by carboxylated multiwalled carbon nanotubes through p53-independent induction ofp21 under the control of the BMP signaling pathway[J]. Chem Res Toxicol, 2012(6):1212-1221.
[16]Zhang L, Mei Y, Fu NY, et al. TRIM39 regulates cell cycle progression and DNA damage responses via stabilizingp21[J]. Proc Natl Acad Sci USA, 2012(51):20937-20942.
[17]Delvecchio C, Tiefenbach J, Krause HM.The zebrafish: a powerful platform for in vivo, HTS drug discovery[J].Assay Drug Dev Technol, 2011(4):354-361.
[18]Stern HM,Zon LI.Cancer genetics and drug discovery in the zebrafish [J].Nat Rev Cancer, 2013(7):533-539.
[19]Langenau DM,Traver D,Ferrondo AA,et al.Myc-induced T cell leukemia in transgenic zebrafish [J].Science, 2003(5608):887-890.
(2016-05-10收稿,2016-06-21修回)
中文编辑: 文箐颍; 英文编辑: 赵毅
*[基金项目]国家自然科学基金项目(30960412); 贵州省科技基础条件平台项目[(2009)4005]; 贵州省优秀科技教育人才省长专项资金(S2008-4)
[中图分类号]R394.3
[文献标识码]A
[文章编号]1000-2707(2016)07-0765-05
DOI:10.19367/j.cnki.1000-2707.2016.07.005
The Expression ofp21 in Development of Wild Type Zebrafish Embryo
SONG Jin1,2, JI Muyuan2,3, WU Xijun2, ZHOU Yanhua2, SHU Liping1,2,4, HE Zhixu1,2,3
(1.DepartmentofImmunology,GuizhouMedicalUniversity,Guiyang550004,Guizhou,China; 2.TheCenterofStemCellandTissueEngineeringResearch,GuizhouMedicalUniversity,Guiyang550004,Guizhou,China; 3.DepartmentofPaediatrics,AffiliatedHospitalofGuizhouMedicalUniversity,Guiyang550004,Guizhou,China; 4.LaboratoryAnimalCenter,GuizhouMedicalUniversity,Guiyang550004,Guizhou,China)
[Abstract]Objective: To explore the expression of p21 in zebrafish. Methods: Extract 0.75 hpf~120 hpf wild-type Zebrafish embryos in multiple phase and total RNA by Trizol, amplificating p21 gene by RT-PCR, and constructing p21-pCS2+plasmid. Preparing antisense mRNA probe with T3 RNA polymerase, using zebrafish whole-mount in situ hybridization to examine the p21 expression pattern in early embryo development. Results: Successfully constructed p21-pCS2+plasmid, preparing antisense mRNA probe; within situ hybridization, there is no expression of p21 in wild-type zebrafish at 0.5 hpf~18 hpf; positive signal in notochord was found in 24 hpf~36 hpf of the wild-type Zebrafish embryos, and positive signal could be found near head and thymus, but indicating low expression. Conclusion: In this research, it has been successfully constructed p21-pCS2+plasmid, antisense mRNA probe preparation, and have a preliminary observation in the expression of p21 gene in Zebrafish embryos in different periods.
[Key words]p21; zebrafish;embryo;development; probe; plasmid
**贵州医科大学2013级硕士研究生
***通信作者 E-mail:gyslp456@gmc.edu.cn; hzx@gmc.edu.cn
网络出版时间:2016-07-17网络出版地址:http://www.cnki.net/kcms/detail/52.5012.R.20160717.1318.018.html
