新疾病模式生物斑马鱼G6PD酶活性的动态研究*
2016-08-01尚鲁俊吴西军周艳华何志旭舒莉萍
宋 锦, 李 莉, 尚鲁俊, 吴西军, 周艳华 , 何志旭***, 舒莉萍,4***
(1.贵州医科大学 免疫学教研室, 贵州 贵阳 550004; 2.贵州医科大学 干细胞与组织工程实验中心, 贵州 贵阳 550004; 3.贵州医科大学 儿科学教研室, 贵州 贵阳 550004; 4.贵州医科大学 实验动物中心, 贵州 贵阳 550004)
·专题研究·
新疾病模式生物斑马鱼G6PD酶活性的动态研究*
宋锦1,2**, 李莉2,3, 尚鲁俊1,2, 吴西军2, 周艳华2, 何志旭2,3***, 舒莉萍1,2,4***
(1.贵州医科大学 免疫学教研室, 贵州 贵阳550004; 2.贵州医科大学 干细胞与组织工程实验中心, 贵州 贵阳550004; 3.贵州医科大学 儿科学教研室, 贵州 贵阳550004; 4.贵州医科大学 实验动物中心, 贵州 贵阳550004)
[摘要]目的: 观察不同发育时期的斑马鱼胚胎、成年斑马鱼不同组织的G6PD酶活性及g6pd mRNA的表达。方法: 收集受精后24 h(24 hpf)、48 hpf、受精后5 d(5 dpf)及15 dpf的野生型斑马鱼胚胎,同时收集成年斑马鱼的脑、肌肉、鳃、皮肤、眼睛及肠等组织,运用改良G6PD定量比值法和RT-PCR法检测上述胚胎或组织的G6PD酶活性及g6pd mRNA表达水平。结果: G6PD酶活性、g6pd mRNA表达水平在24 hpf、48 hpf、5 dpf及15 dpf比较,差异无统计学意义(P>0.05);在成年斑马鱼的脑、肌肉、鳃、皮肤、眼睛及肠等不同部位组织比较,差异也无统计学意义(P>0.05)。结论: 野生斑马鱼G6PD酶活性、g6pd mRNA表达水平不受胚胎发育时期和组织部位的影响。
[关键词]斑马鱼; 胚胎; 葡萄糖6磷酸脱氢酶; 酶活性; mRNA
葡萄糖6磷酸脱氢酶(G6PD)缺乏症属于X染色体连锁不完全显性遗传性疾病,据统计目前全球约有4亿人受此病的困扰,中国是主要的发病国家之一[1]。在中国,G6PD缺乏症的流行病学特点呈“南高北低”趋势,主要分布在长江以南地区,以广东、广西、贵州、四川、云南、海南等省为高[1-2]。G6PD缺乏症是由于g6pd基因发生突变引起,且绝大多数为点突变[3]。早有文献报道G6PD缺乏症的小鼠疾病模型,但筛选出的G6PD缺乏纯合子小鼠在胚胎期就会发生死亡,当使用氧化剂对杂合子小鼠处理后其溶血现象不明显,这对G6PD缺乏症的后期研究有一定的局限性[4]。斑马鱼作为近年来新兴的模式生物,具有养殖方便、产卵量大、胚胎透明、养殖周期较短以及与人类基因高度保守等优势[5],推测若利用斑马鱼建立G6PD缺乏症模型,将更有利于G6PD缺乏症研究,但需了解斑马鱼G6PD酶活性情况及正常值范围,以评估G6PD缺乏斑马鱼模型中G6PD情况。本研究在常规的改良G6PD定量比值法的基础上,根据斑马鱼的特点进行优化,尝试建立一种斑马鱼G6PD酶活性的检测方法,以期了解不同发育时期斑马鱼胚胎、成体斑马鱼不同组织中G6PD酶活性的含量,并用RT-PCR法了解g6pdmRNA表达情况,为进一步利用斑马鱼研究G6PD缺乏症奠定基础。
1材料与方法
1.1实验动物
实验所需Tuebingen品系野生型斑马鱼参照文献[6]方法养殖在28 ℃循环水系统中。根据文献[7]的斑马鱼生长发育图谱区分其发育阶段,收集受精后24 h(24 hours post-fertilization,24 hpf)、48 hpf、受精后5天(5 days post-fertilization,5 dpf)、15 dpf的野生型斑马鱼。
1.2样本制备
1.2.1斑马鱼胚胎样品分别收集不同时相野生型斑马鱼20~40枚胚胎,剥除胚胎表面的胎膜,1×PBS中清洗3遍,冰上研磨胚胎,加入500 μL的0.25%胰酶,在37 ℃温箱消化20~30 min,加入800 μL的胎牛血清终止消化,瞬时离心,留下250 μL的下层细胞液体,并将细胞液体转移至Becton Dickinson falcon 40 μm (BD)尼龙滤网(冰上操作),4 ℃,800 r/min,离心5 min后,弃上清。加入0.9×FBS/PBS 200 μL,将细胞悬液混匀,加入BD过滤膜过滤后,4 ℃,800 r/min,离心5 min,弃上清液。加入0.9×FBS/PBS 15 μL,制成单细胞悬液,再加入双蒸水(ddH2O) 200 μL,制备细胞溶液。
1.2.2斑马鱼成鱼样本(1)全血样品制备:取斑马鱼成鱼1尾,禁食3 d后于尾部动静脉丛处切尾取血,吸取血液加入EDTA-K2抗凝剂的抗凝管中;收集抗凝全血15 μL,加入ddH2O 200 μL,制备溶血液。(2)不同组织样品制备:在冰上解剖成年斑马鱼,取出脑、肌肉、鳃、皮肤、眼睛、肠,取出组织后1×PBS清洗3遍,分别置于无菌清洁载玻片剁碎(冰上操作),用上述方法制成单细胞悬液,加入ddH2O 200 μL,制备成细胞溶液。
1.3斑马鱼g6pdcDNA
收集不同时相斑马鱼胚胎及斑马鱼各组织,用Trizol法提取斑马鱼总RNA,使用Thermo公司的TransScript First-Strand cDNA synthesis Supermix试剂盒反转录得到cDNA(按说明书进行操作)。
1.4改良G6PD比值法测定斑马鱼G6PD 酶活性
使用改良G6PD测定试剂盒(定量比值法,广州米基医疗器械有限公司)测定G6PD酶活性,对试剂盒使用体系再次改良后进行检测,检测体系为:G6PD管, G6PD 6 μL、NBT 8 μL、PMS 4 μL、ddH2O 33 μL、溶血液 50 μL;6PGD 管,6PGD 6 μL、NBT 8 μL、PMS 4 μL、ddH2O 33 μL、溶血液50 μL。利用日本岛津紫外分光光度仪UV-2401在650 nm条件下分别检测G6PD管及6PGD管的吸光度(OD)值,计算G6PD/6PGD比值,判断G6PD活性。
1.5g6pdmRNA表达水平
采用RT-PCR法半定量法,根据斑马鱼cDNA文库中g6pd基因组序列,参照Pubmed-Nucleotide 中斑马鱼g6pd基因的CDS序列设计引物,并在引物前端加入酶切位点,用Primer Premier 5.0 软件设计引物,引物由上海捷瑞生物工程有限公司合成,正向引物为5′- GGATCCATGATGGGCAGTCGAGCGAG-3′,反向引物为5′-GAATTC AGTGTCAAACACACCTAAGT-3′。以g6pdcDNA作为模板,使用高保真DNA聚合酶KOD plus进行PCR扩增,PCR反应程序如下:94 ℃ 8 min,94 ℃ 40 s、66 ℃ 30 s、72 ℃ 1 min,35循环;72 ℃ 10 min。PCR扩增产物进行1%琼脂糖凝胶电泳分析,目的条带为1 527 bp,利用灰度软件对电泳结果进行分析,得出相应的g6pd半定量值,对灰度分析值进行统计学分析。
1.6统计学方法
对斑马鱼不同组织、不同时相胚胎的G6PD酶活性结果,g6pdmRNA表达水平电泳条带灰度值采用EXCEL软件对数据进行双录核实,建立数据库,用SPSS 19.0软件对G6PD酶活性结果采用单因素方差分析。对斑马鱼各组织、不同时相胚胎g6pdmRNA表达水平电泳条带灰度值采用Wilcoxon符号秩和检验,P<0.05为差异有统计学意义。
2结果
2.1G6PD酶活性
对24 hpf、48 hpf、5 dpf、15 dpf 时相斑马鱼胚胎,成年斑马鱼脑、鳃、肌肉、皮肤、眼及肠组织(图1)利用改良G6PD定量比值法对G6PD酶活性进行检测,结果显示不同发育时相斑马鱼胚胎,成年斑马鱼不同组织G6PD/6PGD比值比较,差异无统计学意义(P>0.05),见图2,提示不同发育时相胚胎及不同组织中G6PD酶活性处于同一水平。
2.2g6pdmRNA表达水平
本研究对野生型不同时相斑马鱼胚胎及成年斑马鱼不同组织中g6pdmRNA进行1%琼脂糖电泳及灰度分析。结果显示,不同时相斑马鱼胚胎(图3),成年斑马鱼不同组织(见图4)中的g6pdmRNA表达量比较,差异无统计学意义(P>0.05),进一步证实,斑马鱼不同发育时期胚胎就成年斑马鱼不同组织中G6PD酶活性无明显差异。

图1 成年斑马鱼的不同组织Fig.1 The different tissues of adult zebrafish

图2 不同时相斑马鱼胚胎及成年斑马鱼不同组织G6PD/6PDG比值Fig.2 G6PD/6PGD in different phases and tissues of zebrafish embryos

注:A中1为DNA MakerⅢ,2~5分别为24、48 hpf和5、15 dpf, 6为对照图3 斑马鱼不同发育时期胚胎中g6pd mRNA表达Fig.3 The expression of g6pd mRNA in different tissues of zebrafish
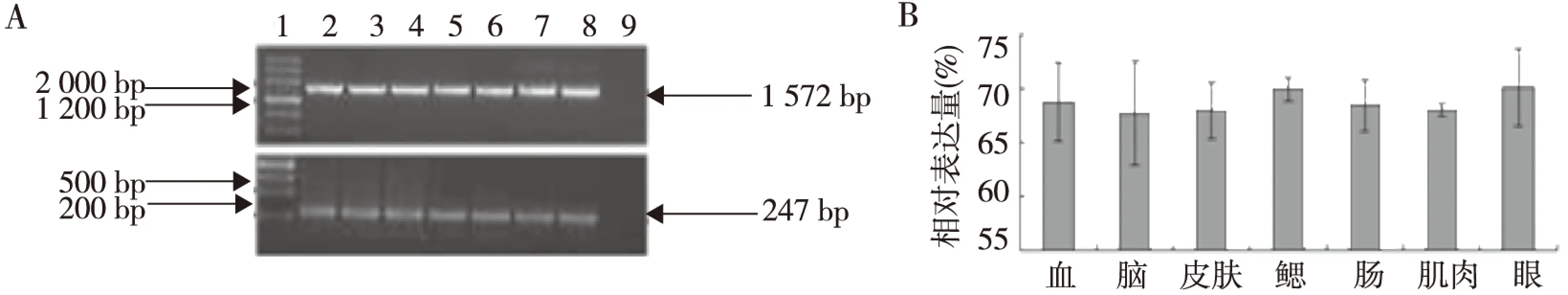
注:A中1为DNA MakerⅢ, 2为血, 3为脑, 4为皮肤,5为鳃, 6为肠,7为肌肉,8为眼,9为对照图4 成年斑马鱼不同组织中g6pd mRNA表达Fig.4 The expression of g6pd mRNA in different tissues of zebrafish
3讨论
G6PD是参与红细胞酵解磷酸戊糖氧化途径的起始限速酶,能催化生成重要的还原性物质还原型辅酶Ⅱ(nicotinamide adenine dinucleotide phosphate,NADPH)。NADPH是体内许多合成代谢的供氢体,是重要抗氧化物质还原型谷胱甘肽(GSH)维持还原状态所必需的辅酶。还原型GSH可以保护细胞以及细胞膜免受氧化剂的损害[8]。当机体G6PD酶活性缺乏时,机体还原型GSH抗氧化效果减弱,红细胞膜无法抵抗氧化攻击,受累红细胞因此失去变形能力,容易在血流的冲击及毛细血管的挤压作用下发生破溶,进而发生急性溶血[9]。已有的G6PD缺乏小鼠疾病模型中,由于G6PD缺乏纯合子小鼠在胚胎期就发生死亡,且杂合子小鼠对氧化剂反应差,致使对G6PD缺乏症的研究存在一定的局限性[4]。此外,由于缺乏合适的动物模型对抗疟疾药物进行筛选,导致抗疟疾药的新药开发出现瓶颈[10],因此对G6PD缺乏症的研究仍有很多问题亟待解决。
斑马鱼是近年来新兴的模式生物,其作为实验动物具有小鼠等其他模式生物所无法比拟的优点,例如:体外受精,产卵量大,便于行高通量基因筛查及药物筛选;其胚胎透明,便于观察;成鱼体型较小,生长发育快,且易于饲养;斑马鱼基因与人类基因保守度约85%;斑马鱼在进化过程中,虽和人类相距较远,但是造血发育是高度保守的[5,11-12]。目前为止已利用斑马鱼成功建立起多种造血系统疾病的模型[13-14]。由于斑马鱼体型小,本研究根据改良的G6PD定量比值法试剂盒说明书将步骤及体系进行优化后,对野生型斑马鱼的不同组织,不同时相胚胎G6PD/6PGD进行检测,通过G6PD/6PGD比值反应斑马鱼各个组织及不同时相的G6PD酶活性情况。本研究中,在选择成年野生型斑马鱼的组织时,尽量将所有组织解剖后制备成细胞悬液,但是部分组织(比如心脏、脾脏、胆囊等)解剖后不易获得或者体积过小难以获得足够的样本,本研究挑选出脑、眼睛、皮肤、肌肉、肠、鱼鳃六组组织作为实验对象。斑马鱼不同组织与血液G6PD/6PGD比值差异无统计学意义,提示斑马鱼组织和血液G6PD酶活性处于同一水平。由于斑马体型小,血量小,在后期利用斑马鱼对G6PD缺乏症进行研究时,可利用斑马鱼组织的G6PD酶活性情况反映斑马鱼血液G6PD酶活性情况,可大大降低操作复杂性。同时为观察G6PD酶活性是否随斑马鱼发育变化而变化,本研究挑选24 hpf、48 hpf、5 dpf以及15 dpf 的胚胎作为对象,检测结果提示不同时相斑马鱼胚胎G6PD/6PGD比值处于同一水平,考虑斑马鱼发育过程中G6PD酶活性波动较小。另外,本研究还运用RT-PCR半定量法对斑马鱼不同组织及不同时相胚胎中g6pdmRNA表达情况进行半定量分析,观察斑马鱼不同组织及不同时相胚胎g6pd基因mRNA表达情况与G6PD 酶活性检测结果是否一致。对1%琼脂糖凝胶电泳结果进行灰度分析后,统计学分析显示斑马鱼各个组织及不同时相胚胎中g6pd的转录水平均值差异无统计学意义,与斑马鱼G6PD 酶活性检测结果一致。
人类G6PD表达与斑马鱼相比有所不同,人类肌肉组织中G6PD表达极低,与血液中G6PD酶活性相差很大[15]。而经本研究对斑马鱼不同组织及不同发育时相胚胎进行G6PD酶活性及g6pdmRNA半定量分析,发现斑马鱼中不同组织及不同时相胚胎之间G6PD酶活性差异无统计学意义。因此推测,由于g6pd基因是一类管家基因,所以经改良G6PD定量比值法检测及RT-PCR半定量分析结果经统计学分析后提示其各组之间差异无统计学意义。本实验反应出斑马鱼G6PD 酶活性的趋势,以及不同组织及不同发育时期斑马鱼G6PD酶活性无明显差异,为进一步对利用斑马鱼建立G6PD缺乏斑马鱼模型及对G6PD缺乏症进行研究奠定基础。
综上所述,本研究建立检测斑马鱼G6PD酶活性的技术,以及检测出斑马鱼不同组织及不同时相斑马鱼胚胎G6PD酶活性的标准值。并通过RT-PCR法对不同组织及不同时相斑马鱼胚胎中g6pdmRNA进行半定量分析,进一步提示斑马鱼不同组织及不同时相斑马鱼胚胎中G6PD酶活性无明显差异,为下一步构建G6PD缺乏斑马鱼模型及研究G6PD缺乏症奠定基础。
4参考文献
[1] Santana MS, Monteiro WM, Siqueira AM,et al. Glucose-6-phosphate dehydrogenase deficient variants are associated with reduced susceptibility to malaria in the Brazilian Amazon[J].Trans RSoc Trop Med Hyg, 2013(5):301-306.
[2] Howes RE, Piel FB, Patil AP, et al. G6PD deficiency prevalence and estimates of affected populations in malaria endemic countries:a geostatistical model-based map[J].PLoS Med, 2012(11):e1001339.
[3] Hu R,Lin M, Ye J,et al. Molecular epidemiological investigation of G6PD deficiency by a gene chip among Chinese Hakka of southern Jiangxi province [J]. Int J Clin Exp Pathol, 2015(11):15013-15018.
[4] Pretsch W, Charles DJ, Merkle S.X-Linked Glucose-6-Phosphate Dehydrogenase Deficiency in Mus musculus[J]. Biochem Genet, 1988(1-2):89-103.
[5] Vargas RA, Sarmiento K,Vasquez IC.Zebrafish (Danio rerio): A Potential Model for Toxinological Studies[J]. Zebrafish, 2015(5):320-326.
[6] Wang YP,Zhou LS, Zhao YZ,et al. Regulation of G6PD acetylation by SIRT2 and KAT9 modulates NADPH homeostasis and cell survival during oxidative stress[J].EMBO J, 2014(12):1304-1320.
[7] Westerfield M. The zebrafish book:A guide for the laboratory use of zebrafish (Danio rerio ) [M].Univ of Oregon Press, 2007:121-134.
[8] Sandoval JM, Arenas FA, Vásquez CC.Glucose-6-phosphate dehydrogenase protects escherichia coli from tellurite-mediated oxidative stress[J]. PlosOne, 2011(9):e25573.
[9] Cappellini MD, Fiorelli G. glucose-6-phosphate dehydrogenase deficiency[J]. Lancet, 2008(371):64-74.
[10]Rochford R, Ohrt C, Baresel PC, et al. Humanized mouse model of glucose-6-phosphate deh ydrogenase deficiency for in vivo assessment of hemolytic toxicity[J]. PASN, 2013(43):17486-17491.
[11]Goessling W,North TE. Hematopoietic stem cell development: using the zebrafish to identify the signaling networks and physical forces regulating hematopoiesis. Methods in cell biology [J]. Methods Cell Biol, 2011(105):117-136.
[12]Kanungo J, Cuevas E, Ali SF, et al. Zebrafish model in drug safety assessment. Current pharmaceutical design[J] . Curr Pharm Des, 2014(34):5416-5429.
[13]Sabaawy HE, Azuma M, Embree LJ, et al. TEL-AML1 transgenic zebrafish model of precursor B cell acute lymphoblastic leukemia[J]. PNSA, 2006(41):15166-15171.
[14]Gutierrez A, Grebliunaite R, Feng H, et al. Pten mediates Myc oncogene dependence in a conditional zebrafish model of T cell acute lymphoblastic leukemia[J]. J Exp Med, 2011(8):1595-1603.
[15]Von Seidlein L, Auburn S, Espino F, et al. Review of key knowledge gaps in glucose-6-phosp hate dehydrogenase deficiency detection with regard to the safe clinical deployment of 8-aminoquinoline treatment regimens: a workshop report[J]. Malar J, 2013(12):112.
(2016-04-23收稿,2016-06-11修回)
中文编辑: 吴昌学; 英文编辑: 刘华
*[基金项目]国家自然科学基金项目资助(31360285)
[中图分类号]R392.9
[文献标识码]A
[文章编号]1000-2707(2016)07-0750-05
DOI:10.19367/j.cnki.1000-2707.2016.07.002
Dynamic Research G6PD Enzyme Activity of New Disease Patterns Zebrafish
SONG Jin1,2, LI Li2,3, SHANG Lujun1,2, WU Xijun2, ZHOU Yanhua2, HE Zhixu1,2,3, SHU Liping1,2,4
(1.DepartmentofImmunology,GuizhouMedicalUniversity,Guiyang550004,Guizhou,China; 2.TheCenterofStemCellandTissueEngineeringResearch,GuizhouMedicalUniversity,Guiyang550004,Guizhou,China; 3.DepartmentofPaediatrics,GuizhouMedicalUniversity,Guiyang550004,Guizhou,China; 4.ExperimentalAnimalCenter,GuizhouMedicalUniversity,GuizhouMedicalUniversity,Guiyang550004,Guizhou,China)
[Abstract]Objective: To observe G6PD enzyme activity and G6PD mRNA expression in different tissues of zebrafish embryos and adult zebrafish at different developmental stages. Method: After fertilization, 24 hpf (24 hour post-fertilization), 48 hpf, 5 dpf (5 day post-fertilization) and 15dpf wild type zebrafish embryos were collected, and the brain, muscle, gill, skin, eyes and intestine of adult zebrafish were collected simultaneously. The modified G6PD quantitative ratio assay and RT-PCR were adopted to detect G6PD activity and mRNA expression levels in zebrafish embryos and tissues. Result: There was no statistically significant difference in G6PD activity and mRNA expression levels between 24 hpf, 48 hpf, 5 dpf and 15 dpf(P>0.05). There was also no statistically significant difference in G6PD activity and mRNA expression levels between brain, muscle, gill, skin, eyes and intestine(P>0.05).Conclusion: The G6PD activity and mRNA expression level of wild zebrafish is not affected by embryonic development period and tissue site.
[Key words]zebrafish; embryo; glucose-6-phosphate dehydrogenase; enzymatic activity; mRNA
**贵州医科大学2013级硕士研究生
***通信作者 E-mail:hzx@gmc.edu.cn; gyslp456@gmc.edu.cn
网络出版时间:2016-07-17网络出版地址:http://www.cnki.net/kcms/detail/52.5012.R.20160717.1318.004.html
