唑来膦酸对人直肠癌COLO320细胞体外增殖和凋亡的影响
2016-06-01高向阳
田 甜, 冷 洁, 赵 晶, 高向阳, 宋 超, 高 超
1.徐州医科大学研究生学院2013级,江苏 徐州 221004; 2.徐州医科大学附属医院肿瘤科
唑来膦酸对人直肠癌COLO320细胞体外增殖和凋亡的影响
田 甜1, 冷 洁1, 赵 晶2, 高向阳2, 宋 超2, 高 超2
1.徐州医科大学研究生学院2013级,江苏 徐州 221004; 2.徐州医科大学附属医院肿瘤科
目的 探讨唑来膦酸(Zoledronic acid,ZOL)对人直肠癌细胞株COLO320体外增殖和凋亡的影响,及其诱导凋亡可能的分子机制。方法 采用CCK-8法检测不同浓度ZOL作用不同时间对COLO320细胞增殖的影响,并计算半数致死量(IC50)及增殖抑制率;采用流式细胞术(flow cytometry,FCM)分析ZOL对细胞凋亡的影响;采用Western blotting和实时定量PCR(Real-Time PCR)检测ZOL作用直肠癌COLO320细胞72 h后相关凋亡基因Bad、Bcl-2、Bax和Caspase-9的mRNA及蛋白表达水平。结果 与对照组相比,ZOL处理组的直肠癌COLO320细胞增殖受到明显抑制,呈剂量和时间依赖性(P<0.05),24、48、72和96 h的IC50分别是209.4、103.6、74.1、65.6 μmol/L;且ZOL对COLO320细胞增殖抑制作用呈时间和浓度依赖性。FCM示不同浓度ZOL处理直肠癌COLO320细胞72 h后的凋亡率较对照组均有不同程度升高,但20 μmol/L浓度组与对照组之间差异无统计学意义(P>0.05),其余各组与对照组比较差异有统计学意义(P<0.05)。ZOL处理72 h后的COLO320细胞凋亡相关基因Bcl-2的表达水平下降,Bax、Bad、Caspase-9的表达升高。RT-PCR显示,Bcl-2 mRNA表达下调,Bax、Bad、Caspase-9 mRNA表达升高。 结论 ZOL对人直肠癌COLO320细胞的增殖有抑制作用,对其凋亡有诱导作用。
直肠癌;唑来膦酸;COLO320细胞;增殖;凋亡
唑来膦酸(Zoledronic acid,ZOL)是第3代双膦酸盐类药物,是一种高效破骨细胞抑制剂,临床上主要用于各种肿瘤骨转移和良性骨病等的治疗,并取得了安全可靠的疗效[1]。临床前研究显示,ZOL除了有抑制骨吸收作用外,还具有直接的体内外抗肿瘤作用[2-3],并与化疗药物协同抗肿瘤,可以提高其化疗疗效[4]。理论上,ZOL的作用机制可能为:(1)抗血管生成效应[5];(2)抑制细胞增殖,促进细胞溶解,并诱导肿瘤细胞凋亡[6];(3)抑制肿瘤细胞扩散、浸润和黏附等。ZOL已被证实对于多种癌细胞系(如肺癌[7]、结肠癌[8]、胃癌[9]、乳腺癌[6]等)有直接抗肿瘤作用。而其对于直肠癌是否有作用目前鲜有报道。
本实验通过观察不同浓度ZOL作用于体外培养人直肠癌COLO320细胞后所导致的肿瘤细胞增殖的影响,及凋亡相关因子表达水平的变化,探讨ZOL对直肠癌COLO320细胞增殖及诱导凋亡作用的分子机制。
1 材料与方法
1.1 材料 人直肠癌COLO320细胞购自武汉大学细胞库。
1.2 主要试剂 ZOL粉剂购自Sigma公司;CCK-8试剂盒(日本同仁化学研究所);SuperReal PreMix Plus(SYBR Green)(北京天根生化科技有限公司);辣根酶标记山羊抗兔IgG、羊抗小鼠IgG(HRP标记)(北京中杉金桥生物有限公司);鼠抗人Bcl-2(美国Santa Cruz公司);兔抗人Bax、Bad(美国Cell Signaling公司);兔抗人Caspase-9(Bioworld Technology);RPMI-1640培养基(南京凯基);胎牛血清(杭州四季青生物工程有限公司);凯基Annexin VFITC/PI细胞凋亡试剂盒(南京凯基生物科技发展有限公司)。
1.3 方法
1.3.1 细胞培养:用含80 U/ml青霉素、0.08 mg/ml链霉素、10%胎牛血清的RPMI-1640培养基,在37 ℃、5%CO2饱和湿度培养箱中培养COLO320细胞。细胞呈单层贴壁生长。隔天换液,用0.05%胰蛋白酶消化传代。
1.3.2 CCK-8法检测ZOL对COLO320细胞增殖的影响:消化、收集处于对数生长期的细胞,调成为5×104/ml的单细胞悬液,接种于96孔板,100 μl/孔。24 h后,加入以RPMI-1640培养液配制的ZOL,至终浓度分别为20、40、60、80、100、120 μmol/L。实验设含RPMI-1640全培养基的空白对照组和仅经浓度调整但未给予药物的阴性对照组。每个浓度设6个复孔,分别于培养24、48、72和96 h后,每孔加入CCK-8试剂10 μl于37 ℃、5%CO2的培养箱中孵育1~2 h,实验重复3次,于酶标仪450 nm处检测光密度(D)值,并计算抑制率。增殖抑制率(%)=(1-实验组D值/对照组D值)×100%。
1.3.3 流式细胞术(FCM)细胞调亡检测方法:取对数生长期的COLO320细胞接种于6孔培养板中常规培养24 h使细胞贴壁生长;以0、20、40、60、80、100、120 μmol/L浓度的ZOL作用COLO320细胞72 h后,用不含乙二胺四乙酸(EDTA)的胰酶消化各组细胞,同样以不含药物的培养基作为阴性对照组;加入Binding Buffer悬浮细胞 500 μl/管,并转移到各相应的流式检测管中,加入Annexin V-FITC 5 μl/管,混匀后加入Propidium Iodide 5 μl/管,混匀;室温下、避光,待反应5~15 min后,移入4 ℃保存;在 1 h 内,进行FCM检测。
1.3.4 Western blotting法测定Bad、Bcl-2、Bax和Caspase-9蛋白表达水平:COLO320细胞经20、60、120 μmol/L浓度ZOL处理72 h后,加入适量裂解液,收集蛋白上清液,取蛋白提取液样品30 μl上样于12%的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)胶,转到聚偏氟乙烯(PVDF)膜;以脱脂奶粉封闭后,分别于4 ℃以1∶1 000浓度稀释的Bax、Bad单抗,以1∶500浓度稀释的Caspase-9及1∶100浓度稀释的Bcl-2抗体孵育过夜,洗膜后并孵育二抗2 h;用鸡冠刺桐凝集素(ECL)显色。用灰度软件扫描各组灰度值。
1.3.5 实时定量PCR(Real-Time PCR)测定Bad、Bcl-2、Bax和Caspase-9 mRNA表达水平:COLO320细胞经20、60、120 μmol/L浓度ZOL处理72 h后,以TRIzol液提取细胞总RNA,取适量用于反转录,产物用于实时定量PCR的扩增。目的基因Bad上游引物:5′-CCAGAGTTTGAGCCGAGTGAG-3′,下游引物:5′-GATGATGCTTGCCGGAGCC-3′;Caspase-9上游引物:5′-GCTCCTGGTACGTTGAGACC-3′,下游引物:5′-CACCGAAACAGCATTAGCGAC-3′;Bcl-2上游引物:5′-ATGTGTGTGGAGAGCGTCAA-3′,下游引物:5′-GAGACAGCCAGGAGAAATCAA-3′;Bax上游引物:5′-ATGGGCTGGACATTGGAC-3′,下游引物:5′-GGGACATCAGTCGCTTCAG-3′;以β-肌动蛋白(actin)为内参照,其上游引物:5′-CTTAGTTGCGTTACACCCTTTC-3′,下游引物:5′-GTCACCTTCACCGTTCCAGT-3′,PCR反应条件为:95 ℃变性15 s,60 ℃退火/延伸30 s,共40个循环。用Applied Biosystems(7500 Real Time PCR System)分析仪进行分析。

2 结果
2.1 CCK-8法检测ZOL对COLO320细胞增殖的影响 不同药物浓度对直肠癌COLO320细胞作用24~96 h后,细胞生长均受到不同程度的抑制,且随药物浓度升高抑制作用增强;相同药物浓度作用不同时间抑制作用不同,且随作用时间延长,抑制作用增强。统计学结果显示各组间的差异均有统计学意义(P<0.05)。不同浓度组间差异有统计学意义(P<0.01)。ZOL处理COLO320细胞24、48、72和96 h后的IC50值分别为209.4、103.6、74.1、65.6 μmol/L。根据IC50数值,我们选用ZOL作用72 h后做后续实验,为了进一步说明其具有浓度依赖性,我们选用20、60和120 μmol/L的药物浓度做后续实验。
2.2 ZOL对直肠癌COLO320细胞凋亡率的影响 用20、60、100及120 μmol/L浓度的ZOL处理直肠癌COLO320细胞72 h后的细胞凋亡率分别为(8.17±2.06)%、(19.80±2.10)%、(28.69±1.97)%、(28.85±1.45)%,与对照组(7.38±1.44)%相比,凋亡率均升高,差异均有统计学意义(P<0.05),但20 μmol/L浓度组与对照组相比差异无统计学意义(P>0.05);100及120 μmol/L浓度组间差异无统计学意义(P>0.05),其余各组间差异有统计学意义(P<0.05,见图1、图2)。

图1 ZOL对人直肠癌细胞COLO320增殖的影响
Fig 1 The effects of ZOL on the proliferation of human rectal cells COLO320
2.3 Western blotting法检测各组COLO320细胞相关凋亡基因的蛋白表达水平 经20、60和120 μmol/L浓度的ZOL处理直肠癌COLO320细胞72 h后,与对照组相比,Bad、Bax及Caspase-9蛋白的表达水平均升高,Bcl-2表达降低,且呈浓度依赖性,不同浓度组间比较差异均有统计学意义(P<0.05,见图3)。

图2 ZOL对直肠癌COLO320细胞凋亡率的影响 A:对照组;B:20 μmol/L浓度组;C:60 μmol/L浓度组;D:100 μmol/L浓度组;E:120 μmol/L浓度组;F:各浓度组
Fig 2 The effects of ZOL on apoptosis rate of COLO320 cells of rectal cancer A:control group;B:20 μmol/L concentration group;C:60 μmol/L concentration group;D:100 μmol/L concentration group;E:120 μmol/L concentration group;F:each concentration group

图3 ZOL对直肠癌细胞COLO320凋亡相关蛋白的影响
Fig 3 The effects of ZOL on apoptosis-related proteins of COLO320 cells of rectal cancer
2.4 荧光定量PCR结果 经ZOL处理后,与对照组组相比,各浓度组Bad、Bax及Caspase-9 mRNA的表达水平均升高,Bcl-2 mRNA表达下降,且呈浓度依赖性(见图4)。与未经药物处理的对照组相比,随着药物浓度的升高,20、60和120 μmol/L浓度ZOL处理后:Bad mRNA的表达量分别是对照组的1.41、2.29和3.34倍;Bax mRNA的表达量分别是对照组的1.66、2.14和2.70倍;Bcl-2 mRNA的表达量分别是对照组的87.1%、64.8%、34.1%;Caspase-9 mRNA的表达量分别是对照组的2.45、3.62和4.76倍。
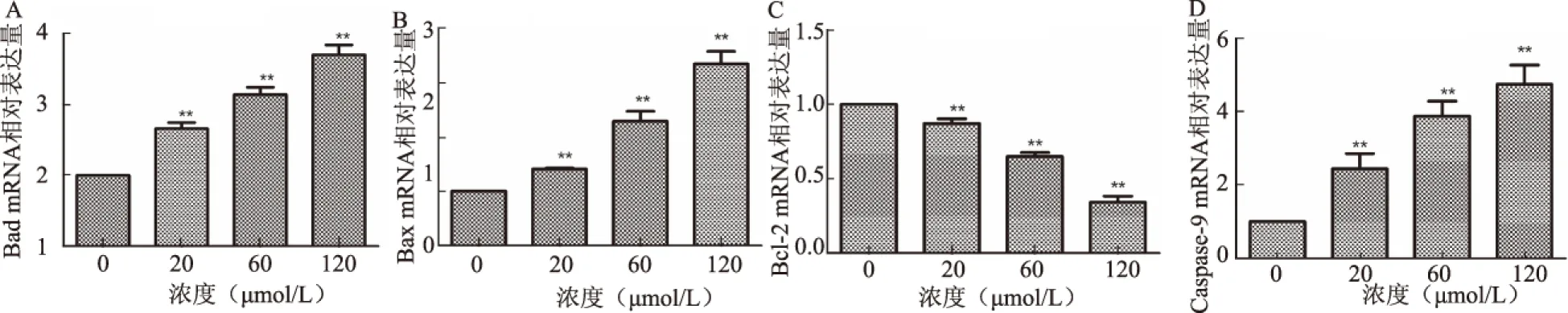
注:与0 μmol/L浓度相比,**P<0.05。
图4 ZOL对各浓度组相关凋亡基因mRNA相对表达量影响 A:Bad mRNA表达水平;B:Bax mRNA表达水平;C:Bcl-2 mRNA表达水平;D:Caspase-9 mRNA表达水平
Fig 4 Effect of ZOL on the expression of mRNA in different concentrations A: expression of Bad mRNA; B: expression of Bax mRNA; C: expression of Bcl-2 mRNA; D: expression of Caspase-9 mRNA
3 讨论
直肠癌是胃肠道常见的恶性肿瘤之一,发病率仅次于胃癌及结肠癌,好发于40岁以上男性,且发病年龄呈年轻化趋势,目前,直肠癌的根治仍以手术为主并辅以放化疗等综合治疗[10-11]。寻求安全、可靠且副作用小的药物仍是临床及科研的主要任务。
ZOL是第三代双磷酸盐类药物,自开发上市以来已在80多个国家广泛应用,其安全性得到肯定。ZOL的主要药理作用是通过抑制破骨细胞的活性和诱导破骨细胞凋亡来抑制骨吸收[12]。研究表明,其可有效控制多种实体瘤的骨相关事件,如前列腺癌[13-14]、肺癌和其他实体瘤[15-16]。除此之外,ZOL还具有体内外抗肿瘤活性作用[2-3]。
Bad、Bax、Bcl-2及Caspase-9在细胞凋亡的线粒体途径起着重要作用。研究表明在脊椎动物细胞凋亡过程中,线粒体被认为处于凋亡调控的中心位置,其关键分子是细胞色素C。细胞损伤后,细胞色素C从线粒体释放,与细胞凋亡激活因子1(Apaf-1)结合,并活化Caspase-9前体,进一步激活Caspase-3从而引发Caspases级联反应,诱发细胞凋亡[17-18]。Bcl-2家族在细胞凋亡的线粒体途径中起着非常重要的调控作用[19]。Bcl-2家族成员分布广泛,但大量数据表明主要效应部位是线粒体。在细胞凋亡过程中,Bcl-2家族促凋亡成员被激活,导致BH3结构域暴露[可能与去磷酸化方式(Bid)或Caspases蛋白水解作用(Bad)等有关],引起其构象改变,并转移到线粒体[19]。Bax、Bad或Bid转移到线粒体后(Bax在线粒体外膜通过形成离子通道方式促进细胞色素C等蛋白分子释放),可引起线粒体释放大量蛋白质,包括细胞色素C。细胞色素C进入线粒体后转化为全细胞色素C,其可以诱导Caspases激活。而Bcl-2和Bcl-xl可直接与Caspases前体联结的Apaf-1相结合存在于线粒体外膜。通过线粒体-Bcl-2/Bcl-xl-Apaf-1-caspase 9前体四聚体复合物,对Apaf-1结构进行调控,这样,通过抑制细胞色素C的释放,Bcl-2和Bcl-xl等就可以最终发挥抑制细胞凋亡作用[20]。可见,Bcl-2表达具有抑制细胞凋亡作用。Bad、Bax及Caspase-9的表达可促进细胞的凋亡。
本实验结果显示,经ZOL处理后的COLO320细胞,与未经ZOL处理细胞相比,其Bcl-2 mRNA及其蛋白表达含量均减少,而Bad、Bax及Caspase-9 mRNA及其蛋白表达含量均增多,说明ZOL对直肠癌COLO320细胞的凋亡有促进作用,并推想线粒体途径可能是ZOL诱导细胞凋亡的重要途径之一。结合CCK8结果分析ZOL对COLO320细胞的增殖有明显抑制作用。本实验表明,ZOL对直肠癌有一定的抗肿瘤作用,但本实验仅限于体外实验阶段,其具体的抗肿瘤作用仍需体内实验进一步探索。
[1]Cheer SM, Noble S. Zoledronic acid [J]. Drugs, 2001, 61(6): 799-805.
[2]Evdokiou A, Labrinidis A, Bouralexis S, et al. Induction of cell death of human osteogenic sarcoma cells by zoledronic acid resembles anoikis [J]. Bone, 2003, 33(2): 216-228.
[3]Neville-Webbe HI, Coleman RE. The use of zoledronic acid in the management of metastatic bone disease and hypercalcaemia [J]. Palliat Med, 2003, 17(6): 539-553.
[4]Jagdev SP, Coleman RE, Shipman CM, et al. The bisphosphonate, zoledronic acid, induces apoptosis of breast cancer cells: evidence for synergy with paclitaxel [J]. Br J Cancer, 2001, 84(8): 1126-1134.
[5]Fournier P, Boissier S, Filleur S, et al. Bisphosphonates inhibit angiogenesis in vitro and testosterone-stimulated vascular regrowth in the ventral prostate in castrated rats [J]. Cancer Res, 2002, 62(22): 6538-6544.
[6]Gordon S, Helfrich MH, Sati HI, et al. Pamidronate causes apoptosis of plasma cells in vivo in patients with multiple myeloma [J]. Br J Haematol, 2002, 119(2): 475-483.
[7]Mahtani R, Khan R, Jahanzeb M. The potential application of zoledronic acid as anticancer therapy in patients with non-small-cell lung cancer [J]. Clin Lung Cancer, 2011, 12(1): 26-32.
[8]高翔, 江波, 张婷, 等. 唑来膦酸诱导结肠癌HCT116细胞株凋亡分子的研究[J]. 中华实验外科杂志, 2013, 30(3): 458-460. Gao X, Jiang B, Zhang T, et al. Zoledronate triggers HCT116 colorectal cancer cell line apoptosis by mitochondria pathway [J]. Chin J Exp Surg, 2013, 30(3): 458-460.
[9]姚强, 闵科, 邓建良, 等. 唑来膦酸对胃癌细胞株SGC-7901体外抗增殖及对VEGF的影响[J]. 海南医学, 2014, 25(19): 2819-2821. Yao Q, Min K, Deng JL, et al. Proliferation inhibition function of zoledronic acid on human gastric cancer cell SGC-7901 and its influence on VEGF [J]. Hainan Med J, 2014, 25(19): 2819-2821.
[10]Hyodo I, Suzuki H, Takahashi K, et al. Present status and perspec-tives of colorectal cancer in Asia: Colorectal Cancer Working Group report in 30th Asia-Pacific Cancer Conference [J]. Jpn J Clin Oncol, 2010, 40 Suppl 1: 38-43.
[11]卫生部医政司. 结直肠癌诊疗规范(2010年版) [J]. 中国医学前沿杂志(电子版), 2011, 03(6): 130-146. Department of Health Administration. Specification for diagnosis and treatment of colorectal cancer (2010 Edition) [J]. Frontiers of Medical Science in China (Electronic Edition), 2011, 03(6): 130-146.
[12]Skerjanec A, Berenson J, Hsu C, et al. The pharmacokinetics and pharmacodynamics of zoledronic acid in cancer patients with varying degrees of renal function [J]. J Clin Pharmacol, 2003, 43(2): 154-162.
[13]Saad F, Gleason DM, Murray R, et al. A randomized, placebo-controlled trial of zoledronic acid in patients with hormone-refractory metastatic prostate carcinoma [J]. J Natl Cancer Inst, 2002, 94(19): 1458-1468.
[14]Rosen LS, Gordon D, Tchekmedyian S, et al. Zoledronic acid versus placebo in the treatment of skeletal metastases in patients with lung cancer and other solid tumors: a phase III, double-blind, randomized trial-the zoledronic acid lung cancer and other solid tumors study group [J]. J Clin Oncol, 2003, 21(16): 3150-3157.
[15]Rosen LS, Gordon D, Tchekmedyian NS, et al. Long-term efficacy and safety of zoledronic acid in the treatment of skeletal metastases in patients with nonsmall cell lung carcinoma and other solid tumors: a randomized, Phase III, double-blind, placebo-controlled trial [J]. Cancer, 2004, 100(12): 2613-2621.
[16]Lipton A, Zheng M, Seaman J. Zoledronic acid delays the onset of skeletal-related events and progression of skeletal disease in patients with advanced renal cell carcinoma [J]. Cancer, 2003, 98(5): 962-969.
[17]Herr I, Debatin KM. Cellular stress response and apoptosis in cancer therapy [J]. Blood, 2001, 98(9): 2603-2614.
[18]刘光伟, 龚守良. 细胞凋亡的线粒体调控机制与电离辐射[J]. 国外医学(放射医学核医学分册), 2003, 27(2): 90-93. Liu GW, Gong SL. Mitochondrial control mechanism on apoptosis and ionizing radiation [J]. Foreign Medical Sciences of Radiation Medicine and Nuclear Medicine, 2003, 27(2): 90-93.
[19]Desagher S, Osen-Sand A, Nichols A, et al. Bid-induced conformational change of Bax is responsible for mitochondrial cytochrome c release during apoptosis [J]. J Cell Biol, 1999, 144(5): 891-901.
[20]Gross A, McDonnell JM, Korsmeyer SJ. BCL-2 family members and the mitochondria in apoptosis [J]. Genes Dev, 1999, 13(15): 1899-1911.
(责任编辑:马 军)
Effects of Zoledronic acid on the proliferation and apoptosis of human rectal cancer COLO320 cells in vitro
TIAN Tian1, LENG Jie1, ZHAO Jing2, GAO Xiangyang2, SONG Chao2, GAO Chao2
1.Grade 2013, Graduate School of Medical sciences, Xuzhou Medical University, Xuzhou 221004; 2.Department of Oncology, the Affiliated Hospital of Xuzhou Medical University, China
Objective To investigate the effects and possible mechanisms of Zoledronic acid (ZOL) on the proliferation and apoptosis of human rectal cancer COLO320 cell in vitro.Methods The proliferation of COLO320 cells exposed to different concentrations of ZOL for various periods was examined by the cell counting kit-8(CCK-8), the rate of inhibition and the half maximal inhibitory concentration (IC50) were calulated. Flow cytometry(FCM) showed ZOL induced apoptosis in COLO320 cells. The expressions of Bad, Bcl-2, Bax and Caspase-9 were measured by Western blotting and Real-Time PCR. Results Compared with the control group, ZOL treatment could remarkably inhibit the proliferation of rectal cancer COLO320 cells in a dose-and time-dependent manner (P<0.05). The values of IC50were 209.4 μmol/L for 24 hours, 103.6 μmol/L for 48 hours, 74.1 μmol/L for 72 hours, 65.6 μmol/L for 96 hours. FCM showed that the apoptosis rate of colorectal cancer cells COLO320 72 hours treated with different concentrations of ZOL were increased with different degrees compared with control group, but there was no significant difference between the 20 μmol/L concentration group and the control group (P>0.05), there were statistically significant differences between control group and other groups (P<0.05). Meanwhile, Western blotting and Real-Time PCR results showed that the expression of Bcl-2 was down-regulated and expressions of Bad, Bax and Caspase-9 mRNA were up-regulated at a dose-dependent manner in COLO320 cells.Conclusion ZOL can inhibit the proliferation and induce apoptosis in rectal cancer COLO320 cells in vitro.
Rectal cancer; Zoledronic acid; COLO320 cells; Proliferation; Apoptosis
10.3969/j.issn.1006-5709.2016.10.024
田甜,硕士研究生,研究方向:消化道肿瘤的综合治疗。E-mail: 814883815@qq.com
高超,教授,硕士生导师,主任医师,研究方向:消化道肿瘤的综合治疗。E-mail: gaochaoly@sina.com
R735.3+7
A
1006-5709(2016)10-1171-05
2016-03-29
