不同浓度DSS诱导小鼠溃疡性结肠炎模型的比较
2016-06-01胡丽红
李 晴, 胡丽红, 曲 波
哈尔滨医科大学附属第二医院消化内科,黑龙江 哈尔滨 150086
不同浓度DSS诱导小鼠溃疡性结肠炎模型的比较
李 晴, 胡丽红, 曲 波
哈尔滨医科大学附属第二医院消化内科,黑龙江 哈尔滨 150086
目的 对比研究不同浓度葡聚糖硫酸钠(dextran sulfate sodium, DSS)诱导的小鼠溃疡性结肠炎(ulcerative colitis, UC)模型,从不同角度监测炎症反应程度,为实验造模提供理论数值,并选择最佳的造模方案。方法 用BALB/C小鼠自由饮用DSS溶液的方法建立低浓度(3%)和高浓度(5%)模型组,正常对照组饮用蒸馏水,每组24只。分别于第0天、3天、7天对小鼠进行动态观察:疾病活动指数(disease activity index, DAI)、结肠组织病理学改变、血清中HGB、CRP、TNF-α的表达、结肠黏膜中MOP、SOD、NF-κB的表达及NF-κB核转位情况、绘制小鼠生存曲线。结果 HGB、SOD与UC疾病活动程度呈负相关,CRP、TNF-α、MOP、NF-κB与UC疾病活动程度呈正相关,均表现出明显的时间和剂量依赖性。结论 随着造模浓度和时间的增加,小鼠模型UC的炎症程度也逐渐加重,但死亡率也随之增加,得出3% DSS溶液喂养7 d建立的UC小鼠模型为最佳。
葡聚糖硫酸钠;小鼠;溃疡性结肠炎;造模
溃疡性结肠炎(ulcerative colitis, UC)是一种病因和发病机制尚不明确的慢性非特异性肠道炎性病变,发病率在我国逐年上升,其发病机制并不明确,治疗也缺乏特异性方法,成为近些年消化领域的热点。
葡聚糖硫酸钠(dextran sulfate sodium, DSS)诱导的小鼠UC模型的肠道病变与人类UC肠道病理形态变化最为相近[1],因此被广泛应用。目前较为常用的造模DSS溶液浓度为3%和5%[1-3],部分研究[4-5]以疾病活动指数(disease activity index, DAI)对小鼠进行评估,发现DAI评分随着DSS溶液浓度呈线性增加。本文将通过更全面的实验指标检测,并对与UC发生、发展相关的核因子-κB(nuclear factor,NF-κB)[6]在UC小鼠结肠黏膜中的表达及激活情况进行比较,以便指导我们选择更优的方式建立UC小鼠模型。
1 材料与方法
1.1 材料
1.1.1 动物:雄性BALB/C小鼠,体质量25~30 g,常规喂养,由哈尔滨市附属第二医院动物实验中心提供。
1.1.2 主要试剂:DSS(M.W.=36 000~50 000,上海翊圣生物科技有限公司);MPO测定试剂盒、SOD测定试剂盒、ELISA试剂盒(北京义翘神州生物科技有限公司);EMSA试剂PIERCE公司;其他试剂为进口或国产分析纯。
1.2 分组 72只BALB/C小鼠随机分为正常对照(蒸馏水)组、低浓度(3%)组和高浓度(5%)组,每组24只,各组内又随机分为0 d、3 d、7 d 3个小组(8只/组)。
1.3 实验观察
1.3.1 一般状态:动态观察小鼠体质量、大便性状及便血情况,根据表1进行DAI评分[7],并分别于第0天、3天、7天3个时间点对小鼠进行相关实验指标检测。
表1 DAI评分标准
Tab 1 Scoring of DAI

计分体质量下降(%)大便性状血便0无正常阴性11~5——26~10半稀便潜血310~15——4>15稀便肉眼血便
注:正常大便为干燥成形且呈小粒状,半稀便为糊状但不黏肛门,稀便为液体状且黏肛门。
1.3.2 血液化验:摘眼球取血,将血液静置离心(3 500 r/min)10 min,取血清,分装后置-20 ℃冰箱保存,实验结束后,一部分统一于相关实验室测定血红蛋白(hemoglobin, HGB)、C反应蛋白(C-reactive protein, CRP)含量。
1.3.3 TNF-α检测:另一部分静脉血应用ELISA法严格按照试剂盒说明书统一测定肿瘤坏死因子-α(tumor necrosis factor-alpha, TNF-α)的表达,以标准物的浓度为横坐标,OD值为纵坐标绘制标准曲线,根据样品的OD值由坐标曲线查出相应的浓度,然后乘以稀释倍数进行计算。
1.3.4 MPO与SOD的活性测定:处死小鼠后取结肠标本,第一部分以4.0%多聚甲醛固定,石蜡包埋后行4 μm厚度切片,HE染色光镜下观察组织病理学形态;第二部分用以测定髓过氧化物酶(myeloperoxidase, MPO)、超氧化物歧化酶(superoxide dismutase, SOD)的活性,冰1×PBS冲洗,冻存于液氮中,测定时从液氮中取出结肠组织,称重,剪碎,以冰生理盐水作匀浆介质,玻璃匀浆器冰上匀浆成10%匀浆液,其他操作步骤根据试剂盒要求,做相应处理后测定吸光度,计算相应的MOP、SOD活性。
1.3.5 NF-κB的表达:组织以免疫组化方法测定NF-κB的表达,显微镜下,细胞浆和细胞核内出现棕黄色颗粒的细胞为NF-κB P65阳性细胞,在40倍高倍镜下选取典型视野计数1 000个细胞,其中阳性细胞数作为NF-κB P65计数值,并以百分率表示。
1.3.6 NF-κB的活化情况:检测NF-κB核转位情况,采用EMSA方法,活化的DNA结合蛋白可与特定序列的DNA探针结合形成DNA-蛋白复合物而使其电泳迁移率显著减慢,于是在胶片或成像系统上出现较游离条带滞后的新条带,根据滞后条带的强弱对样品中的DNA结合蛋白(NF-κB)活性进行半定量分析。

2 结果
2.1 一般情况 正常对照组小鼠生长良好,无明显变化;低浓度组第3天出现半稀便,便潜血阳性,此后逐渐出现体质量减轻、稀便、肉眼血便;高浓度组第2天即出现便血,体质量减轻明显(见表2)。此外,低浓度组3 d小鼠无死亡,高浓度组3 d小鼠死亡1只;低浓度组7 d小鼠死亡1只,高浓度组7 d小鼠死亡3只,高浓度组小鼠生存率明显低于低浓度组(见图1)。
表2 各模型组DAI值比较
Tab 2 Comparison of DAI value in each model group

分组DAI评分F值P值3d低浓度组2.38±0.521100.68<0.053d高浓度组4.29±0.497d低浓度组11.29±0.497d高浓度组11.40±0.89
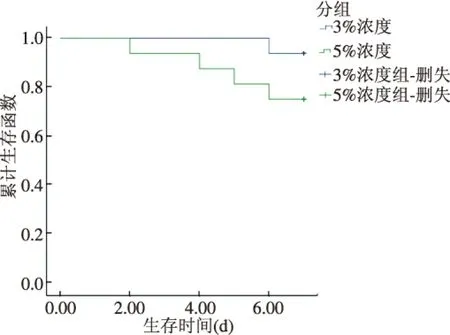
图1 小鼠生存曲线
2.2 病理形态学观察 正常对照组小鼠结肠未见明显病理改变。随着DSS浓度及实验天数的增加,可见炎性细胞浸润的程度随之增加,逐渐出现结缔组织坏死,黏膜上皮细胞随之坏死脱落(见图2)。
2.3 血液指标检测结果 血液中HGB的表达与UC疾病活动程度呈负相关(F=434.05,P<0.0001),CRP的表达与UC疾病活动程度呈正相关(F=308.01,P<0.0001,见表3)。
图2 病理形态学观察 A: 3 d正常对照组(HE 100×); B: 7 d正常对照组(HE 200×); C: 3 d低浓度组 (HE 200×); D:3 d高浓度组 (HE 200×); E: 7 d低浓度组 (HE 200×); F: 7 d高浓度组 (HE 200×)
Fig 2 Observation of pathomorphology A: normal control of 3 days (HE 100×); B: normal control of 7 days (HE 200×); C: low concentration of 3 days (HE 200×); D: high concentration of 3 days (HE 200×); E: low concentration of 7 days (HE 200×); F: high concentration of 7 days (HE 200×)
2.4 TNF-α在UC模型中的表达 实验中随着DSS溶液浓度及实验天数的增加,TNF-α的表达与UC炎症程度呈正相关(F=3655.50,P<0.0001,见表4)。
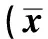
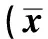

分组HGBF值P值CRPF值P值对照组0d161.88±6.31434.05<0.00010.93±0.10308.01<0.00013d163.38±3.290.84±0.077d161.88±6.310.93±0.10低浓度组0d161.50±6.190.86±0.043d140.63±3.621.41±0.047d73.29±4.921.85±0.05高浓度组0d162.13±5.380.91±0.103d106.86±4.261.71±0.047d60.00±3.542.09±0.06



分组TNF⁃αF值P值对照组3655.50<0.00010d35.25±1.583d35.88±1.257d35.75±1.39低浓度组0d36.25±3.853d84.00±2.007d134.14±2.12
续表4

分组TNF⁃αF值P值高浓度组0d36.25±1.393d104.00±1.417d155.00±1.87
2.5 MPO与SOD的活性测定 MPO与UC疾病活动呈正相关,SOD与UC病情活动程度呈负相关(见表5)。
2.6 NF-κB的表达情况 正常对照组、0 d低浓度、高浓度组几乎无NF-κB的表达;3 d、7 d高浓度组的表达明显高于低浓度组;而无论低浓度组还是高浓度组,7 d较3 d浓度组的表达均升高(见表6、图2)。

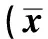

分组MOPF值P值SODF值P值对照组0d0.23±0.042085.04<.000180.86±6.6393.93<.00013d0.22±0.0381.38±4.037d0.23±0.0480.88±6.62低浓度组0d0.22±0.0282.00±5.103d0.68±0.0262.38±2.337d1.23±0.0345.86±3.48高浓度组0d0.22±0.0280.38±6.783d0.88±0.0351.86±2.127d1.62±0.0332.60±4.16
2.7 NF-κB核转位情况 通过EMSA方法分析,形成的新条带由强到弱的顺序分别为7 d高浓度组、7 d低浓度组、3 d高浓度组、3 d低浓度组(见图3)。
3 讨论
由于UC的病因不够明确,治疗上也缺乏特异性的药物,对UC患者造成相当大的困扰,世界卫生组织将其列为难治性疾病之一。因此选择合适浓度的DSS溶液建立更为标准的UC小鼠模型,对今后UC发病机制的研究及新药物的开发显得尤为重要。



分组NF⁃κBF值P值对照组1109.95<0.00010d1.43±0.173d1.35±0.147d1.35±0.18低浓度组0d1.45±0.143d3.20±0.157d5.09±0.16高浓度组0d1.35±0.183d4.66±0.107d6.32±0.11

图3 NF-κB的病理表达(免疫组化400×) A: 3 d正常对照组; B: 7 d正常对照组; C: 3 d低浓度组; D: 3 d高浓度组; E: 7 d低浓度组; F: 7 d高浓度组
Fig 3 Expression of NF-κB (IHC 400×) A: normal control of 3 days; B: normal control 7 days; C: low concentration of 3 days; D: high concentration of 3 days; E: low concentration of 7 days; F: high concentration of 7 days

图3 EMSA法检测NF-κB核转位情况 CK: 竞争抑制; SM3: 3 d低浓度组; HM3: 3 d高浓度组; SM7: 7 d低浓度组; HM7: 7 d高浓度组; 100: 阴性对照组
Fig 3 The nuclear translocation of NF-κB with EMSA CK: competitive inhibition;SM3: low concentration of 3 days; HM3: high concentration of 3 days; SM7: low concentration of 7 days; HM7: high concentration of 7 days; 100: negative control
目前建立UC模型的化学方法有很多种,例如乙酸造模法、角叉菜胶造模法、DSS造模法、NaOONO2造模法、TNBS造模法、DNCB造模法等,但每种造模方法都不尽如人意,通常存在操作复杂、造模成功后自愈性强、成本高等缺点,但近年DSS造模法应用最广泛,因其模型临床症状、病理表现、疾病预后转归与人UC最为相似[1]。
本研究实验初期(0 d),我们对每一组检测指标均进行了相关性分析(P>0.05),从而保证了实验基线水平的一致性;同样对3 d、7 d的检测指标也进行了相关性分析,各检测指标的相关性都很强(P<0.05),实验结束后,我们应用3×3析因设计检测各指标给药时间和给药浓度的主效应和交互效应(P<0.05),可以认为不同给药时机、不同给药浓度对UC小鼠模型都有影响,在一定范围内,给药时间越长UC小鼠模型越好,给药浓度越高UC小鼠模型越好。最后在总体有统计学意义的基础上对各个检测指标进行两两比较,差异均有统计学意义(P<0.05)。
NF-κB是一种具有多向转录调节作用的蛋白质,参与许多疾病的发病机制[8-10]。正常状态下,NF-κB家族成员通常以二聚体形式与其抑制蛋白IκB形成复合物,以非活性形式存在于细胞质中。在各种活化因素的作用下,IκB蛋白激酶IKK活化,IκB被磷酸化并通过26S蛋白酶体顺序降解,与NF-κB解离,NF-κB活化进入细胞核内,其DNA结合位点暴露,与DNA启动子上特定的认知序列结合,调控NF-κB反应性基因的转录。在UC中,活化的NF-κB可调节与UC发生、发展相关的促炎性细胞因子,如TNF-α等的产生和释放,加重肠道的炎性反应[6,11]。由此提示NF-κB的激活在UC免疫调节及炎症反应中起关键作用。在以往的实验中[12-13]已经得到证实,随着UC动物模型炎症程度的增加,肠组织中NF-κB的表达随之增强,核转位随之活跃,本实验也得出了一致的结论。
从整体实验中可以看出药物浓度高、给药时间长的UC模型各项实验指标的变化与UC炎症变化更为接近,但是动物模型的建立是后续实验的基础,需综合考虑模型的死亡率,因此结合小鼠生存曲线,本实验得出3%DSS溶液喂养7 d建立的UC小鼠模型为最佳。
[1]Okayasu I, Hatakeyama S, Yamada M, et al. A novel method in the induction of reliable experimental acute and chronic ulcerative colitis in mice [J]. Gastroenterology, 1990, 98(3): 694-702.
[2]Zhang DK, Yu JJ, Li YM, et al. A Picrorhiza kurroa derivative, picroliv, attenuates the development of dextran-sulfate-sodium-Induced colitis in mice [J]. Mediators Inflamm, 2012, 2012(2): 751629.
[3]Chen X, Zhai X, Shi J, et al. Lactulose mediates suppression of dextran sodium sulfate-induced colon inflammation by increasing hydrogen production [J]. Dig Dis Sci, 2013, 58(6): 1560-1568.
[4]Egger B, Bajaj-Elliott M, Macdonald TT, et al. Characterisation of acute murine dextran sodium sulphate colitis: cytokine profile and dose dependency [J]. Digestion, 2000, 62(4): 240-248.
[5]张艳丽, 黄循铷, 王承党. 小鼠葡聚糖硫酸钠急性溃疡性结肠炎模型的建立和评价[J]. 胃肠病学和肝病学杂志, 2006, 15(2): 130-133. Zhang YL, Huang XR, Wang CD. The establishment of acute ulcerative colitis in mice induced with DSS [J]. Chin J Gastroenterol Hepatol, 2006, 15(2): 130-133.
[6]Ke X, Zhou F, Gao Y, et al. Qing Hua Chang Yin exerts therapeutic effects against ulcerative colitis through the inhibition of the TLR4/NFκB pathway [J]. Int J Mol Med, 2013, 32(4): 926-930.
[7]Murano M, Maemura K, Hirata I, et al. Therapeutic effect of intracolonically administered nuclear factor kappa B (p65) antisense oligonucleotide on mouse dextran sulphate sodium (DSS)-induced colitis [J]. Clin Exp Immunol, 2000, 120(1): 51-58.
[8]Tak PP, Firestein GS. NF-κB: a key role in inflammatory diseases [J]. J Clin Invest, 2001, 107(1): 7-11.
[9]Baldwin AS Jr. Series Introduction: The transcription factor NF-κB and human disease [J]. J Clin Invest, 2001, 107(1): 3-6.
[10]Chen FE, Huang DB, Chen YQ, et al. Crystal structure of p50/p65 heterodimer of transcription factor NF-kappaB bound to DNA [J]. Nature, 1998, 391(6665): 410-413.
[11]Baeuerle PA, Baltimore D. I kappa B: a specific inhibitor of the NF-kappa B transcription factor [J]. Science, 1988, 242(4878): 540-546.
[12]李军华, 于皆平, 何小飞, 等. 核因子-κB在大鼠实验性溃疡性结肠炎肠组织的表达及其意义 [J]. 世界华人消化杂志, 2003, 11(2): 214-218. Li JH, Yu JP, He XF, et al. Expression of NF-κB in rats with TNBS-induced ulcerative colitis [J]. World Chin J Dig, 2003, 11(2): 214-218.
[13]甘华田, 欧阳钦, 陈友琴, 等. 溃疡性结肠炎患者肠粘膜κ基因结合核因子的活化及抗炎药物的作用 [J]. 中华医学杂志, 2002, 82(6): 384-388. Gan HT, Ouyang Q, Chen YQ, et al. Activation of nuclear factor-κB and effects of anti-inflammatory treatment thereon in intestinal mucosa of patients with ulcerative colitis [J]. Natl Med J China, 2002, 82(6): 384-388.
(责任编辑:马 军)
Comparison of different concentrations of DSS induced a mouse model of ulcerative colitis
LI Qing, HU Lihong, QU Bo
Department of Gastroenterology, the 2nd Affiliated Hospital of Harbin Medical University, Harbin 150086, China
Objective To compare the mice ulcerative colitis (UC) model induced by different concentrations of dextran sulfate sodium (DSS), to monitore the degree of inflammation from different angles, and to choose the best modeling program. Methods The BALB/C mice were fed with 3% and 5% DSS solution to induce low concentration and high concentration colitis, the control group was only fed with distilled water, 24 mice in each group. The mice were observed dynamically at the 0, 3rd and 7th days: disease activity index (DAI), the histopathological changes of colon, the expression of HGB, CRP, TNF-α in serum, the contents of MOP, SOD, NF-κB in colonic mucosa and the nuclear translocation of NF-κB. Survival curves of mice were drawn. Results HGB, SOD levels were negatively associated with disease activity of UC, CRP, TNF-α, MOP and NF-κB levels were positively associated with disease activity of UC, they all showed a significant dose-dependent and time. Conclusion With the degree of inflammation in murine models modeling concentration and time of UC has gradually increased, but the mortality rate also increased, that the UC model fed 7 days with the concentration of 3%DSS is the best.
Dextran sulfate sodium; Mice; Ulcerative colitis; Modeling
10.3969/j.issn.1006-5709.2016.10.008
黑龙江省卫生计生委科研课题(2014-332)
李晴,在读硕士研究生,研究方向:溃疡性结肠炎发病机制的研究。E-mail:1206105474@qq.com
曲波,主任医师,教授,硕士研究生导师,研究方向:内镜下的诊断与治疗。E-mail:qubo-1970@hotmail.com
R574.62
A
1006-5709(2016)10-1106-05
2016-03-02
