肝癌肝移植术后索拉非尼治疗肿瘤复发与胰腺萎缩的关系
2016-04-19庄莉钟海钢屠振华王卓轶章茫里张珉郑树森
庄莉 钟海钢 屠振华 王卓轶 章茫里 张珉 郑树森
·论著·
肝癌肝移植术后索拉非尼治疗肿瘤复发与胰腺萎缩的关系
庄莉 钟海钢 屠振华 王卓轶 章茫里 张珉 郑树森
目的 探索肝癌肝移植术后肿瘤复发的患者,长期服用索拉非尼与胰腺体积动态变化及相关不良反应的关系。方法 回顾性分析浙江大学医学院附属第一医院因肝癌行肝移植,且术后发生肝细胞肝癌(HCC)复发转移,并于2013年1月至12月期间开始服用索拉非尼治疗并存活2年以上患者的临床和影像资料。观察索拉非尼不良反应的发生情况,索拉非尼治疗前、后均行腹部增强CT,并对胰腺进行半自动逐层冠状位和矢状位的三维重建。服药前后胰腺体积中位数的比较及发生和未发生手足皮肤反应(HFSR)的患者胰腺萎缩程度的比较采用Wilcoxon符号秩和检验。结果 研究共纳入9例肝移植术后HCC复发接受索拉非尼治疗的患者,男性7例,女性2例;开始服用索拉非尼的中位年龄为44岁(35~65岁)。截至2016年3月,中位随访时间35.8个月(26.5~52.8个月),患者移植肝功能稳定,随访过程中未发生排斥反应,均带瘤生存,按世界卫生组织实体肿瘤改良疗效评价标准评估为疾病稳定。9例患者服药前、后接受了共计32次胰腺体积CT检查,均出现了胰腺体积减少,首次发现胰腺萎缩的中位时间为服药后3个月(2~36个月)。患者服药前和服药后最后一次CT检查胰腺体积中位数分别为70.4 mL 和59.2 mL,减少了16%,差异有统计学意义(Z=-2.55,P<0.05)。3例发生HFSR的患者和6例未发生HFSR的患者最后一次CT检查胰腺萎缩程度分别为24%和11%,差异有统计学意义(Z=-1.81,P<0.05),结论 肝癌肝移植术后接受索拉非尼治疗肿瘤复发的患者可出现胰腺萎缩,胰腺萎缩与索拉非尼的服药时间有一定关系,服药早期(服药后3个月内)即可出现体积减少,这种体积变化可长期存在且多数不可逆。
肝移植; 肝细胞肝癌; 索拉非尼; 胰腺萎缩
近年来,肝细胞肝癌(hepatocellular carcinoma, HCC)的发生率仍在逐年升高,目前已经成为世界上第7位高发肿瘤,我国形势尤为严峻,约有55%的新发肝癌和45%的HCC相关死亡发生在中国[1]。肝移植已经成为治疗HCC的重要手段,但HCC的生物学特性以及移植术后应用免疫抑制剂所导致的HCC高复发率,是影响受者生存的重要因素[2]。
对于肝癌肝移植术后复发的HCC,外科手术切除病灶以及经导管肝动脉化疗栓塞(transcatheter arterial chemoembolization, TACE)等综合治疗手段能够在一定程度上改善患者预后[2-4]。系统的全身治疗同样引起研究者的重视,2个多中心大型随机对照研究发现,对于非肝移植的HCC患者,多激酶抑制剂索拉非尼是唯一已被证明能使患者获益的靶向药物[5-6]。近年来也有一些研究发现,索拉非尼有助于改善肝癌肝移植术后HCC复发患者的预后,甚至该类患者对索拉非尼具有更好的耐受性[7-10]。
目前,索拉非尼的使用仍因其不良反应以及缺乏确切的长期疗效而受限,最常见的不良反应包括腹泻和手足皮肤反应(hand-foot skin reaction, HFSR),经常导致患者减量或停药。然而有研究表明,HCC患者中早期皮肤毒性[11]或腹泻[12-13]的发生可能提示较好的药物疗效及预后。2013年,有学者报道了HCC患者长期接受索拉非尼治疗后出现的新的不良反应——胰腺萎缩,2例患者分别在接受索拉非尼治疗7个月和37个月后被发现胰腺体积减少20%和35%[14]。本研究回顾性分析浙江大学医学院附属第一医院肝癌肝移植术后肿瘤复发服用索拉非尼治疗的患者资料,研究胰腺体积动态变化情况及其与索拉非尼相关不良反应的关系。
1 资料和方法
1.1 研究对象
回顾性分析在本院因肝癌行肝移植且术后发生HCC复发转移,于2013年1月至12月期间开始服用索拉非尼治疗并存活2年以上患者的临床和影像资料。纳入标准:肝移植前受者符合肝癌肝移植“杭州标准”;年龄大于18岁;代偿期肝硬化(Child-Pugh分级A~B级);美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)活动状态评分0~2级;有服药前、后(至少2次)腹部CT检查影像资料。排除标准:既往存在胰腺病变;既往有胰腺手术史。肝移植术后HCC复发转移的诊断依据美国肝病研究学会的推荐标准[15]。本研究获得本院医学伦理委员会批准,并取得所有患者的书面知情同意。
1.2 免疫抑制方案和抗病毒方案
肝移植围手术期免疫抑制方案为他克莫司+吗替麦考酚酯+巴利昔单抗+糖皮质激素(术中1 000 mg)。供、受者ABO血型不合则加用利妥昔单抗(375 mg/m2)和免疫球蛋白。术后2个月时若受者粒细胞水平正常且无高脂血症和蛋白尿,则将他克莫司转换为雷帕霉素;若出现粒细胞减少(<1.3×109/L)或严重腹泻,则停用吗替麦考酚酯。乙肝复发的抗病毒治疗方案为拉米夫定联合低剂量乙肝免疫球蛋白。
1.3 抗肿瘤综合治疗方案
肝移植术后HCC复发患者若存在手术指征则行手术治疗;无手术指征则接受积极的介入治疗,如TACE、射频消融(radio frequency ablation,RFA)以及全身静脉化疗。肿瘤治疗疗效评估依据世界卫生组织实体肿瘤改良疗效评价标准(modified response evaluation criteria in solid tumors,mRECIST)分为完全缓解、部分缓解、疾病稳定和疾病进展[16]。
1.4 索拉非尼治疗方案
索拉非尼起始剂量为400 mg/次,2次/d;肝功能异常患者则为200 mg/次,2次/d,耐受良好则2~4周增加至400 mg/次,2次/d。依据美国国立癌症研究所常见不良反应事件评价标准(National Cancer Institute, Common Terminology Criteria for Adverse Events, NCI CTCAE)4.0版[17]判断不良反应的发生和分级。患者出现中度(2级)不良反应时将索拉非尼减量,不良反应缓解后恢复原剂量;出现重度(3级)不良反应时,中断治疗直至不良反应缓解为1级或完全缓解,之后持续减量治疗。轻、中度腹泻给予蒙脱石散或盐酸洛哌丁胺胶囊治疗,重度腹泻(>12次/d或有脱水表现)则暂时停药。所有患者使用尿素软膏预防皮肤毒性,重度HFSR患者则按烧伤专科处理[12]。我们根据服药后8周内是否发生HFSR定义“早发”和“迟发”。患者出现皮疹则予扑尔敏等抗组胺药。
1.5 CT扫描和影像处理
索拉非尼治疗前、后均行腹部增强CT,从肝脏膈顶处向下扫描至髂骨嵴,通过自动化双腔电动注射器静脉注射碘对比剂,注射剂量为80~100 mL,注射速度为3~4 mL/s。使用造影剂团注技术进行动脉期扫描定时,即动脉期扫描在腹主动脉衰减系数达到120 Hounsfield单位7 s后自动启动,静脉期扫描在动脉期扫描后30 s获得。
采用Hexa 3D软件对胰腺进行半自动逐层冠状位和矢状位的三维重建,软件技术人员仅对CT图像负责,不参与后续体积分析。使用动脉期影像有助于区分器官边界,利用相同组织局部CT密度相同的原理,逐层标注胰腺组织的边界(见图1)。为了减少测量误差,重复测量3次后取平均值用于后续体积分析。

注: 绿线为胰腺边界,红线为动脉边界,逐层标记
1.6 观察指标
服药前最后一次CT检查的胰腺体积定义为基线(100%),胰腺体积减小>10%定义为胰腺萎缩。对患者进行总体疗效评估,观察索拉非尼治疗不良反应的发生情况及胰腺体积变化。
1.7 统计学方法
采用SPSS 22.0统计软件处理数据。非正态分布计量资料以中位数表示,计数资料以百分数表示。服药前后胰腺体积中位数的比较及发生和未发生HFSR的患者胰腺萎缩程度的比较采用Wilcoxon符号秩和检验。P<0.05为差异有统计学意义。
2 结 果
2.1 一般情况
本研究共纳入9例肝癌肝移植术后HCC复发接受索拉非尼治疗的患者。男性7例,女性2例;开始服用索拉非尼的中位年龄为44岁(35~65岁)。由于目前晚期HCC患者推荐综合治疗,因此部分患者在服用索拉非尼的同时接受全身静脉化疗、RFA或TACE,治疗前停用索拉非尼1 d,治疗后根据患者身体恢复情况(平均5 d)继续服用索拉非尼。4例患者为单个肿瘤复发,2例位于肝内,2例位于肝外(肺部),均手术切除;其余5例患者因多个复发病灶或无法手术切除,接受TACE、RFA及全身静脉化疗等治疗。截至2016年3月,中位随访时间35.8个月(26.5~52.8个月),日均索拉非尼剂量中位数为696 mg(607~772 mg),累积索拉非尼剂量中位数为720 g(552~1 224 g)。9例患者移植肝功能稳定,随访过程中未发生排斥反应,目前均带瘤生存,mRECIST评估均为疾病稳定。患者年龄、HCC复发/转移、治疗方案及疗效评估情况见表1。
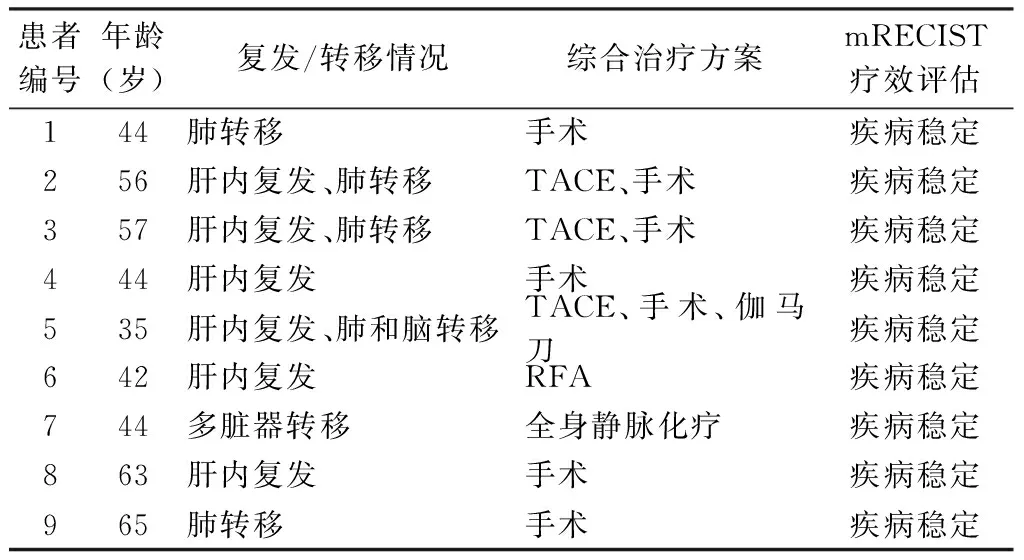
表1 9例肝癌肝移植术后HCC复发患者诊疗情况
注:HCC. 肝细胞肝癌; mRECIST. 实体肿瘤改良疗效评价标准; TACE. 经导管肝动脉化疗栓塞;RFA. 射频消融
2.2 索拉非尼不良反应的发生情况
腹泻和HFSR是索拉非尼治疗过程中常见的不良反应。1例患者未发生腹泻,发生腹泻且NCI CTCAE 4.0分级为1、2、3级的患者例数分别为4、3、1例,发生腹泻的中位时间为服药后2周(5~30 d)。6例患者未发生HFSR,3例发生HFSR的患者NCI CTCAE 4.0分级分别为1、2、3级,发生HFSR的中位时间为服药后3周(10~40 d)。另有患者出现高血压、脱发等,予调整药物剂量和对症治疗后均好转。9例患者中1例在服用索拉非尼前已诊断为糖尿病,口服降糖药物治疗。所有患者服药后每个月监测空腹血糖水平,2例出现新发的糖耐量异常,未出现新发糖尿病患者。
2.3 索拉非尼治疗后胰腺体积变化
9例患者服药前、后接受了共计32次胰腺体积CT检查。截至2016年1月,最后一次CT检查为服药后8.5~36.0个月。患者服药前和服药后最后一次CT检查的胰腺体积中位数分别为70.4 mL和59.2 mL,减少了16%,差异有统计学意义(Z=-2.55,P<0.05)。9例患者均出现了胰腺体积减少,首次发现胰腺萎缩的中位时间为服药后3个月(2~36个月)。患者胰腺体积减少程度与服用索拉非尼时间有一定关系,服药早期(服药后3个月内)即可出现胰腺体积减少,最严重的1例患者在索拉非尼治疗3个月时胰腺体积减少了29%,这种体积的变化可长期存在且多数不可逆。患者服药前、后胰腺三维重建示例见图2,可见胰腺头部体积显著减少。9例患者服药前、后胰腺体积变化趋势见图3。
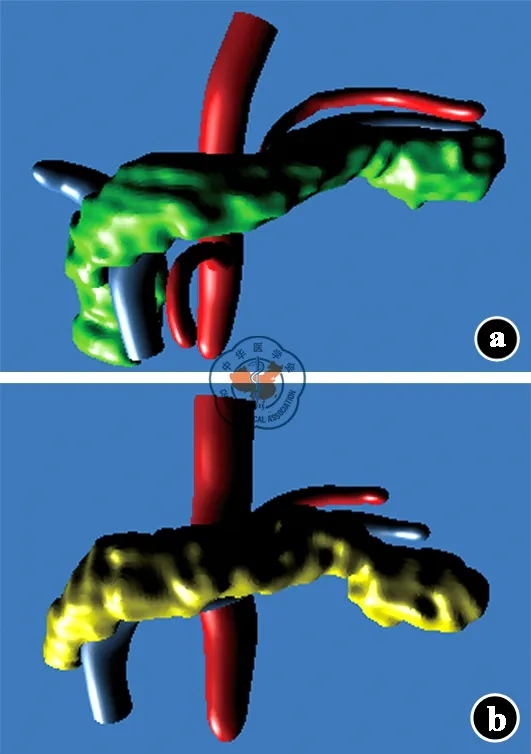
注: a. 治疗前;b. 治疗后;可见胰腺体积明显减少
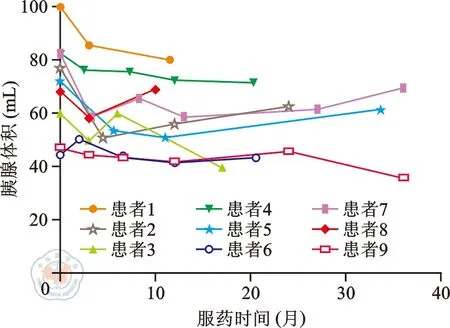
图3 9例肝癌肝移植术后复发患者索拉非尼治疗前、后胰腺体积变化
胰腺萎缩与腹泻的发生或NCI CTCAE4.0分级无关,但是胰腺体积减少与迟发HFSR有关。3例发生HFSR的患者和6例未发生HFSR的患者最后一次CT检查胰腺萎缩程度分别为24%和11%,差异有统计学意义(Z=-1.81,P<0.05)。此外,出现糖耐量异常的2例患者胰腺体积均减少20%以上。
3 讨 论
中国有大量因HCC等待肝移植的患者,对符合肝癌肝移植“杭州标准”的患者,肝移植已经成为有效的治疗方案,术后5年生存率可达65%;但对于那些超出杭州标准的患者,5年生存率甚至低于35%,HCC复发是影响患者生存的重要因素[18]。
索拉非尼是至今唯一被美国食品药品管理局批准适用于HCC患者的全身靶向药物[5-6]。一方面通过抑制RAF/MEK/ERK信号传导通路直接抑制肿瘤生长;另一方面通过抑制血管内皮细胞生长因子受体和血小板衍生生长因子受体从而阻断肿瘤新生血管的形成,间接抑制肿瘤细胞的生长[19]。目前研究认为,肝癌肝移植术后HCC复发的患者接受索拉非尼治疗同样可以生存获益[20]。
最近已有3篇文献报道称胰腺萎缩是索拉非尼长期治疗的不良反应[14, 21-22]。最早的相关研究发表于新英格兰医学杂志,2例HCC患者在接受索拉非尼治疗7个月和37个月后,胰腺体积分别减少了20%和35%,这2例患者服用索拉非尼累积剂量超过1 000 g,且治疗时间大于24个月[14]。德国学者对19例HCC患者的队列研究进一步证实了这一发现,18例患者在索拉非尼治疗后出现渐进性胰腺萎缩,大部分在服药3~4个月后即发现胰腺体积减小;尽管服药前患者胰腺体积差异较大,但索拉非尼引起的整个样本的胰腺体积减少仍有统计学意义;并且累积索拉非尼剂量小于100 g即可观察到胰腺相当程度的萎缩[21]。此外,该研究中胰腺体积与累积药物剂量、服药时间的相关系数分别为0.36和0.35,相关性较差,且半数患者在1年内死亡,胰腺体积长期的动态变化仍未明确。国内研究纳入31例 HCC患者,接受索拉非尼治疗时间超过2年,发现胰腺萎缩的患者肿瘤应答和总体生存率高于未发生胰腺萎缩的患者;但研究中CT检查时间点仅为服药后1年和2年,对于胰腺体积的动态变化研究则需要更多次数的CT检查[22]。
索拉非尼最常见的不良反应包括腹泻和HFSR。已有报道称胰腺外分泌功能不全可导致索拉非尼相关腹泻[23]。Hescot等[14]发现2例服用索拉非尼治疗HCC的患者出现脂肪泻,其中1例给予胰酶替代治疗成功。本研究中,我们发现肝癌肝移植术后HCC复发服用索拉菲尼治疗的患者发生腹泻的时间(中位时间为2周)早于胰腺体积减少,因此推测胰腺萎缩导致的外分泌功能不全与腹泻无关,但这可能是预防性使用盐酸洛哌丁胺引起的。此外,本研究结果还显示胰腺体积减少程度与迟发性HFSR有关,其可能的原因是迟发性HFSR患者不需要索拉非尼早期减量,故导致药物累积剂量更高而引起胰腺体积减少程度更严重。
本研究中2例出现糖耐量异常的患者胰腺体积均减少20%以上,提示胰腺内分泌功能可能受到影响;但是由于移植术后影响血糖水平的因素较多,故该结果还需要其他研究进一步明确。综合国内外研究,肝移植术后糖尿病发病率为10%~64%,术前基础疾病、肥胖、高龄和供者基因多态性等均是肝移植术后发生糖尿病的危险因素;术后长期接受免疫抑制治疗,糖皮质激素、钙调磷酸酶抑制剂等药物均可在不同程度上导致肝移植术后糖尿病的发生,或加重术前已存在的糖尿病[24-25]。
索拉非尼抗血管生成特性可使肿瘤组织和正常组织的微血管系统减少,导致胰腺[14, 21-22]、肌肉[26]和甲状腺[27]萎缩,也是常见不良反应(如腹泻和HFSR)发生的原因。因此,更多、更严重的抗血管生成不良反应可能意味着索拉非尼治疗中更强的抗肿瘤效应和更佳的生存获益。据相关文献报道,在服用索拉非尼治疗的HCC和肾细胞癌患者中,腹泻和/或早期HFSR[11, 28-30]的发生以及其他不良反应[31]的出现提示预后更佳。然而,德国学者研究中胰腺体积减少的程度与预后并无相关性[21]。结论不一致的原因可能是双方纳入患者的肝功能分级、病理分化和血管侵犯程度各有不同,这些因素均可影响患者预后[19];例如前者研究中患者均为巴塞罗那临床肝癌分期C期,而后者研究中有三分之一的患者为B期。
本研究并未探究患者生存时间和生存率,一方面是因为本研究的目的主要是观察胰腺体积动态变化,故纳入的是长期存活(>2年)的肝癌肝移植术后HCC复发患者,另一方面是因为此类患者除了接受索拉非尼治疗以外,部分患者同时接受TACE、RFA等综合治疗方案,对生存时间的影响因素较多,难以控制。但从另一个角度来说,这9例患者的诊疗经过从侧面证明,对于肝癌肝移植术后HCC复发,采取手术、TACE、RFA、索拉非尼等综合治疗方案仍有长期带瘤生存的希望。
本研究存在一定的局限性。为了使胰腺体积测量结果有更好的可比性,MRI检查数据未纳入本研究中。2例患者服药前CT检查时间大于3个月,利用服药前3个月内的MRI检查排除了服药前胰腺体积的显著变化。此外,本研究缺乏脂肪酶等胰腺外分泌功能和血清C肽等胰腺内分泌功能的检查数据,胰腺体积萎缩与其功能减退的关系仍未能明确,需要大型、前瞻性观察试验来阐明。
4 结 论
肝癌肝移植术后接受索拉非尼治疗肿瘤复发的患者可出现胰腺萎缩,胰腺萎缩与索拉非尼服药时间有一定关系。服药早期即可出现胰腺体积减少,最大可减少30%以上,这种体积变化可长期存在且多数不可逆。
1 Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016,66(2):115-132.
2 Davis E, Wiesner R, Valdecasas J, et al. Treatment of recurrent hepatocellular carcinoma after liver transplantation[J]. Liver Transpl, 2011,17 (Suppl 2):S162-S166.
3 Kim SH, Choi SB, Lee JG, et al. Prognostic factors and 10-year survival in patients with hepatocellular carcinoma after curative hepatectomy[J]. J Gastrointest Surg, 2011,15(4):598-607.
4 Fuks D, Dokmak S, Paradis V, et al. Benefit of initial resection of hepatocellular carcinoma followed by transplantation in case of recurrence: an intention-to-treat analysis[J]. Hepatology, 2012,55(1):132-140.
5 Llovet JM, Ricci S, Mazzaferro V, et al. Sorafenib in advanced hepatocellular carcinoma[J]. N Engl J Med, 2008,359(4):378-390.
6 Cheng AL, Kang YK, Chen Z, et al. Efficacy and safety of sorafenib in patients in the Asia-Pacific region with advanced hepatocellular carcinoma: a phase Ⅲ randomised, double-blind, placebo-controlled trial[J]. Lancet Oncol, 2009,10(1):25-34.
7 Sposito C, Mariani L, Germini A, et al. Comparative efficacy of sorafenib versus best supportive care in recurrent hepatocellular carcinoma after liver transplantation: a case-control study[J]. J Hepatol, 2013,59(1):59-66.
8 Gomez-Martin C, Bustamante J, Castroagudin JF, et al. Efficacy and safety of sorafenib in combination with mammalian target of rapamycin inhibitors for recurrent hepatocellular carcinoma after liver transplantation[J]. Liver Transpl, 2012,18(1):45-52.
9 Lee SH, Song IH, Noh R, et al. Clinical outcomes of patients with advanced hepatocellular carcinoma treated with sorafenib: a retrospective study of routine clinical practice in multi-institutions[J]. BMC Cancer, 2015,15:236.
10 Weinmann A, Niederle IM, Koch S, et al. Sorafenib for recurrence of hepatocellular carcinoma after liver transplantation[J]. Dig Liver Dis, 2012,44(5):432-437.
11 Vincenzi B, Santini D, Russo A, et al. Early skin toxicity as a predictive factor for tumor control in hepatocellular carcinoma patients treated with sorafenib[J]. Oncologist, 2010,15(1): 85-92.
12 Koschny R, Gotthardt D, Koehler C, et al. Diarrhea is a positive outcome predictor for sorafenib treatment of advanced hepatocellular carcinoma[J]. Oncology, 2013,84(1):6-13.
13 Bettinger D, Schultheiss M, Knuppel E, et al. Diarrhea predicts a positive response to sorafenib in patients with advanced hepatocellular carcinoma[J]. Hepatology, 2012,56(2):789-790.
14 Hescot S, Vignaux O, Goldwasser F. Pancreatic atrophy—a new late toxic effect of sorafenib[J]. N Engl J Med, 2013,369(15):1475-1476.
15 Bruix J, Sherman M; Practice Guidelines Committee, American Association for the Study of Liver Diseases. Management of hepatocellular carcinoma[J]. Hepatology, 2005,42(5):1208-1236.
16 Eisenhauer EA, Therasse P, Bogaerts J, et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1) [J]. Eur J Cancer, 2009,45(2):228-247.
17 National Institutes of Health, National Cancer Institute. Common Terminology Criteria for Adverse Events (CTCAE) version 4.03[EB/OL]. (2010-06-14)[2016-03-20]. http://evs.nci.nih.gov/ftp1/CTCAE/About.html.
18 Xu X, Lu D, Ling Q, et al. Liver transplantation for hepatocellular carcinoma beyond the Milan criteria[J]. Gut, 2015.
19 European Association for the Study of The Liver, European Organisation for Research and Treatment of Cancer. EASL-EORTC clinical practice guidelines: management of hepatocellular carcinoma[J]. J Hepatol, 2012,56(4):908-943.
20 Huang L, Li GM, Zhu JY, et al. Efficacy of sorafenib after liver transplantation in patients with primary hepatic carcinoma exceeding the Milan criteria: a preliminary study[J]. Onco Targets Ther, 2012,5:457-462.
21 Ganten MK, Schuessler M, Bruckner T, et al. Pancreatic atrophy in hepatocellular carcinoma patients receiving long-term treatment with Sorafenib[J]. Oncology, 2015,89(2):88-94.
22 Xu L, Zhou DS, Zhao J, et al. Long-term therapy with sorafenib is associated with pancreatic atrophy[J]. J Surg Res, 2015,199(2):314-321.
23 Mir O, Coriat R, Boudou-Rouquette P, et al. Sorafenib-induced diarrhea and hypophosphatemia: mechanisms and therapeutic implications[J]. Ann Oncol, 2012,23(1):280-281.
24 Parekh J, Corley DA, Feng S. Diabetes, hypertension and hyperlipidemia: prevalence over time and impact on long-term survival after liver transplantation[J]. Am J Transplant, 2012,12(8):2181-2187.
25 李新宇, 朱继业, 黄磊, 等. 肝移植术后代谢综合征及危险因素分析[J]. 中华普通外科杂志, 2012,27(1):8-11.
26 Antoun S, Birdsell L, Sawyer MB, et al. Association of skeletal muscle wasting with treatment with sorafenib in patients with advanced renal cell carcinoma: results from a placebo-controlled study[J]. J Clin Oncol, 2010,28(6):1054-1060.
27 van Doorn L, Eskens FA, Visser TJ, et al. Sorafenib induced thyroiditis in two patients with hepatocellular carcinoma[J]. Thyroid, 2011,21(2):197-202.
28 Yada M, Masumoto A, Motomura K, et al. Indicators of sorafenib efficacy in patients with advanced hepatocellular carcinoma[J]. World J Gastroenterol, 2014,20(35):12581-12587.
29 Cho JY, Paik YH, Lim HY, et al. Clinical parameters predictive of outcomes in sorafenib-treated patients with advanced hepatocellular carcinoma[J]. Liver Int, 2013,33(6):950-957.
30 Poprach A, Pavlik T, Melichar B, et al. Skin toxicity and efficacy of sunitinib and sorafenib in metastatic renal cell carcinoma: a national registry-based study[J]. Ann Oncol, 2012,23(12):3137-3143.
31 Song T, Zhang W, Wu Q, et al. A single center experience of sorafenib in advanced hepatocellular carcinoma patients: evaluation of prognostic factors[J]. Eur J Gastroenterol Hepatol, 2011,23(12):1233-1238.
(本文编辑:鲍夏茜)
庄莉, 钟海钢, 屠振华, 等. 肝癌肝移植术后索拉非尼治疗肿瘤复发与胰腺萎缩的关系[J/CD]. 中华移植杂志:电子版, 2016,10(2):60-65.
The relationship between tumor recurrence treated with sorafenib in patients with hepatocellular carcinoma after liver transplantation and pancreatic atrophy
ZhuangLi,ZhongHaigang,TuZhenhua,WangZhuoyi,ZhangMangli,ZhangMin,ZhengShusen.
DepartmentofHepatobiliaryandPancreaticSurgery,FirstAffiliatedHospital,SchoolofMedicine,ZhejiangUniversity,Hangzhou310003,China
ZhengShusen,Email:shusenzheng@zju.edu.cn
Objective To investigate the changing pattern of pancreatic volume and other adverse effects among a cohort of liver transplantation (LT) recipients with hepatocellular carcinoma (HCC) recurrence who were treated with sorafenib. Methods We retrospectively analyzed the clinical and radiological data of HCC recurrent patients after LT in the First Affiliated Hospital, Zhejiang University School of Medicine from January 2013 to December 2013 began with treatment of sorafenib and survived for more than 2 years. Sorafenib side effects were collected at every month interval and abdominal enhanced CT scan were performed before and under sorafenib treatment at multiple time points. Pancreas volumes were calculated through semi-manually segmented section by section in both coronal and sagittal reconstruction. Results Nine cases (7 males and 2 females) met inclusion criteria were enrolled. The median age was 46 years old (35-65 years old) when beginning sorafenib treatment. Up to March 2016, the median follow-up time was 35.8 months (26.5-50.8 months). The graft function was stable in all cases and no early or late rejection occurred during follow-up. All cases were survival with tumor and in the stable disease by mRECIST. Nine patients received 32 CT scans before and after sorafenib treatment and all of them had a pancreatic volume loss. The median time to detect the volume loss was 3 months (2-36 months) and the volume reduction can reach 29%. The median pancreatic volume before the onset of sorafenib was 70.4 mL while 59.2 mL at the last CT scan under sorafenib, resulting a significant volume reduction by 16% (Z=-2.55,P<0.05). The volume loss at the last CT scan in HFSR cases (24%,n=3) was significantly higher than no-HFSR cases (11%,n=6) (Z=-1.81,P<0.05). Conclusion The results confirmed pancreatic atrophy after sorafenib therapy in part of HCC recurrence patients post LT, while the variation pattern of pancreatic volume could correlate with sorafenib exposure time. The volume loss was detectable as early as after 3-month of sorafenib treatment and with the irreversible pancreatic volume for long-term.
Liver transplantation; Hepatocellular carcinoma; Sorafenib; Prancreatic atrophy
10.3877/cma.j.issn.1674-3903.2016.02.003
浙江省医药卫生科技项目一般项目(2016KYA073)
310003 杭州,浙江大学医学院附属第一医院肝胆胰外科
郑树森,Email:shusenzheng@zju.edu.cn
2016-03-20)
