儿童心脏死亡器官捐献供肝移植治疗儿童遗传代谢性肝病
2016-04-19蔡秋程杨芳张小进吕立志胡还章潘凡慕宁陈少华江艺
蔡秋程 杨芳 张小进 吕立志 胡还章 潘凡 慕宁 陈少华 江艺
·论著·
儿童心脏死亡器官捐献供肝移植治疗儿童遗传代谢性肝病
蔡秋程 杨芳 张小进 吕立志 胡还章 潘凡 慕宁 陈少华 江艺
目的 总结儿童心脏死亡器官捐献(DCD)供肝移植治疗儿童遗传代谢性肝病的经验。方法 回顾性分析2011年7月至2013年11月南京军区福州总医院肝胆外科完成的2例儿童DCD供肝移植临床资料。受者1为4岁2个月男童,诊断为肝糖原累积症继发肝功能不全、严重低血糖;供者1为3岁8个月男童,因严重病毒性脑炎致脑死亡继发心脏死亡行DCD。受者2为 12岁男童,诊断为肝豆状核变性继发肝硬化、脾功能亢进、上消化道出血;供者2为13岁男童,因颅内肿瘤致脑死亡继发心脏死亡行DCD。手术均采用经典原位肝移植术式,受者1和受者2供肝热缺血时间分别为6、10 min,冷缺血时间分别为180、360 min,术中留置胆汁引流管和经胃空肠造瘘管。术后密切监测生命体征和移植肝功能,术后1周内每天行床边彩色多普勒超声监测移植肝血流情况,同时给予抗感染、改善微循环及营养支持等处理,采用他克莫司+甲泼尼龙二联免疫抑制方案。结果 受者1和受者2手术时间分别为420、360 min,其中无肝期分别为55、50 min,术中出血量分别为400、300 mL。受者1术后6 h清醒并拔除气管插管,2 d血糖恢复正常,术后7 d移植肝功能恢复正常,术后18 d痊愈出院。受者2术后5 h拔除气管插管,术后12 d出现胆瘘,行经皮肝穿刺胆道引流+腹腔穿刺引流+经内镜逆行胰胆管造影内支架引流治愈,术后1个月出现肝动脉假性动脉瘤破裂出血,行肝动脉介入栓塞治疗,于移植术后2个月痊愈出院。结论 儿童DCD供肝是儿童肝移植的理想供肝来源,儿童DCD供肝移植治疗儿童遗传代谢性肝病效果确切;需要熟练、精细的显微外科操作技术预防术后并发症;积极引流和及时行动脉介入治疗是儿童肝移植术后胆瘘和肝动脉瘤破裂出血的有效治疗方法。
肝移植; 儿童; 代谢障碍; 心脏死亡器官捐献
儿童肝糖原累积症、肝豆状核变性等遗传代谢性疾病进展至终末期肝病时,肝移植是唯一有效的治疗方法。以往儿童肝移植供肝大多来源于亲属供肝或成人尸体供肝行劈离式肝移植,然而这两类肝移植手术技术难度大、风险高、术后并发症发生率高,严重影响儿童肝移植成功率和受者术后生存质量[1-2]。儿童心脏死亡器官捐献(donation after cardiac death, DCD)供肝避免了处理肝断面带来的技术难度和相关的术后并发症;且儿童供肝更符合儿童受者生长发育需要,是儿童肝移植的理想供肝来源。2011年7月至2013年11月,南京军区福州总医院肝胆外科完成2例儿童DCD供肝移植治疗儿童遗传代谢性肝病,现报道如下。
1 资料与方法
1.1 受者资料
(1)受者1 男童,4岁2个月,体质量15 kg,身高95 cm,血型为A型,Rh(+)。因“反复乏力、低血糖、生长迟缓3年”收治入我院。查体:消瘦,身高较同龄儿童明显矮小,腹部膨隆,肝脏重度增大。实验室检查:血糖1.7 mmol/L,ALT 112 U/L,AST 237 U/L,总胆红素6.4 mmol/L。肝穿刺活检:50%肝细胞弥漫性糖原沉积,50%肝细胞呈大泡性脂肪变性,肝小叶间纤维间隔形成(图1)。腹部CT示肝脏重度肿大并密度弥漫性减低,符合肝糖原异常沉积症;CT血管成像示肝脏血管未见明显异常(图2)。最终诊断为肝糖原累积症继发肝功能不全、严重低血糖。

注: 可见50%肝细胞呈大泡性脂肪变性,肝小叶间纤维间隔形成
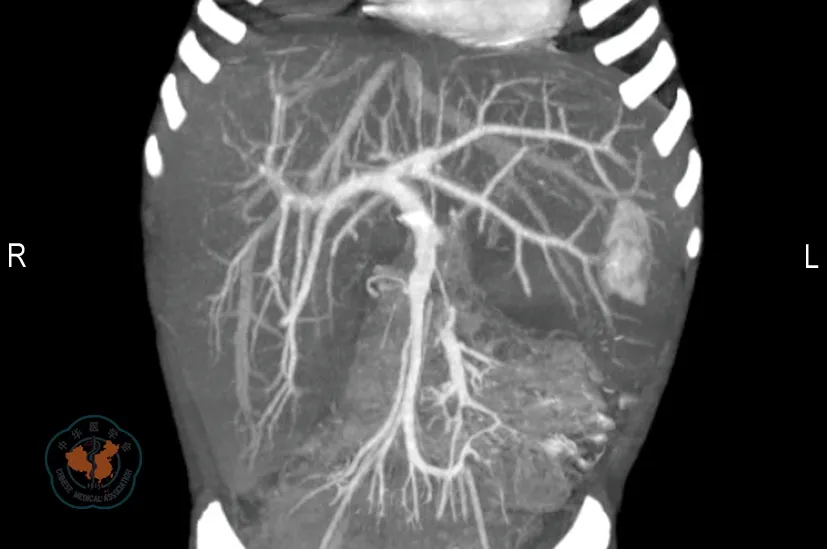
注: 肝脏重度肿大,肝实质密度弥漫性减低,血管未见明显异常
(2)受者2 男童,12岁,体质量30 kg。因“反复呕血、黑便1年余”入我院。查体:患儿生长发育迟缓,面色晦暗,脾肋下5 cm可触及,神经系统未见明显异常。实验室检查:红细胞计数1.89×109/L、血红蛋白106 g/L、血小板计数64×109/L;血清白蛋白38 U/L,ALT 87 U/L,AST 75 U/L,总胆红素26.5 μmol/L,碱性磷酸酶409 U/L,γ谷氨酰转肽酶102 U/L;HBV、EB病毒、CMV均为阴性,血清铜蓝蛋白在正常范围。腹部CT示:肝硬化伴门静脉高压(食道胃底静脉曲张)形成,脾肿大(图3)。诊断为上消化道出血、肝硬化、门脉高压症、脾功能亢进。
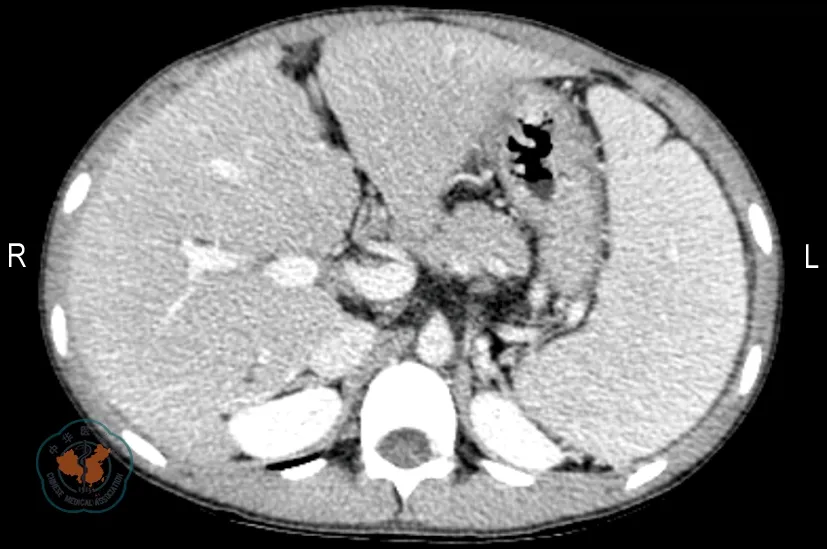
注: 可见肝硬化,门静脉增粗,食道胃底静脉曲张,脾重度肿大
1.2 供者资料
供者1:男童,3岁8个月,体质量16 kg,血型为O型,Rh(+);因严重病毒性脑炎致脑死亡。供者2:男童,13岁,体质量32 kg,血型为O型,Rh(+);因颅内肿瘤致脑死亡。依据《中国心脏死亡器官捐献工作指南》[3],并经福建省红十字会成功开展劝捐工作,亲属同意捐献器官,并签署了《心脏死亡自愿无偿器官捐献知情同意书》及相关文件。2例儿童供者均按DCD程序施行器官捐献。移植手术经我院伦理委员会审核批准。
2例供者分别于2011年7月2日、2013年11月5日实行可控型心脏死亡器官获取。供肝热缺血时间分别为6、10 min。获取的供肝质软,重量分别为582、960 g。受者1的供肝可见肝动脉变异,肝右后动脉发自肠系膜上动脉,门静脉、胆管、肝静脉解剖结构正常。受者2供肝血管解剖结构正常。供肝修整后置于4 ℃ UW液中保存,受者1和受者2的供肝冷缺血时间分别为180、360 min。
1.3 手术方法
2例儿童受者均采用经典原位肝移植术式。术中见受者1肝脏明显增大(28 cm×17cm×8 cm),占据腹腔3/4空间,呈重度脂肪肝外观(图4);分离肝动脉发现存在变异,其肝右后动脉来源于肠系膜上动脉。术中见受者2肝脏萎缩(17 cm×13 cm×8 cm),表面呈结节状(图5),脾脏重度增大,肝脏血管解剖结构正常。
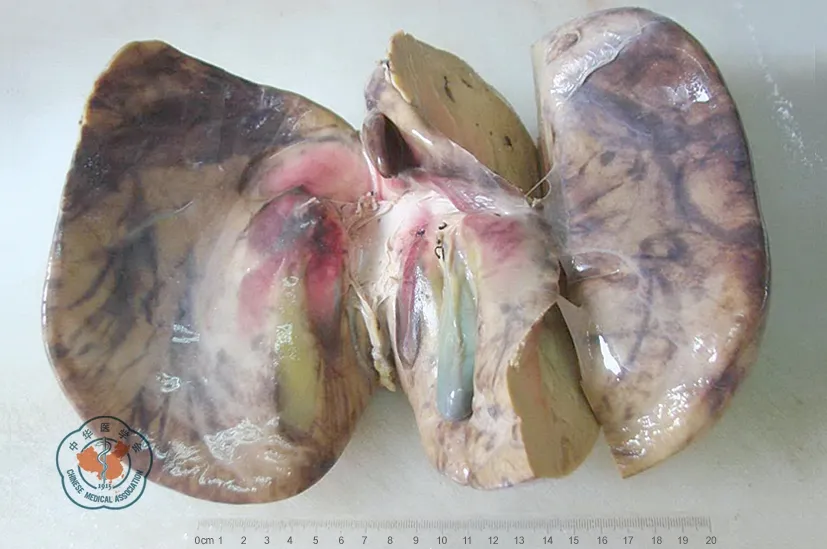
注: 可见肝脏呈重度脂肪肝外观,表面光滑,边缘圆钝,切面呈灰黄色
肝上下腔静脉、肝下下腔静脉用5-0普理灵线行端端吻合,供、受者门静脉用5-0普理灵线行端端吻合,供、受者胆总管用6-0普迪斯线行端端吻合,留置胆汁引流管和经胃空肠造瘘管。肝动脉吻合在2.5倍放大镜下进行,供肝腹腔动脉干与受者肝动脉和胃十二指肠动脉汇合处用8-0普理灵线连续缝合;受者1变异的肝右后动脉与其供肝变异的肝右后动脉用9-0普理灵线间断缝合。受者1肝移植术中动脉重建见图6。
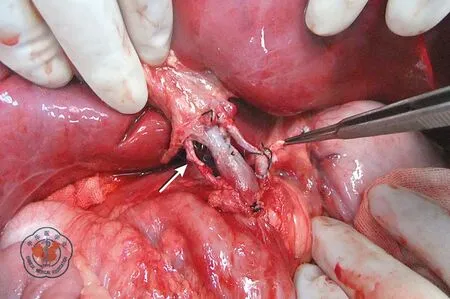
注: 箭头处为术中变异的肝右动脉,动脉开放后博动良好
1.4 术后监护
术后监测儿童受者生命体征、肝功能及出、凝血情况。采用他克莫司+甲泼尼龙二联免疫抑制方案。术后1周内每天行床边彩色多普勒超声监测移植肝血流情况。给予第3代头孢菌素类抗生素预防感染,前列地尔+低分子右旋糖酐抗凝治疗;维持水、电解质及酸碱平衡;给予营养支持,术后第2天经胃空肠造瘘管行肠内营养及给药,术后第5天过渡为经口饮食。
2 结 果
2例受者肝移植手术均成功,手术时间分别为420、360 min,其中无肝期分别为55、50 min,术中出血量分别为400、300 mL。
受者1术后6 h清醒并拔除气管插管,术后2 d血糖即恢复正常,术后7 d下床活动,移植肝功能恢复正常,术后2~9 d监测血糖波动于3.9~6.3 mmol/L,术后18 d痊愈出院。于术后1个月后开始出现明显生长追赶,术后4个月拔除胆汁引流管和胃空肠造瘘管,术后6个月开始参加幼儿园学习。术后6个月停用糖皮质激素,他克莫司血药浓度谷值控制在3~5 μg/L。随访至2016年3月,已健康生活56个月,身高增长42 cm,体质量增加25 kg,随访期间血糖、移植肝功能均正常。
受者2术后病肝组织电镜检查示:肝细胞内见铜沉积,考虑肝豆状核变性。术后12 d发现胆瘘,行经皮肝穿刺胆道引流+腹腔穿刺引流+经内镜逆行胰胆管造影内支架引流(图7),1个月后治愈。肝移植术后1个月出现肝动脉假性动脉瘤破裂出血,行肝动脉造影示移植肝脾动脉残端破裂出血,行弹簧圈栓塞治疗(图8)。于治疗后3 d再次出现腹腔出血,行第2次肝动脉造影示弹簧圈栓塞处出血,再次用一小弹簧圈栓塞及生物胶填塞加固(图9),后未再出现腹腔出血,于移植后2个月痊愈出院,出院时移植肝功能良好。随访至2016年3月,已健康生活29个月,现采用他克莫司+吗替麦考酚酯二联免疫抑制方案,他克莫司血药浓度谷值波动在3~5 μg/L,随访期间移植肝功能正常,未再出现腹腔出血。
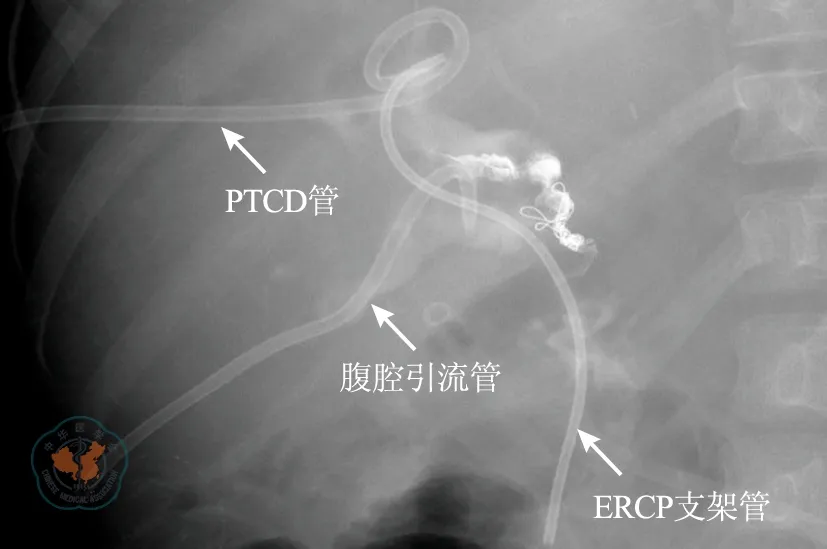
注: PTCD. 经皮肝穿刺胆道引流;ERCP. 经内镜逆行胰胆管造影

注: a. 肝固有动脉近吻合处见一瘤样突起,大小约为3.27 cm×2.14 cm;b. 行弹簧圈栓塞后,假性动脉瘤未见显影
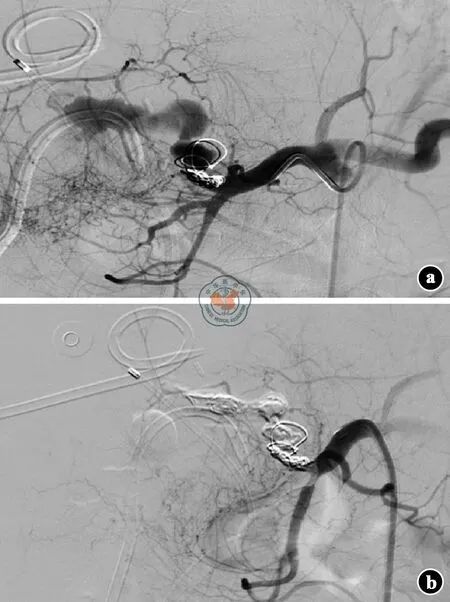
注: a. 肝固有动脉及原假性动脉瘤腔内见高密度弹簧圈影,造影剂溢出;b. 再次行弹簧圈+生物胶栓塞后假性动脉瘤未见显影
3 讨 论
肝移植可以在功能上治疗一些由遗传缺陷所致的代谢性疾病。儿童遗传代谢性疾病已成为儿童肝移植的第二大适应证[4-5]。
肝糖原累积症为一种较少见的婴幼儿先天性隐性遗传性糖原代谢紊乱性疾病,发病率约为1/50 000~1/100 000[6],主要病因为肝内葡萄糖-6-磷酸酶缺乏,导致糖原分解或合成障碍,从而产生肝脏内糖原过多累积。临床主要表现为严重低血糖,患儿生长迟缓,肝脏重度肿大,严重者可发展为肝功能失代偿。治疗上一般采用高蛋白、高葡萄糖、多餐饮食,主要目的是将血糖控制在正常水平[7]。肝移植可以从病因上完全治愈该疾病,尤其对于重症肝功能失代偿患者,肝移植是唯一有效的治疗方法[8]。本研究儿童受者1肝移植术后第2天血糖即恢复正常,迅速出现生长发育追赶,短期内即达到同龄儿童的生长发育水平,恢复正常学习生活,生活质量明显提高,随访期间血糖正常、肝功能良好。
肝豆状核变性是一种常染色体遗传性铜代谢异常疾病,主要病因为肝脏不能排铜导致铜在肝脏、中枢神经系统、眼和肾脏中蓄积,发病率约为1/30 000[9-10],多数患者在青年时期即进展为肝功能衰竭而威胁生命。肝移植不仅是肝豆状核变性患儿病情进展至终末期肝病时唯一的治疗方法,并且从根本上解决了肝脏排铜的问题。Stuclife等[11]对24例因肝豆状核变性行肝移植的受者进行长期随访,发现术后受者铜代谢指标恢复正常,神经系统症状减轻甚至消失,5年生存率达87.5%。国内张峰等[12]临床观察数据显示,肝豆状核变性患者行亲属活体肝移植术后1年生存率达93.3%。
目前,儿童肝移植主要为成人活体肝移植及成人尸体供肝的劈离式肝移植。成人活体肝移植需要切除健康成年人供者的部份肝脏,技术难度较高,供者有巨大手术风险和术后出现严重并发症甚至死亡的风险。劈离式肝移植同样存在技术难度高的特点,修整供肝可能损害重要的解剖结构从而影响供肝质量,对肝断面的处理增加了术后发生出血、胆瘘等严重并发症的风险,从而影响儿童受者生存率。因此,有必要寻找更合适的儿童肝移植供肝来源。
在严格控制热缺血和冷缺血时间的情况下,儿童DCD供肝可以成为儿童肝移植供肝来源。此外,根据肝移植供肝/受者体质量比≥1%即可满足受者需要[13],儿童DCD供肝在一定条件下可以用于较小体质量的成人受者,从而拓展儿童DCD供肝的使用范围。儿童供肝体积与儿童受者匹配更合理,同时避免成人活体肝移植及劈离式肝移植中处理肝断面可能带来的严重并发症等问题。儿童间肝移植更符合儿童生长发育需要,同时由于供、受者免疫系统均处于未成熟阶段,移植术后随着时间的延长,有可能发展为嵌合状态;受者只需服用较小剂量免疫抑制剂即可以有效控制排斥反应,甚至部分儿童受者后期可以考虑停用免疫抑制剂[14-15]。本研究中儿童受者1移植6个月后单用他克莫司,且血药浓度在较低水平即可有效抗排斥反应,随访期间肝功能良好,后期我们考虑停用免疫抑制剂。
儿童供肝血管和胆管细小、壁薄,管道重建时容易造成组织撕裂且后期易发生管腔狭窄,尤其存在先天变异时,移植术后肝动脉或静脉血栓形成、胆瘘等发生率高,因此对显微外科技术及围手术期管理有较高要求。本研究中儿童受者1及其供肝均存在肝动脉变异,肝右后动脉均发自肠系膜上动脉,血管纤细,变异肝右后动脉管径只有2 mm;我们安排一位医师专门进行肝动脉重建,在2.5倍放大镜下行间断缝合,术后加强床边彩色多普勒超声监测移植肝血流,根据该例儿童受者凝血状况加强抗凝治疗;受者术后恢复良好,未发生动、静脉狭窄或血栓形成等并发症。儿童受者2胆管纤细,并有明显纤维化改变,移植术中采用胆管端端吻合,术后12 d出现胆瘘,考虑与受者胆管纤细、引流不畅致胆道压力高有关。通过对此例患儿的诊治,我们的体会是:如果受者胆管本身有病变、管腔细,术中判断胆管端端吻合不满意时,不能勉强吻合,可以采用胆肠吻合,以减少术后胆道并发症的发生率。
针对肝移植术后胆瘘的治疗,理想的方法为多个角度置管引流,受者2采用经皮肝穿刺胆道引流+腹腔穿刺引流+经内镜逆行胰胆管造影内置管引流,效果良好。由于胆汁具有腐蚀作用,胆瘘最大的风险在于血管受腐蚀破裂出血,往往为动脉出血且量大,如处理不及时,短时间内可危及生命。受者2于胆瘘后2周出现肝动脉出血,由于刚经历肝移植,再次手术难度大、风险高,最佳方法是对出血的残端行肝动脉介入弹簧圈栓塞。值得注意的是,介入术中由于导丝及造影剂的刺激,肝动脉处于收缩状态,往往造成已栓塞止血的假象,待动脉扩张以后又会再次出现出血,因此弹簧圈栓塞应尽量填紧。我们的经验为联合应用生物胶加固,同时观察时间足够长,确保止血效果。
由于儿童受者依从性差,术后难以有效表达主诉及正常服药。我们在术中放置胆汁引流管和经胃空肠造瘘管,一方面通过每天观察引流胆汁情况,一定程度上可以判断移植肝功能;另一方面,通过胃空肠造瘘管可以早期进行肠内营养,有利于保护肠黏膜屏障功能,同时可以经胃空肠造瘘管给药,有效地解决了受者依从性差等问题。
综上所述,儿童DCD供肝是儿童肝移植的理想供肝来源,儿童DCD供肝移植治疗儿童遗传代谢性肝病效果确切。儿童DCD供肝及儿童受者本身由于解剖结构纤细,需要更熟练、更精细的显微外科操作技术以预防术后并发症。积极引流和及时行动脉介入治疗是治疗儿童DCD供肝移植后胆瘘和肝动脉瘤破裂出血的有效方法。
1 朱志军, 曾志贵. 儿童肝移植术后早期血管并发症的诊断、治疗及预防[J]. 中国普外基础与临床杂志, 2015,22(12):1425-1427.
2 Yagi S, Uemoto S. Small-for-size syndrome in living donor liver transplantation[J]. Hepatobiliary Pancreat Dis Int, 2012,11(6):570-576.
3 中华医学会器官移植学分会. 中国心脏死亡器官捐献工作指南(第2版)[J/CD]. 中华移植杂志:电子版, 2012,6(3):221-224.
4 李姗霓, 马楠, 孙超, 等. 儿童肝移植的主要适应证[J]. 实用器官移植电子杂志, 2014,9(5):310-316.
5 郭源, 臧运金. 公民逝世后器官捐献供肝肝移植:我国儿童肝移植的新出路[J]. 器官移植, 2016,7(2):85-88.
6 胡亚美, 江载芳. 诸福棠实用儿科学[M]. 7版. 北京:人民卫生出版社, 2002:2125-2133.
7 Ausems MG, Verbiest J, Hermans MP, et al. Frequency of glycogen storage disease type Ⅱ in the Netherlands: implications for diagnosis and genetic counselling[J]. Eur J Hum Genet, 1999,7 (6):713-716.
8 Starzl TE, Demetris AJ, Trucco M, et al. Chimerism after liver transplantation for type Ⅳ glycogen storage disease and type Ⅰ Gaucher′s disease[J]. N Engl J Med, 1993,328(11):745-749.
9 Weiss KH, Stremmel W. Evolving perspectives in Wilson disease: diagnosis, treatment and monitoring[J]. Curr Gastroenterol Rep, 2012,14(1):1-7.
10 Catana AM, Medici V. Liver transplantation for Wilson disease[J]. World J Hepatol, 2012,4(1):5-10.
11 Stuclife RP, Maguire DD, Muiesan P, et al. Liver transplantation for Wilson’s disease: long term results and quality-of-life assessment[J]. Transplantation, 2003,75(7):1003-1006.
12 张峰, 王学皓, 李相成, 等. 亲体部分肝移植治疗Wilson病 20例报告[J]. 中华普通外科杂志, 2004,19(18):459-460.
13 Kiuchi T, Kasahara M, Uryuhara K, et al. Impact of graft size mismatching on graft prognosis in liver transplantation from living donors[J]. Transplantation, 1999,67(2):321-327.
14 Bartlett A, Vara R, Muiesan P, et al. A single center experience of donation after cardiac death liver transplantation in pediatric recipients[J]. Pediatr Transplant, 2010,14(3):388-392.
15 时军, 罗文峰, 丁利民, 等. 脑死亡儿童供肝成人移植临床分析[J]. 中华肝胆外科杂志, 2011,17(5):359-362.
(本文编辑:鲍夏茜)
蔡秋程, 杨芳, 张小进, 等. 儿童心脏死亡器官捐献供肝移植治疗儿童遗传代谢性肝病[J/CD]. 中华移植杂志:电子版, 2016,10(2):71-75,91.
Liver transplantation for children with congenital metabolic diseases using pediatric donation after cardiac death grafts
CaiQiucheng,YangFang,ZhangXiaojin,LyuLizhi,HuHuanzhang,PanFan,MuNing,ChenShaohua,JiangYi.
MilitaryinstituteofOrganTransplantation,CentreofHepatobiliarySurgery,FuzhouGeneralHospitalofNanjingMilitaryCommand,Fuzhou350025,China
JiangYi,Email:jiangyi8183@163.com
Objective To summary the experience of liver transplantation with liver grafts from pediatric donation after cardiac death (DCD) in treatment of children with congenital metabolic liver diseases. Methods The clinical date of two cases of DCD liver transplantation in Centre of Hepatobiliary Surgery, Fuzhou General Hospital between 2011 and 2013 years was retrospectively analyzed. Case 1: the recipient was a 4 years and 2 months old boy, diagnosed as glycogen storage disease secondary to liver dysfunction, severe hypoglycemia; the donor was a 3 years and 8 months old boy; DCD was performed after brain death caused by severe viral encephalitis. Case 2: the recipient was a 12-year-old boy, diagnosed as Wilson disease secondary to liver cirrhosis, hypersplenism, and upper gastrointestinal hemorrhage; the donor was a 13-year-old boy; DCD was performed after brain death caused by intracranial tumor. The surgical was classically orthotopic liver transplantation, the warm ischemia time of the two liver grafts were 6 and 10 minutes, respectively; the cold ischemia time were 180 and 360 minutes, respectively. The vital signs and liver grafts function were monitored after operation, and the bedside color ultrasonic instrument was used to monitor blood flow of liver grafts everyday during the first week after surgery. The recipients were given treatments of anti-infection, improving microcirculation and nutritional support. The immunosuppressive regimens were tacrolimus and prednisone. Results The operation time of the recipients were 420 and 360 minutes; the anhepatic phase was 55 and 50 minutes; and the blood loss was 400 and 300 mL, respectively. Case 1: the endotracheal intubation was removed at 6 hours of postoperative; the blood sugar became normal on 2 days after surgery; the liver function returned to normal and the recipient began to get out of bed on 7 days after surgery, and discharged on 18 days after surgery. Case 2: the endotracheal intubation was removed at 5 hours of postoperative; 12 days after surgery, biliary fistula was occurred, and cured by the combination of percutaneous transhepatic cholangical drainage, abdominal puncture and drainage and endoscopic retrograde cholangiopancreatography. Hepatic artery pseudoaneurysm ruptured out on one month postoperative, and cured by hepatic artery embolization. The child was discharged two months after transplantation. Conclusions The pediatric DCD liver is an ideal graft for pediatric liver transplantation. Liver transplantation is a good way to treat children with congenital metabolic liver disease. We should have more skilled and careful surgical technique to prevent postoperative complications. Active drainage and timely artery intervention were effective ways to treat the biliary fistula and hepatic aneurysm rupture after liver transplantation.
Liver transplantation; Child; Metabolic diseases; Donation after cardiac death
10.3877/cma.j.issn.1674-3903.2016.02.005
福建省自然科学基金重点项目(2015Y0026);福建省科技计划项目(2016J01585)
350025 福州,全军器官移植研究所 南京军区福州总医院肝胆外科
江艺, Email: jiangyi8183@163.com
2016-03-09
