大鼠肾脏皮质中分离出新型间质细胞
——特络细胞
2016-04-19黎力平林淼李龙郑龙朱同玉
黎力平 林淼 李龙 郑龙 朱同玉
·论著·
大鼠肾脏皮质中分离出新型间质细胞
——特络细胞
黎力平1, 2林淼3李龙1, 2郑龙1, 2朱同玉1, 2
目的 分析SD大鼠肾脏皮质中特络细胞(TC)的形态学及分子生物学特征。方法 手术获取4周雄性SD大鼠肾脏皮质,使用二型胶原酶等消化酶获取细胞,利用显微切割的方法分离纯化并原代培养TC。利用相差显微镜观察并鉴定原代培养的TC。免疫荧光检测TC、成纤维细胞及间充质干细胞(MSC)中CD34、CD117、CD63、Ⅳ型胶原蛋白及层黏连蛋白(LN)的表达情况。利用透射电子显微镜(TEM)观察TC形态学特征。结果 肾脏皮质中能分离出TC,且可以体外原代培养,其形态学特征与其他器官中发现的TC相似。免疫荧光检测结果发现TC表达CD117、CD34及CD63 3种细胞表面分子,以及肾小管和肾小球基底膜的主要成分Ⅳ型胶原蛋白及LN,明显与成纤维细胞及MSC不同。TEM检测结果发现,TC位于肾脏皮质的间质区域、肾小管及血管周围。结论 大鼠肾脏皮质存在TC,由于其表达CD117、CD34、CD63、Ⅳ型胶原蛋白及LN,提示其可能在促进基底膜再生及肾脏损伤修复过程中发挥功能。
特络细胞; 成纤维细胞; 间充质干细胞; 大鼠; 肾脏皮质
1899年,西班牙神经解剖学家卡扎尔在人体胃肠道中首次发现了一种被称为“间质神经元”的特殊细胞——卡扎尔细胞[1]。这种细胞被认为是胃肠道起搏器,能够影响胃肠道活动及神经传递[2-3]。Popescu研究团队发现了一种与卡扎尔细胞形态十分相似的间质细胞也存在于消化道以外的空腔器官,当时这种间质细胞被命名为卡扎尔样间质细胞(interstitial Cajal-like cell,ICLC)[4-5]。但进一步研究表明,ICLC与卡扎尔细胞存在明显差异,仅形态学特征就可将ICLC与其他间质细胞区分开来,因此,Popescu等人[6]认为ICLC可能是一种新型间质细胞。
根据前期关于ICLC的研究结果,Pospesu等[6]于2010年首次提出并命名了一种特殊类型的间质细胞——特络细胞(telocyte,TC);这些间质细胞拥有非常细长的细胞延伸部分(telopod,Tp),该部分由膨大节段及细长节段交替组成。后续研究进一步阐明了其特征:TC胞体中胞浆含量较少,膨大部分中富含线粒体,细胞间联系紧密。目前,TC已被证实存在于多种器官和组织中,包括心脏、肺血管、肠道、肠系膜、胆囊、子宫、输卵管、胸膜、骨骼肌、胰腺外分泌部、乳腺以及胎盘[7-20]。
肾脏间质可以影响肾脏功能[21-23],细胞与急性间质性肾炎、慢性移植物排斥反应及缺血再灌注损伤等也有密切联系[24-27]。传统理论认为,成纤维细胞及免疫细胞是肾脏间质中的主要细胞[28]。但传统概念中的肾脏间质成纤维细胞间存在极大的形态差异,部分细胞与TC形态有一定的相似性,因此将这些细胞笼统地全部称为成纤维细胞并不合适。本研究通过原代分离培养、免疫荧光、透射电子显微镜(transmission electron microscope,TEM)等方法分离、鉴定SD大鼠肾脏中的TC,根据表面标志物比较其与成纤维细胞和间充质干细胞(mesenchymal stem cell,MSC)的区别,推测其潜在的功能。
1 材料与方法
1.1 细胞培养
MSC及肾成纤维细胞均购自广州赛业生物科技有限公司,MSC培养于含10%胎牛血清的DMEM/F12培养基(美国Gibco公司),肾成纤维细胞培养于含10%胎牛血清的DMEM高糖培养基(美国Gibco公司),置于37 ℃、5%CO2细胞培养箱培养。
1.2 分离纯化及原代培养TC
4周雄性SD大鼠购自复旦大学附属中山医院实验动物中心,所有动物的使用均通过实验动物中心伦理审批。动物等级为SPF级。无菌条件下获取大鼠肾脏皮质,使用无菌剪刀将组织剪成约1 mm×1 mm×1 mm的块状,PBS(美国Gibco公司)清洗3次。消化液为使用不含钙离子及镁离子的PBS配置的10 mg/mL二型胶原酶(美国Sigma公司)及2 000 U/mL DNA酶(美国Sigma公司)。组织置于37 ℃振荡器中消化4 h。收集的细胞悬液1 500转离心5 min,移至40 μm细胞过滤器(美国BD Falcon公司)中过滤。细胞接种于10%胎牛血清的DMEM/F12培养基,置于37 ℃、5%CO2细胞培养箱培养。使用相差显微镜(IX51-DPT2-CCD,日本奥林巴斯公司)观察细胞生长。原代细胞及早期几代细胞中,杂细胞(如肾小管上皮细胞及成纤维细胞)数量较多,可使用显微切割方法去除。具体方法:TC成簇生长后,于相差显微镜下利用细胞刮刀刮除杂细胞,弃去上层杂细胞悬浮液,PBS冲洗,重复数次直至镜下观察效果满意,而后行细胞传代。
1.3 细胞免疫荧光
取大鼠原代TC、肾成纤维细胞及MSC,分别接种于放有无菌盖玻片的24孔板,每孔接种约1×104个细胞,2~3 d后用PBS清洗3次,每次5 min;-20 ℃预冷甲醇固定20 min,PBS清洗3次,每次5 min;10%胎牛血清白蛋白(美国Gibco公司)室温封闭1 h,滴加200 μL羊抗大鼠CD34一抗(1/300,美国R&D公司),4 ℃孵育过夜,PBS清洗3次,每次5 min;然后加200 μL 异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记的兔抗羊二抗(1/ 200,美国Jackson公司),室温避光孵育1 h,PBS清洗3次,每次5 min;最后用DAPI染核,室温避光孵育15 min。同时,设立不加一抗的阴性对照,剩余步骤同前,荧光显微镜(IX51-DPT2-CCD,日本奥林巴斯公司)下观察。
检测CD117表达时使用的一抗为兔抗大鼠CD117(1/300,美国Novus公司),二抗为Fitc标记的羊抗兔二抗(1/ 200,美国Jackson公司);检测Ⅳ型胶原蛋白表达时使用的一抗为兔抗大鼠Ⅳ型胶原蛋白一抗(1/300,美国R&D公司),二抗为FITC标记的羊抗兔二抗(1/200,美国Jackson公司);检测层黏连蛋白(laminin,LN)表达时使用的一抗为兔抗大鼠LN一抗(1/300,美国R&D公司),二抗为FITC标记的羊抗兔二抗(1/ 200;美国Jackson公司);检测CD63表达时使用的一抗为兔抗大鼠CD63一抗(1/100,美国Santa Cruz公司),二抗为FITC标记的羊抗兔二抗(1/200,美国Jackson公司)。
1.4 TEM
获取SD大鼠肾脏标本,使用0.1 mol/L的PBS(pH为7.2)配置的2.5%谷氨酰胺固定,而后使用1.0%锇酸(美国Polysciences公司)固定1 h。去离子水冲洗标本,乙醇梯度脱水(30%、50%、70%、85%、90%乙醇各1次,100%乙醇2次)后使用Eponate 812环氧树脂包埋(瑞典Ted Pella公司),梯度升温烘干。使用超微显微镜薄片切片机(LKB-Ⅱ,德国Leica Microsystems公司)切取组织,厚度为50 nm,3%醋酸铀和柠檬酸铅染色。TEM(飞利浦CM120型)观察,数码相机获取图片。
2 结 果
2.1 TC原代培养
在相差显微镜下能观察到富含细长念珠状突起的纺锤形细胞,与TC的形态标准相符合(见图1)。一个典型的TC有1个Tp,该Tp中含有多个细长部分和膨大部分;另一个TC有多个Tp。TC呈纺锤形,随着细胞密度的增加,细胞的突起也更多。
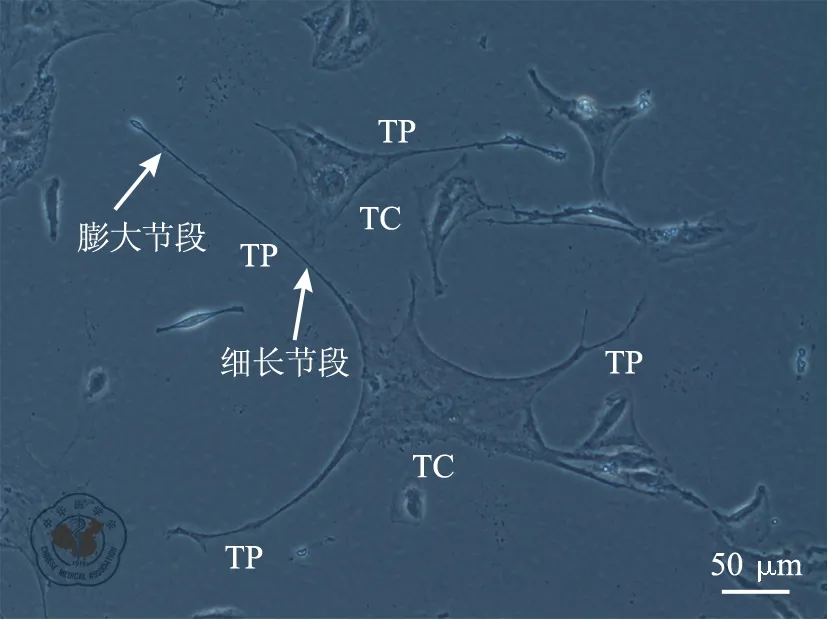
注: TC. 特络细胞;Tp. 细胞延伸部分; 图中可见数个TC,其中一个TC有1个Tp;另一个TC有多个Tp,并与其他TC有联系
2.2 TC表面标志物
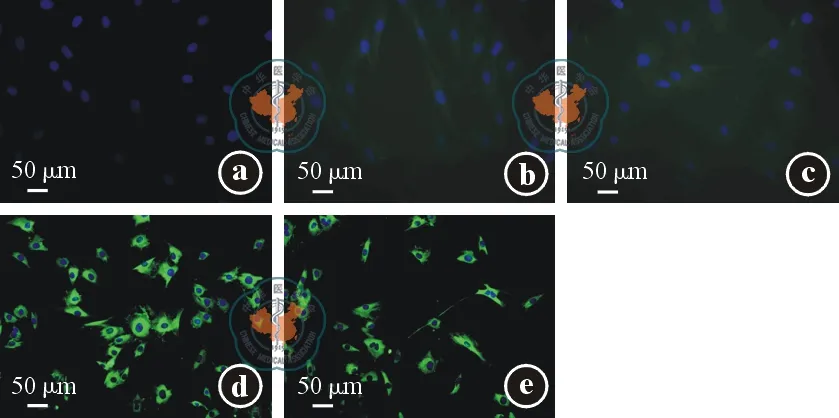
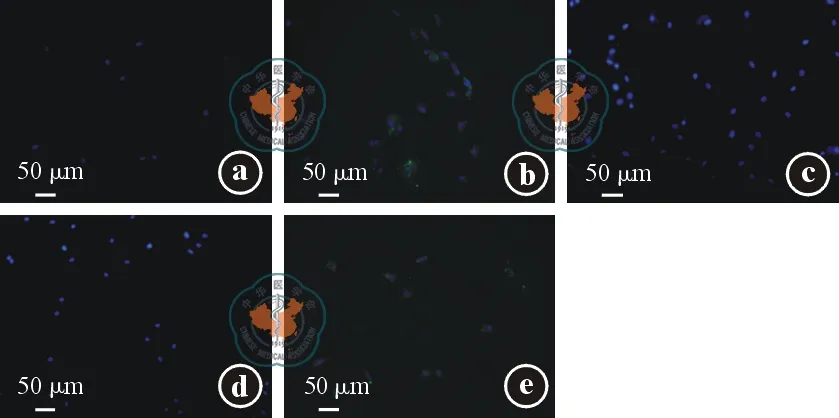
我们利用细胞免疫荧光检测CD117、CD34及CD63 3种细胞表面分子和肾小管、肾小球基底膜主要成分Ⅳ型胶原蛋白及LN的表达。检测结果发现,原代培养的TC表达CD34、CD117及CD63,高表达Ⅳ型胶原蛋白及LN(见图2)。MSC不表达CD34,低表达CD117及CD63,高表达Ⅳ型胶原蛋白及LN;肾成纤维细胞不表达CD34、LN及CD63,表达CD117及Ⅳ型胶原蛋白(见图3~4)。

注: 原代培养的特络细胞表达CD34(图2a)、CD117(图2b)及CD63(图2c),高表达层黏连蛋白(图2d)及Ⅳ型胶原蛋白(图2e)
注: 间充质干细胞不表达CD34(图3a),低表达CD117(图3b)及CD63(图3c),高表达层黏连蛋白(图3d)及Ⅳ型胶原蛋白(图3e)
注: 成纤维细胞不表达CD34(图4a)、CD63(图4c)及层黏连蛋白(图4d),低表达CD117(图4b)及IV型胶原蛋白(图4e)
2.3 定位肾脏TC并分析其形态特征
我们使用TEM定位肾脏标本中TC,分析其在体形态学特征。发现TC位于肾小管及血管的周围,以其非常细长且弯曲Tp包绕内皮细胞或基底膜,其细长节段及膨大节段结构清晰可见(见图5)。同时发现TC在活体中不止存在1个Tp,TC的形态与Tp的数量有关。

注: 可见典型的特络细胞(TC),其有特征性的细胞延伸部分(Tp)、膨大节段及细长节段(图5a);TC位于肾小管及血管的周围,可见到肾小管基底膜(BM)、内皮细胞(E)、线粒体(m)及红细胞(RBC)(图5b)
3 讨 论
研究证实多种器官与组织中都存在TC,这些研究分别利用细胞培养、免疫荧光及TEM等方法分离和鉴定TC[7-20]。目前TC的公认特征如下:(1)位于肾小管外的间质部位;(2)胞体呈纺锤形、梭形或多角边形;(3)富含Tp,Tp能产生分枝并与周围细胞及组织形成广泛联系;(4)膨大节段及核周胞浆中富含线粒体;(5)细胞表面标志物CD117及CD34阳性。
本研究分离鉴定的细胞均具有以上特征。细胞培养、TEM均提示TC位于肾脏皮质的间质区域。细胞原代培养中能观察到形态典型的TC。免疫荧光检测结果显示其表达CD34及CD117,与MSC及肾成纤维细胞有明显区别。TEM发现TC多存在于血管及肾小管周围并以Tp包绕基底膜。因此,形态特征及细胞表面标志物可以证明在肾脏皮质中发现的新型间质细胞是TC。
虽然在多种器官及组织中已证实TC的存在,但关于其具体功能的研究仍比较缺乏。有研究发现,在心脏缺血再灌注损伤的体外实验中,心脏干细胞及TC共培养能促进心脏干细胞的增殖,相似结果在骨骼肌再生的实验中也得到证实[29-30]。Manole等[31]通过建立大鼠急性心梗死模型发现,TC会在新生的血管周围聚集,免疫组织化学法证实其能通过旁分泌的方式分泌血管内皮生长因子或一氧化氮合酶,促进血管再生,此外还发现TC表达多种血管再生相关微RNA。另有研究证实,于心脏缺血30 min 内行TC回输能减少心肌梗死面积、改善心脏功能[32]。有学者将血管周围的各种肿瘤细胞分子标志物与TC进行比较,发现TC与某些肿瘤有潜在的关系,他们进一步利用免疫组织化学法分析相关正常组织及肿瘤病理标本,提出了TC可能与多个器官的某些病理改变密切相关的假设[33-34]。
我们研究发现TC主要聚集于肾血管及肾小管周围,同时TC高表达Ⅳ型胶原蛋白及LN,而Ⅳ型胶原蛋白及LN是血管及肾小管基底膜的主要成分,提示TC与肾小管基底膜和肾内血管稳定性可能存在联系。有研究通过基因表达谱也发现TC与MSC及成纤维细胞间基因表达存在明显差异,TC高表达基质金属蛋白酶3(matrix metallopeptidase 3,MMP3)、金属蛋白酶组织抑制剂3(tissue inhibitor of metalloproteinase 3,TIMP3)及Ⅳ型胶原蛋白α等基因[35]。而MMP3与TIMP3能维持基底膜的动态平衡,这些证据进一步提示TC在肾脏再生修复中可能发挥重要的作用。
此外,我们研究发现TC也表达CD63分子,该分子能够激活金属蛋白酶组织抑制剂1-CD63-整合素β1信号转导通路,继而通过激活PI3K-ERK信号通路中的关键蛋白分子,发挥抑制内源性及外源性细胞凋亡途径的作用[36]。TC作为间质来源细胞,有较强的抗损伤能力,CD63可能是其抗损伤的关键分子之一。
综上所述,我们在大鼠肾脏皮质中分离并鉴定了TC,并发现其主要位于肾血管及肾小管周围,表达Ⅳ型胶原蛋白、LN及CD63分子,提示其可能有促进基底膜再生及肾脏损伤修复的功能。
1 Llinas RR. The contribution of Santiago Ramon y Cajal to functional neuroscience[J]. Nat Rev Neurosci, 2003, 4(1):77-80.
2 Hirst GD, Ward SM. Interstitial cells: involvement in rhythmicity and neural control of gut smooth muscle[J]. J Physiol, 2003, 550(Pt 2):337-346.
3 Sanders KM, Koh SD, Ward SM. Interstitial cells of cajal as pacemakers in the gastrointestinal tract[J]. Annu Rev Physiol, 2006, 68:307-343.
4 Hinescu ME, Gherghiceanu M, Mandache E, et al. Interstitial Cajal-like cells (ICLC) in atrial myocardium: ultrastructural and immunohistochemical characterization[J]. J Cell Mol Med, 2006, 10(1):243-257.
5 Hinescu ME, Popescu LM. Interstitial Cajal-like cells (ICLC) in human atrial myocardium[J]. J Cell Mol Med, 2005, 9(4):972-975.
6 Popescu LM, Faussone-Pellegrini MS. TELOCYTES - a case of serendipity: the winding way from Interstitial Cells of Cajal (ICC), via Interstitial Cajal-Like Cells (ICLC) to TELOCYTES[J]. J Cell Mol Med, 2010, 14(4):729-740.
7 Gherghiceanu M, Popescu LM. Cardiomyocyte precursors and telocytes in epicardial stem cell niche: electron microscope images[J]. J Cell Mol Med, 2010,14(4):871-877.
8 Gherghiceanu M, Manole CG, Popescu LM. Telocytes in endocardium: electron microscope evidence[J]. J Cell Mol Med, 2010,14(9):2330-2334.
9 Popescu LM, Gherghiceanu M, Hinescu ME, et al. Insights into the interstitium of ventricular myocardium: interstitial Cajal-like cells (ICLC)[J]. J Cell Mol Med, 2006,10(2):429-458.
10 Mandache E, Popescu LM, Gherghiceanu M. Myocardial interstitial Cajal-like cells (ICLC) and their nanostructural relationships with intercalated discs: shed vesicles as intermediates[J]. J Cell Mol Med, 2007, 11(5):1175-1184.
11 Kostin S, Popescu LM. A distinct type of cell in myocardium: interstitial Cajal-like cells (ICLCs)[J]. J Cell Mol Med, 2009, 13(2):295-308.
12 Suciu L, Popescu LM, Regalia T, et al. Epicardium: interstitial Cajal-like cells (ICLC) highlighted by immunofluorescence[J]. J Cell Mol Med, 2009, 13(4):771-777.
13 Li L, Lin M, Li L, et al. Renal telocytes contribute to the repair of ischemically injured renal tubules[J]. J Cell Mol Med, 2014, 18(6):1144-1156.
14 Gherghiceanu M, Hinescu ME, Andrei F, et al. Interstitial Cajal-like cells (ICLC) in myocardial sleeves of human pulmonary veins[J]. J Cell Mol Med, 2008, 12(5A):1777-1781.
15 Zheng Y, Li H, Manole CG, et al. Telocytes in trachea and lungs[J]. J Cell Mol Med, 2011, 15(10):2262-2268.
16 Qi G, Lin M, Xu M, et al. Telocytes in the human kidney cortex[J]. J Cell Mol Med, 2012, 16(12):3116-3122.
17 Popescu LM, Ciontea SM, Cretoiu D. Interstitial Cajal-like cells in human uterus and fallopian tube[J]. Ann N Y Acad Sci, 2007, 1101:139-165.
18 Hinescu ME, Gherghiceanu M, Suciu L, et al. Telocytes in pleura: two- and three-dimensional imaging by transmission electron microscopy[J]. Cell Tissue Res, 2011, 343(2):389-397.
19 Suciu L, Popescu LM, Gherghiceanu M. Human placenta: de visu demonstration of interstitial Cajal-like cells[J]. J Cell Mol Med, 2007, 11(3):590-597.
20 Gherghiceanu M, Popescu LM. Interstitial Cajal-like cells (ICLC) in human resting mammary gland stroma. Transmission electron microscope (TEM) identification[J]. J Cell Mol Med, 2005, 9(4):893-910.
21 Hou Y, Wang X, Li L, et al. FHL2 regulates hematopoietic stem cell functions under stress conditions[J]. Leukemia, 2015, 29(3):615-624.
22 Hou Y, Li W, Sheng Y, et al. The transcription factor Foxm1 is essential for the quiescence and maintenance of hematopoietic stem cells[J]. Nat Immunol, 2015, 16(8):810-818.
23 Takehara Y, Yabuuchi A, Ezoe K, et al. The restorative effects of adipose-derived mesenchymal stem cells on damaged ovarian function[J]. Lab Invest, 2013, 93(2):181-193.
24 Lin M, Li L, Li L, et al. The protective effect of baicalin against renal ischemia-reperfusion injury through inhibition of inflammation and apoptosis[J]. BMC Complement Altern Med, 2014, 14(1):1-9.
25 Zhang C, Zheng L, Li L, et al. Rapamycin protects kidney against ischemia reperfusion injury through recruitment of NKT cells[J]. J Transl Med, 2014, 12(1):224-224.
26 Tanaka T, Nangaku M. Pathogenesis of tubular interstitial nephritis[J]. Contrib Nephrol, 2011, 169:297-310.
27 Lee S, Huen S, Nishio H, et al. Distinct macrophage phenotypes contribute to kidney injury and repair[J]. J Am Soc Nephrol, 2011, 22(2):317-326.
28 Kaissling B, Hegyi I, Loffing J, et al. Morphology of interstitial cells in the healthy kidney[J]. Anat Embryol (Berl), 1996, 193(4):303-318.
29 Popescu LM, Manole E, Serboiu CS, et al. Identification of telocytes in skeletal muscle interstitium: implication for muscle regeneration[J]. J Cell Mol Med, 2011,15(6):1379-1392.
30 Popescu LM, Gherghiceanu M, Manole CG, et al. Cardiac renewing: interstitial Cajal-like cells nurse cardiomyocyte progenitors in epicardial stem cell niches[J]. J Cell Mol Med, 2009, 13(5):866-886.
31 Manole CG, Cismasiu V, Gherghiceanu M, et al. Experimental acute myocardial infarction: telocytes involvement in neo-angiogenesis[J]. J Cell Mol Med, 2011, 15(11):2284-2296.
32 Zhao B, Chen S, Liu J, et al. Cardiac telocytes were decreased during myocardial infarction and their therapeutic effects for ischaemic heart in rat[J]. J Cell Mol Med, 2013, 17(1):123-133.
33 Ardeleanu C, Bussolati G. Telocytes are the common cell of origin of both PEComas and GISTs: an evidence-supported hypothesis[J]. J Cell Mol Med, 2011, 15(12):2569-2574.
34 Li L, Li B, Shao J, et al. Chemotherapy sorting can be used to identify cancer stem cell populations[J]. Mol Biol Rep, 2012, 39(11):9955-9963.
35 Zheng Y, Zhang M, Qian M, et al. Genetic comparison of mouse lung telocytes with mesenchymal stem cells and fibroblasts[J]. J Cell Mol Med, 2013, 17(4):567-577.
36 Stetler-Stevenson WG. Tissue inhibitors of metalloproteinases in cell signaling: metalloproteinase-independent biological activities[J]. Sci Signal, 2008, 1(27):re6.
(本文编辑:徐小明)
黎力平, 林淼, 李龙, 等. 大鼠肾脏皮质中分离出新型间质细胞——特络细胞[J/CD]. 中华移植杂志: 电子版, 2016, 10(2): 81-84,96.
A new type of interstitial cell in rat renal cortex: telocyte
LiLiping1, 2,LinMiao3,LiLong1, 2,ZhengLong1, 2,ZhuTongyu1, 2.
1DepartmentofUrology,2ShanghaiKeyLabofOrganTransplantation,3DepartmentofThoracicSurgery,ZhongshanHospital,AffiliatedtoFudanUniversity,Shanghai200032,China
ZhuTongyu,Email:tyzhu@fudan.edu.cn
Objective To investigate the morphological and molecular biological features of telocyte(TC)in rat renal cortex. Methods Kidneys of four weeks old SD rats were taken from surgery. The method of microdissection was used to isolate and purify TC. Phase contrast microscope was used to observe and identify TC in rat renal cortex. Immunofluorescence was used to detect the molecular biomarkers including CD34, CD117, CD63, collagen Ⅳ and laminin of TC, fibroblast and mesenchymal stem cell. Transmission electron microscope (TEM) was used to observe the morphological features of TC. Results Typical TC could be isolated from rat renal cortex, whose morphological features were similar to TC which was found in other organs. The experimental results of immunofluorescence showed that CD34, CD117, CD63, and collagen Ⅳ and laminin were expressed in TC, which was obviously different from fibroblast and mesenchymal stem cell. Typical TC observed by TEM was ditributed around blood capillaries and renal tubules in rat kidney interstitium. Conclusions TC expressing CD34, CD117, CD63, collagen Ⅳ and laminin could be found in kidney interstitium, which prompted us that they might play a role during processes like basement membranes regeneration and kidney injury recovery.
Telocyte; Fibroblast; Mesenchymal stem cell; Rat; Renal cortex
10.3877/cma.j.issn.1674-3903.2016.02.007
200032 上海,复旦大学附属中山医院泌尿外科1, 上海市器官移植重点实验室2, 胸外科3
朱同玉, Email: tyzhu@fudan.edu.cn
2016-04-22)
