饲料脂肪源和乳化剂对牛蛙生长性能、肠道消化酶活力及肝脏生化指标的影响
2015-12-21张春晓
冯 伟 王 玲 张春晓* 宋 凯 张 璐
(1.农业部东海海水健康养殖重点实验室,厦门市集美大学饲料检测与安全评价重点实验室,集美大学水产学院,厦门 361021;2.通威股份有限公司,成都 610041)
鱼油作为水产饲料的优质脂肪源一直备受青睐,但随着海洋渔业资源的枯竭和鱼类捕捞量的下降,全球鱼油总产量锐减。严峻的市场压力导致了鱼油价格大幅度上升,这使得水产饲料生产企业越来越关注具有开发前景的脂肪源。中国是一个猪油资源十分丰富的国家,猪油来源于肥肉的炼制、食品加工等副产品,其高效利用日渐成为一个十分重要的课题[1]。国内外学者先后在虹鳟(Oncorhynchus mykiss)[2]、异 育 银 鲫 (Carassius auratus gibelio)[3]、鲤鱼(Cyprinus carpio)[4]、凡纳滨对 虾(Litopenaeus vannamei)[5]、施 氏鲟 (Acipenser schrenckii)幼 鱼[6]、黄 颡 鱼 (Pelteobagrus fulvidraco)[7]等水产动物上开展了猪油替代鱼油的研究。多数结果表明鱼油作为饲料脂肪源时,动物的生长性能明显优于猪油组[2-6]。有研究表明,水产动物对猪油的消化率比鱼油低[8],因此如何提高水产动物对猪油的利用是猪油作为鱼油替代脂肪源的关键问题。乳化剂能有效促进脂肪在肠道内乳化形成水溶性微粒,增强动物对脂肪的吸收和利用[9-11]。研究表明,在以猪油为主要脂肪源的饲料中添加乳化剂可显著提高仔猪增重率和饲料效率[12]。
牛蛙原产于北美洲,因其鸣叫声宏亮酷似牛叫,故名牛蛙。牛蛙肉味鲜美,营养丰富,蛋白质含量高,胆固醇含量低。同时牛蛙具有繁殖快、适应性强、生长迅速和抗逆性强等优点,在福建、广东、浙江和海南等省都有大量养殖。国内外学者对蛙类营养生理已有部分研究[13-17],其中,皇康康等[15]研究发现,以鱼油为脂肪源时,牛蛙饲料中适宜的脂肪水平为7%。在传统牛蛙饲料中,鱼油仍然是牛蛙饲料的主要脂肪源。因此,寻找替代脂肪源,降低饲料成本,是牛蛙饲料和养殖产业节支增收的途径之一。本试验通过双因子试验设计探讨饲料中不同脂肪源和乳化剂对牛蛙生长性能、体组成、肠道消化酶活力、肝脏生化指标的影响,旨在为牛蛙配合饲料中猪油的使用提供科学依据。
1 材料与方法
1.1 试验饲料
以鱼粉、豆粕为主要蛋白质源,分别以猪油(美国动物蛋白及油脂提炼协会提供)和鱼油为主要脂肪源,配制脂肪水平为7%的2种基础饲料;另分别向2种基础饲料中添加300 mg/kg的商用乳化剂(磷脂型复合乳化剂,由厦门市美尔吉生物科技有限公司提供),制成2种含乳化剂的饲料。试验共配制4种等氮等能的试验饲料,分别记为D1(7%猪油+不添加乳化剂)、D2(7%猪油+0.03%乳化剂)、D3(7%鱼油+不添加乳化剂)、D4(7%鱼油+0.03%乳化剂)。试验饲料组成及营养水平见表1。
1.2 动物饲养与管理
试验用牛蛙购于厦门市同安区一养殖场,为同一批孵化蛙苗。正式试验前,牛蛙放于室内暂养缸(1.5 m×0.7 m×0.6 m)中暂养,以商业牛蛙膨化饲料(福建省海新集团有限公司提供)进行投喂,使之逐渐适应养殖环境。暂养15 d后,将牛蛙饥饿24 h,挑选个体大小均匀的健康牛蛙随机分配到室内12个水族箱(0.7 m×0.4 m×0.4 m)中进行养殖试验。试验牛蛙初始体重为(19.01±0.01)g,随机分为4组,每组3个重复(水族箱),每个重复放养15只牛蛙。养殖试验持续8周。试验期间,水族箱水位4 cm,水温28~30℃,每天投喂2次(08:00、18:00),达表观饱食状态,投喂前30 min对各缸进行换水和清洗。养殖期间记录牛蛙的摄食和死亡情况。
1.3 样品采集
养殖试验开始前,采用双毁髓法将暂养缸中随机挑取的15只牛蛙处理后置于-20℃冰箱中保存,以用于牛蛙初始样本的分析。8周养殖试验结束后,禁食24 h,然后对每个重复进行计数并逐只称重。分别从每个缸中随机抽取5只牛蛙,用双毁髓法处理,其中2只牛蛙用于全体成分分析;将另外3只牛蛙解剖,将牛蛙体腔内容物取出,称内脏总重,再剥离出肝脏和肠道,称肝脏重,并迅速截取部分肠道(胃幽门后方2~9 cm处),置于-80℃冰箱中保存待测,随后将这3只取过内脏的牛蛙存放于同一自封袋,置-20℃冰箱中保存待测牛蛙胴体成分。
1.4 样品分析
试验原料、饲料、牛蛙全体和胴体中水分、粗蛋白质、粗脂肪和粗灰分含量以及总能的测定参照AOAC(2005)[16]的测定方法。水分含量采用105℃常压烘箱干燥法测定;粗蛋白质含量采用凯氏定氮法,用FOSS公司生产的Kjeltec8400型全自动凯氏定氮仪进行测定;粗脂肪含量采用索氏抽提法测定;粗灰分含量采用马福炉550℃灼烧法测定;总能采用氧弹式测量热仪(PARR6300,美国)测定。
将牛蛙前肠样品用预冷生理盐水漂洗,除去内容物及结缔组织,滤纸拭干称重。每只牛蛙取1.0 g肠道样品加入9倍体积的浓度为0.7%的4℃生理盐水,冰浴匀浆(10 000 r/min,10 s/次,连续4次),3 000 r/min离心10 min,取上清液用于测肠道蛋白酶、脂肪酶和淀粉酶等消化酶活力。肠道蛋白酶活力测定采用福林-酚试剂法[17],蛋白酶活力单位定义:每分钟内分解出1μg酪氨酸的酶量称为1个酶活力单位。脂肪酶活力测定采用化学比浊法(试剂盒购自南京建成生物工程研究所)。脂肪酶活力单位定义:在37℃条件下,每克组织蛋白质在反应体系中与底物反应1 min,每消耗1μmol底物为1个酶活力单位。淀粉酶活力测定采用碘-淀粉比色法(试剂盒购自南京建成生物工程研究所)。淀粉酶活力单位定义:组织中每毫克蛋白质在37℃与底物作用30 min,水解10 mg淀粉定义为1个酶活力单位。
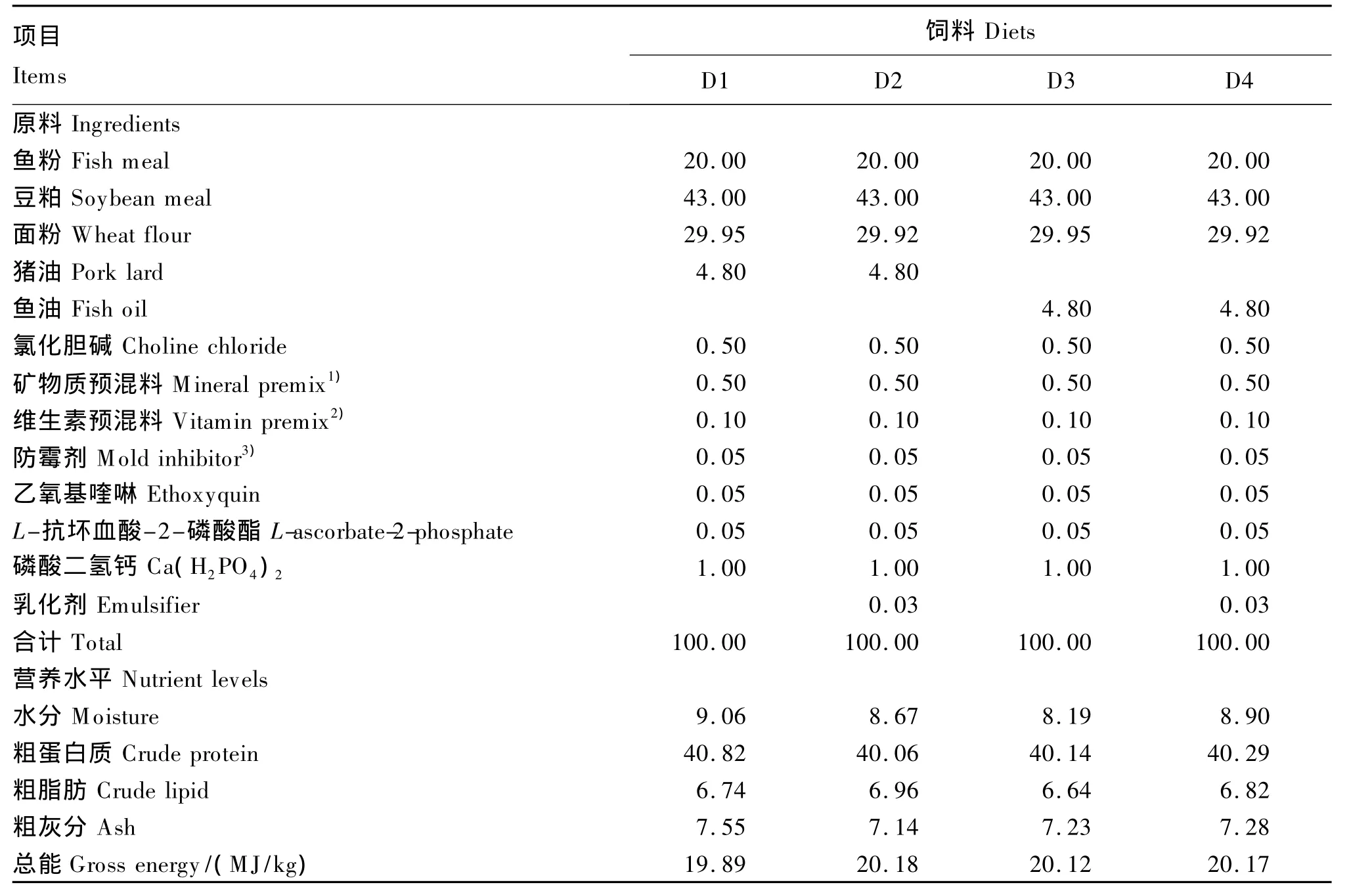
表1 试验饲料组成及营养水平(风干基础)Table 1 Composition and nutrient levels of experimental diets(air-dry basis) %
牛蛙肝脏丙二醛(MDA)含量及过氧化氢酶(CAT)和超氧化物歧化酶(SOD)活力采用南京建成生物工程研究所生产的试剂盒进行测定,具体操作均按照说明书进行。
1.5 计算公式
根据相应数据,按下式计算增重率(weight gain rate,WGR,%)、特定生长率(specific growth rate,SGR)、摄食量(feed intake,FI)、饲料系数(feed conversion ratio,FCR)、肝体比(hepaticsomatic index,HSI)、脏体比(viscerasomatic index,VSI)、氮沉积率(nitrogen retention rate,NRE)和能量沉积率(energy retention rate,ERE)。
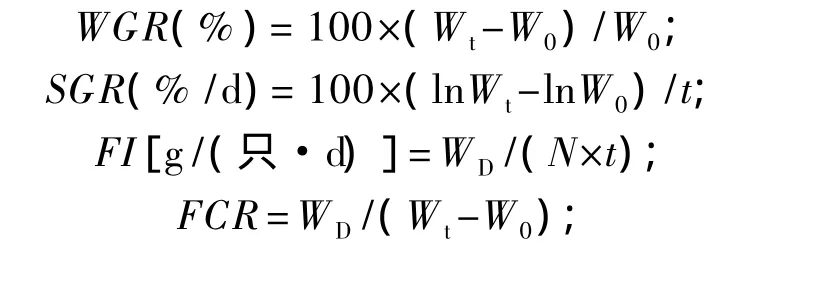
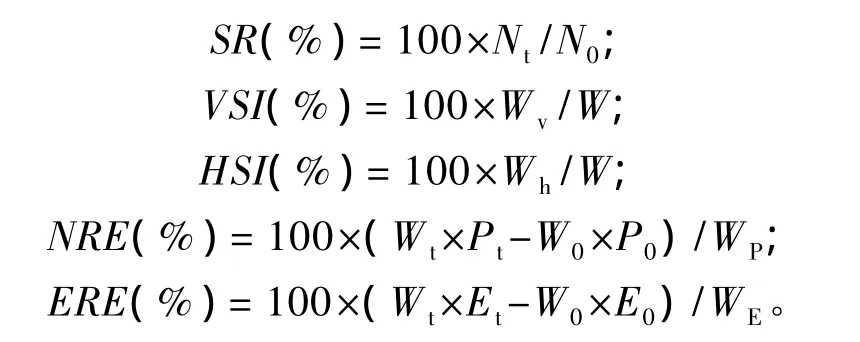
式中:Wt为终末牛蛙总重(g);W0为初始牛蛙总重(g);WD为摄食饲料总重(g);Wp为摄入蛋白质总量(g);N为牛蛙只数;Nt终末牛蛙只数;N0为初始牛蛙只数;Wv为内脏重(g);Wh为肝脏重(g);W为体重(g);Pt为终末牛蛙全体粗蛋白质含量(%);P0为初始牛蛙全体粗蛋白质含量(%);Et为终末牛蛙全体能量(kJ/g);E0为初始牛蛙全体能量(kJ/g);WE为摄入饲料的总能量(kJ/g)。
1.6 数据统计与分析
试验数据经Excel 2007初步整理后,采用SPSS 16.0软件对所得数据分别进行单因素方差分析(one-way ANOVA)和双因素方差分析(twoway ANOVA)。若差异显著,则进行Tukey氏多重比较,显著性水平为P<0.05,数据均采用平均值±标准误(mean±SE)表示。
2 结果
2.1 饲料脂肪源和乳化剂对牛蛙生长性能的影响
由表2可知,D3组与D1组相比,WGR提高了7.41%(P<0.05),而 D2组与 D4相比,WGR 和 FI分别提高了 10.74% 和 24.17%(P<0.05)。D2组与D1组相比,WGR、SGR和 FI分别提高了18.92% 、9.65% 和 35.45%(P<0.05),2 组之间 FCR、NRE、ERE、SR、HSI和 VSI均差异不显著(P>0.05)。D3组和 D4 组之间 WGR、SGR、FCR、NRE、ERE、SR、FI、HSI和 VSI均差异不显著(P>0.05)。双因素方差分析结果表明,饲料脂肪源和乳化剂对WGR、SGR和FI有显著的交互作用(P<0.05)。
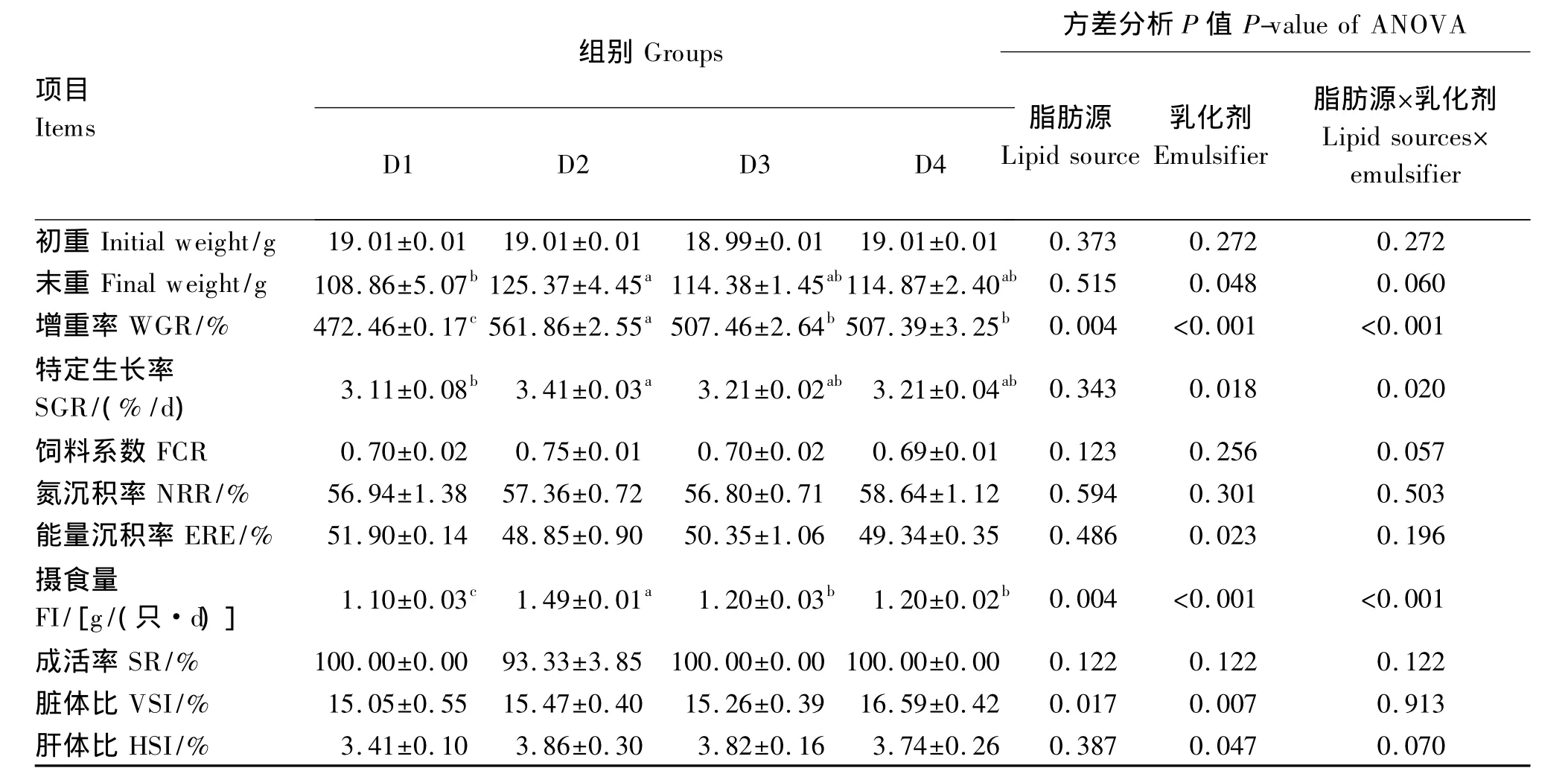
表2 饲料脂肪源和乳化剂对牛蛙生长性能的影响Table 2 Effects of dietary lipid source and emulsifier on growth performance of bullfrog
2.2 饲料脂肪源和乳化剂对牛蛙全体和胴体组成的影响
由表3可知,各组牛蛙全体水分、粗蛋白质和粗灰分含量无显著差异(P>0.05)。D1组与D3组相比,全体粗脂肪含量差异不显著(P>0.05)。D2组与D4组相比,全体粗脂肪含量提高了17.73%(P<0.05)。D2组较 D1组全体粗脂肪含量提高了21.60%(P<0.05)。D3 组与 D4 组之间全体粗脂肪含量差异不显著(P>0.05)。饲料脂肪源和乳化剂对牛蛙全体水分和粗脂肪含量有显著的交互作用(P<0.05)。各组牛蛙胴体水分、粗蛋白质、粗脂肪和粗灰分含量均无显著差异(P>0.05),且饲料脂肪源和乳化剂对胴体上述成分无显著的交互作用(P>0.05)。
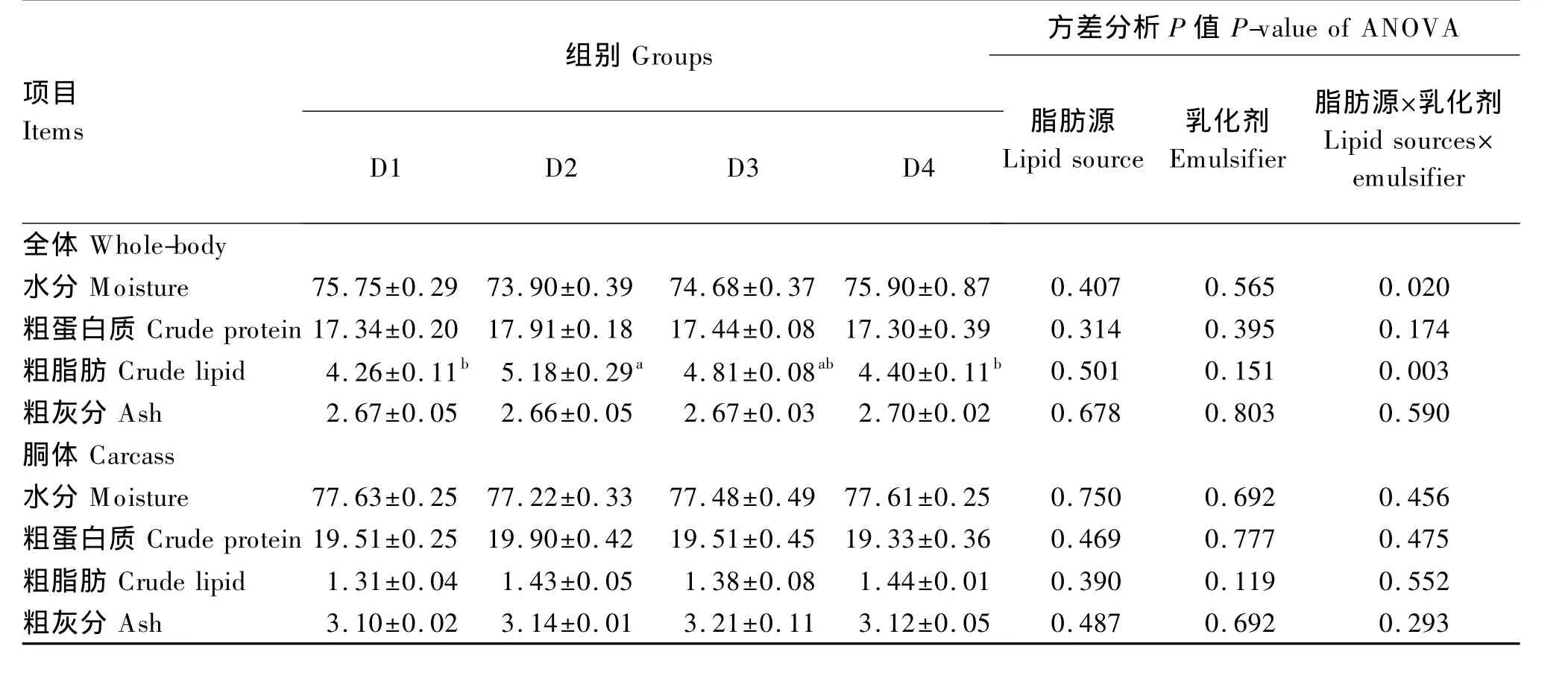
表3 饲料脂肪源和乳化剂对牛蛙全体和胴体组成的影响Table 3 Effects of dietary lipid source and emulsifier on whole-body and carcass composition of bullfrog %
2.3 饲料脂肪源和乳化剂对牛蛙肠道消化酶活力的影响
由表4可知,在不同脂肪源的饲料中添加乳化剂对肠道蛋白酶和淀粉酶活力均无显著影响(P>0.05)。D3组与D1组相比,肠道脂肪酶活性提高了40.61%(P<0.05)。相同脂肪源的各组中,D2组较D1组肠道脂肪酶活性提高了62.58%(P<0.05),D3组与D4组肠道脂肪酶活力没有显著差异(P>0.05)。饲料脂肪源和乳化剂对牛蛙肠道脂肪酶活力有显著的交互作用(P<0.05)。
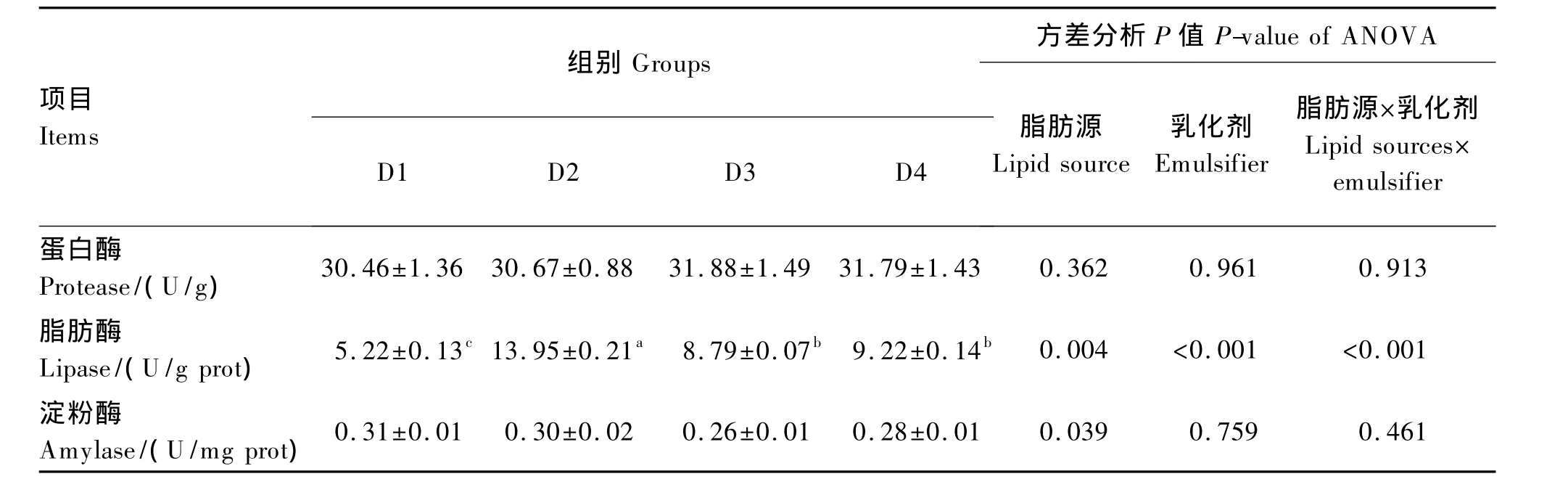
表4 饲料脂肪源和乳化剂对牛蛙肠道蛋白酶、脂肪酶和淀粉酶活力的影响Table 4 Effects of dietary lipid source and emulsifier on protease,lipase and amylase activities in intestine of bullfrog
2.4 饲料脂肪源和乳化剂对牛蛙肝脏生化指标的影响
由表5可知,在不同脂肪源的饲料中添加乳化剂对牛蛙肝脏CAT和SOD活力无显著影响(P>0.05)。D3组与 D1组相比,肝脏 MDA含量提高了18.87%(P<0.05)。相同脂肪源的各组中,D2组较D1组肝脏MDA含量提高了18.87%(P<0.05),D3组与D4组之间肝脏 MDA含量差异不显著(P>0.05)。饲料脂肪源和乳化剂对牛 蛙肝脏MDA含量有显著的交互作用(P<0.05)。
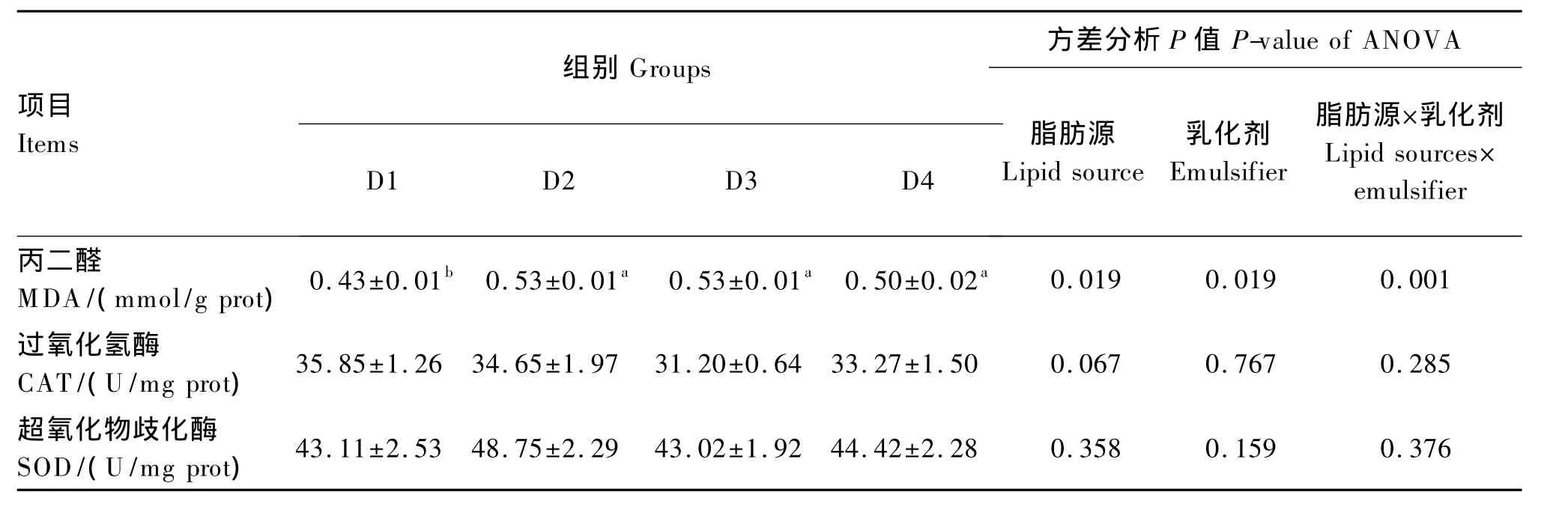
表5 饲料脂肪源和乳化剂对牛蛙肝脏生化指标的影响Table 5 Effects of dietary lipid source and emulsifier on hepatic biochemical indexes of bullfrog
3 讨论
不同的脂肪源存在不同的脂肪酸组成及比例,而脂肪酸的组成及比例可对鱼类生长产生影响[18]。在对草鱼(Ctenopharyngodon idellus)[19]、罗非鱼(Oreochromis niloticus)[20]和异育银鲫[3]的研究中发现,不同脂肪源对于鱼类生长有显著影响,且鱼油组生长效果好于猪油组。导致该试验结果的原因可能有以下2方面:一方面是鱼油中富含对水产动物具有重要生理功能的高不饱和脂肪酸(highly unsaturated fatty acids,HUFAs)[21],另一方面是鱼油富含的不饱和脂肪酸较猪油富含的饱和脂肪酸更易消化吸收[22]。在本试验中,D1组WGR和FI显著低于D3组,但2组之间FCR差异不显著,这表明较低的FI可能是导致猪油组生长较差的原因。本试验的结果也说明,与猪油相比,鱼油对牛蛙有更好地促摄食作用。
在本试验中,D2组的WGR和SGR显著高于D1组和D3组,相似结果也出现在对团头鲂[9]和肉鸡[10,23]的研究中。这说明,饲料中添加乳化剂可以提高猪油作为脂肪源的使用效果。然而,饲料中添加乳化剂并没有改善鱼油组的生长性能。一般而言,多不饱和脂肪酸自身具有较高的乳化能力,通常比饱和脂肪酸更容易形成微团[24],含有大量多不饱和脂肪酸的鱼油能够被动物很好地利用,因而牛蛙饲料中乳化剂的添加对于鱼油利用率的改善效果不明显。本研究发现D2组FI显著高于D1组,而D3组与D4组FI差异不显著,说明饲料中添加乳化剂改善了猪油组饲料的适口性。各组之间FCR均无显著差异,说明D2组牛蛙FI的增加是其WGR提高的主要原因。D1组与D3组相比,其FI更低,而FCR、NRE和 ERE相似,即低摄食水平下牛蛙对以猪油为主要脂肪源饲料的利用率与高摄食水平下牛蛙对以鱼油为主要脂肪源饲料的利用率相似,说明牛蛙对食物的消化能力影响其摄食量,牛蛙可能通过摄食的调节以维持稳定的对食物的利用率。
已有研究表明,饲料组成对水产动物体组成有重要影响[25]。潘瑜等[4]报道,用鱼油、豆油、菜籽油、亚麻籽油和猪油为脂肪源的5种试验饲料投喂鲤鱼8周后,鱼油组全鱼粗脂肪含量最低,猪油组全鱼粗脂肪含量最高。研究人员认为这可能是因为鱼油富含n-3HUFA,可通过抑制脂肪合成来降低脂肪沉积量[26]。在小鼠上的研究也发现,HUFA抑制脂肪生成是通过下调固醇调节元件结合蛋白-1(SREBP-1)的表达实现的,并相应地降低脂肪生成酶 mRNA 的表达[27]。徐后国[28]研究发现,饲料中添加饱和脂肪酸显著增加了鲈鱼幼鱼机体及组织脂肪含量。然而,本试验结果表明,在D1组和D3组,牛蛙全体和胴体中营养成分没有因为饲料中主要脂肪源的不同而发生变化,可能是因为D1组FI显著低于D3组,因而可用于体内沉积的脂肪含量较少,不足以改变牛蛙机体组成。本试验中,D2组全体粗脂肪含量显著高于D1组,而在以鱼油为主要脂肪源的饲料中添加乳化剂并未显著影响牛蛙全体营养成分含量。这可能是因为通过在饲料中添加乳化剂显著提高了猪油组的FI,使得牛蛙消化吸收更多的饱和脂肪酸,从而导致D2组体脂肪沉积量增加。
肠道消化酶的活力是反映肠道对食物中蛋白质、脂肪和碳水化合物等消化能力的重要指标。有研究表明,脂肪酶的分泌会受到饲料中脂肪的诱导,脂肪酶的活力与饲料中的脂肪水平具有相关性[29]。宋理平等[30]研究发现,随着饲料脂肪水平的升高,厚唇弱济 (Hephaestus fuliginosus)肠道脂肪酶活力也随之升高。在对金头鲷(Sparus aurata)[31]和 翘 嘴 红 鲌 (Erythroculter ilishaeformis)[32]的研究中也得到相似的结果。从本试验研究结果来看,D3组较D1组有更高的肠道脂肪酶活力和FI,可能是因为鱼油组通过摄食更多的脂肪而刺激牛蛙分泌更多的脂肪酶。本试验中,D2组肠道脂肪酶活力显著高于D1组,这可能是因为D2组具有较高的FI,从而单位时间内摄入更多脂肪,刺激分泌更多的脂肪酶,同时在乳化剂的作用下,脂肪乳化分散更易被脂肪酶分解而产生更多的脂肪酸,而脂肪酸可通过刺激胆囊收缩素释放而促进胰腺分泌消化酶[33]。同时,在本试验中,在以鱼油为脂肪源的饲料中添加乳化剂并未显著影响肠道脂肪酶的活力,可能是2组之间相似的FI所致。
动物机体的抗氧化水平在一定程度上反映机体的健康状况。SOD和CAT存在于生物体各种组织中,可以消除超氧阴离子自由基,降低脂质过氧化物含量,使机体免受损伤[34]。MDA被认为是体内脂肪酸过氧化物的产物,其组织含量是肝脏损伤程度的指标[35]。本试验中,D3组肝脏MDA含量显著高于D1组。Huang等[20]研究也发现摄食以鱼油为主要脂肪源饲料的罗非鱼,其肝胰脏MDA含量高于摄食以猪油为主要脂肪源饲料的罗非鱼,这可能是因为鱼油富含HUFA,而HUFA因其高度不饱和性而容易发生脂质过氧化。另外,本试验中,D2组MDA含量显著高于D1组。皇康康等[15]研究发现牛蛙肝脏MDA的含量随饲料脂肪水平的增加而显著升高。张春暖等[36]研究也发现梭鱼(Chelon haematocheilus)肝脏MDA含量随饲料脂肪水平的增加而升高,表明外源脂肪的添加对肝细胞脂质过氧化有一定的诱导作用。本试验中各组饲料脂肪水平一致,但D2组牛蛙较D1组有更高的FI,因而导致其更高的肝脏MDA含量。而D3组与D4组牛蛙的FI相似,因而二者肝脏MDA含量差异不显著。
4 结论
在饲料脂肪水平为7%条件下,饲料中以猪油为主要脂肪源时添加0.03%乳化剂能提高牛蛙的FI和肠道消化酶的活力,并促进牛蛙生长。
[1] 符剑刚,钟宏.猪油的开发利用[J].粮油食品科技,2003,11(4):28-30.
[2] GIOVANNI M T,TIZIANA M,LIVER F,et al.Effects of alternative dietary lipid sources on performance,tissues chemical composition,mitochondrial fatty acid oxidation capabilities and sensory characteristics in brown trout(Salmo trutta L.)[J].Aquaculture,2003,225(1/2/3/4):251-267.
[3] 王煜恒,王爱民,刘文斌,等.不同脂肪源对异育银鲫鱼种生长、消化率及体成分的影响[J].水产学报,2010,34(9):1439-1446.
[4] 潘瑜.亚麻油对鲤生长性能、脂质代谢及抗氧化能力的影响[D].硕士学位论文.重庆:西南大学,2013.
[5] ZHOU Q C,LIC C,LIU C W,et al.Effects of dietary lipid sources on growth and fatty acid composition of juvenile shrimp,Litopenaeus vannamei[J].Aquaculture Nutrition,2007,13(3):222-229.
[6] 高露姣,施兆鸿,艾春香.不同脂肪源对施氏鲟幼鱼血清生化指标的影响[J].海洋渔业,2005,27(4):319-323.
[7] 刘飞.不同油脂、不同磷脂水平对黄颡鱼生长及其脂肪酸组成的影响[D].硕士学位论文.武汉:华中农业大学,2004.
[8] NRC.Nutrient requirements of fish and shrimp[S].Washington,D.C.:National Academy Press,2011.
[9] 阮剑均,张严伟,温超,等.乳化剂对团头鲂生产性能、脂肪酶活性及血液生化指标的影响[J].水产科学,2012,31(10):577-581.
[10] 柘丽.乳化剂与L-肉碱对肉鸡生产性能及饲粮养分利用的影响[D].硕士学位论文,雅安:四川农业大学,2012.
[11] 李林枫,赵颖,周岩民.乳化剂对育肥猪肌肉品质和抗氧化性能的影响[J].粮食与饲料工业,2013(4):56-58.
[12] 张鹤亮,呙于明,陈清明,等.大豆卵磷脂和不同饱和度的油脂在断奶仔猪日粮中的应用效果[J].中国畜牧杂志,1999,35(4):22-24.
[13] 徐德平,曾训江,刘素文,等.牛蛙饲料中最适蛋白质含量的研究[J].湖南水产,1989(6):15-18.
[14] OLVERA-NOVOA M A,ONTIVEROS-ESCUTIA V M,FLORES-NAVA A.Optimum protein level for growth in juvenile bullfrog(Rana catesbeiana Shaw,1802)[J].Aquaculture,2007,266(1/2/3/4):191-199.
[15] 皇康康,张春晓,王玲,等.饲料蛋白质和脂肪水平对牛蛙生长性能的影响[J].水产学报,2014,38(6):877-887.
[16] AOAC.Official methods of analysis of AOAC international[S].18th ed.Gaithersburg MD:Association of Official Analytical Chemists International,2005.
[17] 北京大学生物系生物化学教研室.生物化学实验指导[M].北京:人民教育出版社,1979:73-74.
[18] SARGENT J,BELL G,MCEVOY L,et al.Recent developments in the essential fatty acid nutrition of fish[J].Aquaculture,1999,177(1/2/3/4):191-199.
[19] 刘玮,徐萍,任本根,等.不同脂肪源饲料对草鱼稚鱼生长的影响[J].水产学报,1995,19(4):362-365.
[20] HUANG C H,HUANG M C,HOU P C.Effect of dietary lipids on fatty acid composition and lipid peroxidation in sarcoplasmic reticulum of hybrid tilapia,Oreochromis niloticus×O.aureus[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,1998,120(2):331-336.
[21] JI H,LI J,LIU P.Regulation of growth performance and lipid metabolism by dietary n-3 highly unsaturated fatty acids in juvenile grass carp,Ctenopharyngodon idellus[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,2011,159(1):49-56.
[22] FREEMAN C P.Properties of fatty acids in dispersions of emulsified lipid and bile salt and the significance of these properties in fat absorption in the pig and the sheep[J].British Journal of Nutrition,1969,23(2):249-263.
[23] 胡玲.两种能量水平饲粮添加乳化剂对肉鸡生产性能及养分利用率的影响[D].硕士学位论文.雅安:四川农业大学,2012.
[24] POLIN D,WING T L,KI P,et al.The effect of bile acids and lipase on absorption of tallow in young chicks[J].Poultry Science,1980,59(12):2738-2743.
[25] HANSEN A C,ROSENLUND G,KARLSEN Ø,et al.Total replacement of fish meal with plant proteins in diets for Atlantic cod(Gadus morhua L.)Ⅰ—Effects on growth and protein retention[J].Aquaculture,2007,272(1/2/3/4):599-611.
[26] RIBEIRO P A P,LOGATO P V R,PAULA D A D G,et al.Effect of different oils in the diet on lipogenesis and the lipid profile of Nile tilapias[J].Revista Brasileira de Zootecnia,2008,37(8):1331-1337.
[27] KIM H J,TAKAHASHI M,EZAKI O.Fish oil feeding decreases mature sterol regulatory element-binding protein 1(SREBP-1)by down-regulation of SREBP-1c mRNA in mouse liver a possible mechanism for down-regulation of lipogenic enzyme mRNAs[J].Journal of Biological Chemistry,1999,274(36):25892-25898.
[28] 徐后国.饲料脂肪酸对鲈鱼幼鱼生长、健康及脂肪和脂肪酸累积的影响[D].博士学位论文.青岛:中国海洋大学,2013.
[29] SHIELDS R J.Larviculture of marine finfish in Europe[J].Aquaculture,2001,200(1/2):55-88.
[30] 宋理平,韩勃,冒树泉,等.脂肪水平对厚唇弱棘䱨生长及肠道脂肪酶活力性影响[J].广东海洋大学学报,2010,30(1):13-17.
[31] FOUNTOULAKI E,ALEXI M N,NENGAS I,et al.Effect of diet composition on nutrient digestibility and digestive enzyme levels of gilthead sea bream(Sparus aurata L.)[J].Aquaculture Research,2005,36(13):1243-1251.
[32] 向枭,陈建,周兴华,等.饲料中脂肪含量对翘嘴红鲌幼鱼生长的影响[J].饲料工业,2008,29(20):20-23.
[33] 艾晓杰,韩正康.禽胰液分泌的调节[J].国外畜牧科技,2000,27(5):37-39.
[34] 周显青,李胜利,王晓辉,等.维生素C多聚磷酸酯对小鼠肝脏脂质过氧化物和抗氧化物酶的影响[J].动物学报,2004,50(3):370-374.
[35] MOURENTE G,TOCHER D R,DIAZ E,et al.Relationships between antioxidants,antioxidant enzyme activities and lipid peroxidation products during early development in Dentex dentex eggs and larvae[J].Aquaculture,1999,179(1/2/3/4):309-324.
[36] 张春暖,王爱民,刘文斌,等.饲料脂肪水平对梭鱼脂肪沉积、脂肪代谢酶及抗氧化酶活性的影响[J].中国水产科学,2013,20(1):108-115.
