竹鼠肠道中厌氧纤维素降解菌的分离与鉴定
2015-12-21曹晓燕汪珊如徐高跷张胜男王士长梁世忠
曹晓燕 汪珊如 徐 雯 徐高跷 张胜男 王士长 梁世忠*
(1.广西大学动物科学技术学院,南宁 530005;2.南宁学院,南宁 530200)
近年来,一些学者对厌氧和兼性厌氧的纤维素降解菌进行了研究[1-3],以扩大纤维素酶的应用。但对于肠道中厌氧型降解菌的研究鲜有报道,而动物肠道中99%的菌群是厌氧或者是兼性厌氧菌[4]。竹鼠,分类地位是哺乳纲啮齿目竹鼠科竹鼠属和小竹鼠属,主要分布在我国的南部和中部地区、缅甸北部和越南等国家和地区。竹鼠属于草食性动物,日常主要以植物的根茎类为食。平时饲养时主要以农作物的新鲜秸秆为饲料,其采食的部分是其他动物弃食的部分,是消化利用粗纤维的佼佼者。中华竹鼠主要以成熟竹子为食物来源,对于纤维素具有很强的消化能力。本试验的目的是从竹鼠肠道中分离、鉴定出高活力厌氧纤维素降解菌,以期为提高动物肠道纤维素的利用率,增加动物抵抗力,减少抗生素的使用和解决厌氧环境下高效分解纤维素利用率提供理论支持,为绿色粗词料微生物添加剂的研究和开发提供基础资料。
1 材料与方法
1.1 试验材料
1.1.1 培养基
1.1.1.1 初筛培养基[5-6]
矿物质溶液:(NH4)2SO46.0 g,NaCl 6.0 g,MgSO40.6 g,CaCl20.6 g,加蒸馏水至 1 000 mL。
培养基:NH4Cl 2.0 g,K2HPO41.8 g,酵母膏1.2 g,矿物质盐溶液 150 mL,DL-半胱氨酸盐酸盐0.5 g,纤维素[微晶纤维素(MCC)或羧甲基纤维素钠(CMC-Na)]悬浊液100 mL(5%,m/V),pH调至7.0,加蒸馏水至1 000 mL。灭菌后,按照每200 mL培养基加入1 mL刚果红(CR)溶液(10 mg/mL)的比例加入CR溶液,混匀后倒入平板。
1.1.1.2 复筛培养基[5]
复筛培养基组成中纤维素悬浊液采用纤维二糖代替作为唯一的碳源,溶液纤维二糖含量5%(m/V),其他成分同初筛培养基。
1.1.2 样品采集
选取3只5月龄雄性的竹鼠,体重约1.5 kg作为试验对象(购自广西省南宁市金诚双丰经济动物养殖科技有限公司),其饲粮由粗饲料和精饲料组成。粗饲料由米糠、新鲜竹子、黄竹草下端茎部、玉米粒组成。精饲料由米饭、预混料(212AA,广西彼得汉预混饲料有限公司)和配合饲料(采用膨化乳猪配合料,购自广西金苹果饲料有限公司)组成。上午饲喂2次,在09:00左右将米饭(50%)、米糠(40%)、预混料(5%)、配合饲料(5%,用水泡湿)混合搅拌后进行饲喂,平均每只成年竹鼠总量为50 g左右;11:00左右饲喂新鲜竹子,每只竹鼠约21.00 g。下午饲喂 2次,在15:00左右饲喂新鲜黄竹草下端茎部,每只竹鼠约20 g;16:00左右饲喂泡好并晾干的玉米粒,每只竹鼠约15粒。
1.2 试验方法
1.2.1 菌种的筛选
在厌氧条件下,取竹鼠盲肠部分内容物进行稀释,选用初筛培养基进行培养,将倒好的平板置于37℃厌氧箱中进行培养,约72 h,同时设空白对照组(蒸馏水代替内容物稀释液)。待平板中有菌落长出,选取有透明水解圈(产生纤维素菌落的周围将会出现明显的透明水解圈)的单菌落镜检观察是否为单一菌种,若是单一菌种,留存以备复筛,若不是单一菌种,继续进行初筛分离纯化。将初筛得到的几株能产透明的水解圈的菌株在复筛培养基上进行单菌落培养(同时设空白对照组,蒸馏水代替菌液),对比水解圈的大小和透明度,选出水解圈较大且透明度较好的2株菌。复筛培养条件同初筛。
1.2.2 纤维素酶活力测定
吸取 450μL 1%CMC-Na溶液(m/V)于2 mL离心管中,置于40℃的水浴锅中预热5 min。加入50μL的菌液并以灭活的菌液作为对照组,在水浴锅中保温反应30 min。反应结束后,立即加入1 mL的二硝基水杨酸(DNS)试剂,煮沸反应显色5 min,冷却至室温。在540 nm下测其吸光度(OD)值。
纤维素酶活力定义:1 mL菌液于40℃ pH 4.8条件下,每分钟水解1%CMC-Na溶液产生1μmol还原糖(以葡萄糖计,含量通过DNS试剂法测定[7])的酶量,定义为1个活力单位。
1.2.3 菌种的16S rDNA序列测定
1.2.3.1 提取所筛选菌株的基因组DNA
用试剂盒对37℃培养48 h的菌株进行基因组DNA提取,细菌基因组DNA快速抽提试剂盒购自生工生物工程(上海)有限公司。步骤如下:1)取1 mL过夜培养的细菌菌液,加入1.5 mL离心管中,用低温冷冻离心机(H1850R,湘仪离心机仪器有限公司)室温5 717×g离心1 min,弃上清,收集菌体,加入400μL裂解液(buffer digestion),震荡混匀。65℃水浴1 h至细胞完全裂解。水浴过程中,每10 min颠倒混匀1次,至混合液变澄清透明为裂解完全。为得到无RNA的DNA,在水浴后加入20μL RNase A(20 mg/mL),室温放置2~5 min。2)加入200 mL Buffer PB,充分颠倒混匀,-20℃冰箱放置5 min。3)室温8 933×g离心5 min,将上清液(500~550μL)转移到新的1.5 mL离心管中。4)加入等体积的异丙醇,颠倒5~8次使之充分混匀,室温放置2~3 min。室温8 933×g离心5 min,弃上清。5)加入1 mL 75%乙醇,颠倒漂洗 1 ~3 min,8 933×g离心 2 min,弃上清。漂洗时一定要使沉淀悬浮起来。6)重复步骤5)1次。7)开盖室温,放入真空抽干机,至残留的乙醇完全挥发。(注:此步绝不可省略,否则残留的乙醇会严重影响得率和后续试验。如果残留的乙醇有挂壁现象,倒掉液体后再短暂离心,将残留用移液器吸出。然后开盖室温放真空抽干机,至残留的乙醇完全挥发。)8)得到的DNA用50~100μL TE缓冲液溶解。提取的总DNA可立即进行下一步试验或-20℃保存。TE缓冲液组成为10 mmol/L Tirs-HCl,1 mmol/L乙二胺四乙酸(EDTA),pH 8.0。9)提取的总 DNA 用1%的琼脂糖凝胶电泳进行检测。
1.2.3.2 16S rDNA 的扩增、克隆与序列分析
将提取得到的DNA用作PCR扩增的模板,用细菌通用引物27F和1492R对16S rDNA序列进行扩增[8]。引物序列上游为 27F:5'-AGAGTTTGATCMTGGCTGAG -3',下 游 为 1492R:5'-TACGGCTACCTTGTTACGACTT-3'。PCR 扩增反应体系终体积为50μL。PCR扩增反应程序:预变性94℃ 3 min;变性94℃ 1 min,退火55℃40 s,延伸 72 ℃ 1.5 min,20个循环;延伸 72 ℃10 min;4℃保温。
利用1%琼脂糖凝胶电泳检测,PCR产物的预期长度约为1 500 bp。
对目的片段进行胶回收,得到单一的16S rDNA片段。电泳检测16S rDNA片段浓度后,确定连接酶系。过夜培养后得到的连接产物转化到大肠杆菌感受态细胞DH5α中。利用蓝白斑筛选正确的转化子。37℃摇床培养后,提取DNA并进行PCR扩增、电泳检测,验证正确的转化子提取质粒后送生工生物工程(上海)有限公司进行测序。
2 结果与分析
2.1 菌种筛选
2.1.1 初筛结果
由图1可见,初筛采用CMC-Na和MCC为纤维素源均有明显的水解圈产生。在2种不同培养基上,各获得3株水解圈较大且明显的单菌落。

图1 CMC-Na和MCC对纤维素降解菌的初筛培养Fig.1 Cellulolytic bacteria preliminary screening culture by CMC-Na and MCC
2.1.2 复筛结果
由图2可见,通过产水解圈大小和透明度的初步观察,分别筛选出2株产水解圈相对较好的单菌落,分别命名为MCC菌株和CMC-Na菌株。它们都能在以纤维素二糖为唯一碳源的培养基上生长。
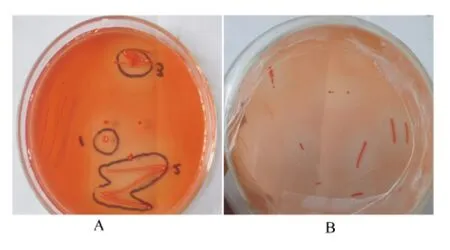
图2 2株产水解圈的单菌落Fig.2 Two strains of single colonies producing hydrolysis circle
2.2 纤维素酶活力
由表1可见,MCC菌株和CMC-Na菌株的纤维素酶活力分别为6.599和5.268 U/mL。

表1 2株纤维素降解菌的纤维素酶活力Table 1 Cellulolytic enzyme activity of two strains of cellulolytic bacteria U/mL
2.3 电泳图结果分析
由图3-A可见,总DNA成功提取。PCR产物使用琼脂糖凝胶电泳检测(图3-B),约为1 500 bp,与预期长度一致。验证正确的转化子(图4)提取质粒后生工生物工程(上海)有限公司进行测序(图5和图6)。
测序结果整理后,登陆NCBI,在GenBank数据库中用Blast对测序所得到的序列进行同源性比对分析,记录同源性最高菌株的GenBank登录号。经过软件NTIVector比对,CMC-Na菌株和MCC菌株的一致性为99.4%。它们都与酪酸梭状芽孢杆菌(Clostridium butyricum)具有很高的同源性,皆为99%。所得序列经ClustalX 1.81软件校正对齐后运用MEGA 4.1软件的相邻计算法[9]构建系统发育树,结果见图7和图8,从中可以看出,MCC菌株、CMC-Na菌株和酪酸梭状芽孢杆菌的亲缘关系最近。结果证明MCC菌株和CMC-Na菌株都属于梭菌属(Clostridium)。

图3 提取的总DNA(A)和16S r DNA的PCR产物(B)Fig.3 Extracted total DNA(A)and PCR product of 16SrDNA(B)
3 讨论
有研究报道,目前已经筛选到的中温厌氧纤维素降解细菌主要出现在6个属中:梭菌属(如C.papyrosolves[11]、C.cellulolyticum[12])、拟 杆 菌 属(Bacteroides,如 B.cellulo.solvens)、醋弧菌属(Acetivibrio,如 A.cellulolyticus)、运动杆菌属(Eubacterium,如E.cellulosolvens)、瘤胃球菌属(Ruminococcus,如 R.albus)、盐胞菌属(Halocella,如 H.cellulolytica)[10]。

图4 转化子的PCR产物Fig.4 PCR product of the transformant

图5 MCC菌株的序列Fig.5 Sequence of MCC strain

图6 CMC-Na菌株的序列Fig.6 Sequence of CMC-Na strain

图7 MCC菌株16Sr DNA系统发育树Fig.7 16S rDNA phylogenetic tree of MCC strain
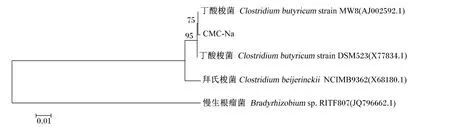
图8 CMC-Na菌株16Sr DNA系统发育树Fig.8 16S rDNA phylogenetic tree of CMC-Na strain
酪酸梭状芽孢杆菌(Clostridium butyricum),即丁酸梭菌,属于梭菌属,革兰氏阳性厌氧芽孢杆菌。可从于人和动物肠道、干酪和自然酸奶、土壤获得。酪酸梭菌在动物体内定植生长,能产生多种酶。其产生的β-淀粉酶、α-淀粉酶、脂酶、蛋白酶、半纤维素酶、纤维素酶等,可促进动物对多糖、脂肪、蛋白质、半纤维素、纤维素等消化吸收[13]。
本试验从竹鼠肠道中分离出2株厌氧纤维素降解菌同属梭菌属,并且其同源性与酪酸梭菌相接近。试验过程中还发现,混合菌株产水解圈比较大,而分离培养的菌株产水解圈相对较小且透明度不佳。目前,对于产纤维素降解酶的复合微生物体系[14-16]和分筛混合菌测酶活力[17-18]的研究已经有报道。本试验基础上,可以通过测定不同发酵时间、碳源、氮源、接种量、温度及初始pH对菌株产酶活力的影响,对产酶条件进行优化,从而确定这2株纤维素降解菌最佳产酶条件。
4 结论
从竹鼠盲肠中成功筛选出2株纤维素降解菌,具有较高的纤维素酶活力,经鉴定确定属于梭菌属。
[1] KANG M S,IM W T,JUNG H M,et al.Cellulomonas composti sp.nov.a cellulolytic bacterium isolated from cattle farm compost[J].International Journal of Systematic and Evolutionary Microbiology,2007,57(6):1256-1260.
[2] TRIPATHI V K,SEHGAL J P,PUNIYA A K,et al.Hydrolytic activities of anaerobic fungi from wild blue bull(Boselaphus tragocamelus)[J].Anaerobe,2007,13(1):36-39.
[3] THAREJA A,PUNIYA A K,GOEL G,et al.In vitro degradation of wheat straw by anaerobic fungi from small Ruminants[J].Archives of Animal Nutrition,2006,60(5):412-417.
[4] 何明清,程安春.动物微生物生态学[M].成都:四川科学技术出版社,2004:156-157.
[5] 刘占英,侯先志,刘玉承,等.一株分解纤维素的肠球菌的分离鉴定[J].内蒙古大学学报:自然科学版,2008,39(2):166-171.
[6] JOBLIN K N.Isolation,enumeration,and maintenance of rumen anaerobic fungi in roll tubes[J].Applied and Environmental Microbiology,1981,42(6):1119 -1122.
[7] 张龙翔,张庭芳,李令嫒.生化实验方法与技术[M].2版.北京:高等教育出版社,1999.
[8] 张武先,王金华,熊智思,等.思茅松毛虫2龄幼虫肠道好氧细菌的筛选及毒力测定[J].安徽农业科学,2011,39(28):17288-17290.
[9] THOMPSON JD,GIBSON T J,PLEWNIAK F,et al.The CLUSTAL_X windows interface:flexible strategies for multiple sequence alignment aided by quality analysis tools[J].Nucleic Acids Research,1997,25(24):4876-4882.
[10] 罗辉,仇天雷,马诗淳,等.一株中温厌氧纤维素降解细菌的分离、鉴定及其系统发育分析[J].中国沼气2008,26(3):3-7.
[11] PETITDEMANGE E,CAILLET F,GIALLO J,et al.Clostridium cellulolyticum sp.nov.,a cellulolytic,mesophilic:species from decayed grass[J].International Journal of Systematic and Evolutionary Microbiology,1984,34(2):155-159.
[12] MADDEN R H,BRYDER M J,POOLE N.Isolation and characterization of an anaerobic,cellulolytic bacterium,Clostridium papyrosolvens sp.nov.[J].International Journal of Systematic and Evolutionary Microbiology,1982,32(1):87-91.
[13] 刘亭婷,王晓霞.酪酸梭菌的作用机理及其在动物生产中的应用[J].中国饲料,2012(4):9-11.
[14] 蒲一涛,钟毅沪,周万龙.固氮菌和纤维素分解菌的混合培养及对生活垃圾降解的影响[J].环境科学与技术1999(1):15-18.
[15] 张晓昱,杜甫佑,王宏勋,等.不同木质纤维素基质上白腐菌降解特性的研究[J].微生物学杂志2004,24(6):4-7.
[16] 杨艳红,郑一敏,王伯初,等.多菌种固体共发酵生物软化稻壳的研究[J].微生物学通报,2004,31(4):14-18.
[17] 牛俊玲,崔宗均,李国学,等.高效纤维素降解菌复合系的筛选构建及其对秸秆的分解特性[J].农业环境科学学报,2005,24(4):795-799.
[18] 王伟东,崔宗均,牛俊玲,等.一组木质纤维素分解菌复合系的筛选及培养条件对分解活性的影响[J].中国农业大学学报,2004,5(9):7-11.
