吉西他滨对Beclinl基因沉默的人胰腺癌MiaPaCa-2细胞的周期及凋亡的影响
2014-08-04李宏宇李晓姝王立生杨月峰郭晓钟
李宏宇 李晓姝 王立生 杨月峰 郭晓钟
胰腺癌的发生、发展及转移与其细胞生物学的调控有关,并与细胞坏死、凋亡及自噬存在密切联系。Beclin1基因参与细胞自噬的调控,在肿瘤形成及发展过程中具有重要作用[1-3]。研究提示,胃癌、前列腺癌、乳腺癌等多种肿瘤细胞存在Beclin1自噬基因的缺陷,导致了肿瘤细胞逃避自噬性死亡,且发现某些抗肿瘤药物可能通过自噬机制在肿瘤治疗方面发挥作用,但在胰腺癌方面尚缺乏相关的研究报道。吉西他滨是目前用于治疗胰腺癌的一线药物。本研究观察吉西他滨对Beclin1基因沉默的人胰腺癌细胞系MiaPaCa-2细胞周期及凋亡的影响,为胰腺癌的基因治疗提供一定的实验基础。
材料与方法
一、质粒的构建及细胞转染
根据siRNA设计原理,由上海吉玛制药技术有限公司合成3条靶向Beclin1基因的siRNA(siBecl)、阴性对照siRNA(siNC)及荧光标记的siRNA(siFAM)。筛选干扰效果最好的siBecl序列构建表达质粒U6/Neo-siBec1、阴性对照质粒pGPU6/Neo-siNC及荧光对照质粒pGPU6/GFP/Neo-siFAM。载体由上海吉玛制药技术有限公司构建。
人胰腺癌细胞系MiaPaCa-2由军事医学科学院提供,常规条件下培养、传代。取对数生长期细胞,采用Lipofectamin2000(Invitrogen 公司)将3种质粒分别转染细胞。先瞬时转染,48 h,再在培养上清液中加入400 μg/ml的G418筛选稳定转染细胞,3~4 d,换含G418的培养液一次,18 d后收集细胞,提取蛋白,置-20℃冰箱保存。
此外,转染siBecl的MiaPaCa-2细胞的培养液中加入0.4 μg/ml吉西他滨(法国礼来公司)继续培养24 h,以未加吉西他滨处理的转染siBecl的MiaPaCa-2细胞作为对照。
二、Beclin1蛋白和mRNA表达的检测
采用常规蛋白质印迹法检测Beclin1蛋白表达,以β-actin作为内参。兔抗Beclin1单抗为Reagents 公司产品,兔抗Actin抗体以及羊抗兔IgG多抗为Santa Cruz公司产品。
应用Trizol试剂盒(Invitrogen公司)提取各组细胞总RNA,按照试剂盒说明书操作。先逆转录成cDNA,再行实时PCR检测Beclin1mRNA表达,RT-PCR试剂盒为Fermentas(中国)公司产品。根据GenBank的Beclin1基因上游调控区序列,由Invitrogen 公司合成Beclin1引物,上游序列5′-GGTGTCTCTCGCAGATTCATC-3′,下游序列5′-TCAGTCTTCGGCTGAGGTTCT-3′。 以β-actin作为内参。PCR反应条件:95℃ 2 min,95℃ 20 s、65℃ 20 s、72℃ 30 s,40个循环。60~90℃间每升温0.2℃维持2 s。mRNA表达量通过公式2-ΔΔCt计算,以shNC转染细胞的表达量为1.0。
三、细胞凋亡检测
收集转染后48 h的细胞至EP管,1 000 r/min、4℃离心10 min,弃上清。加入1 ml预冷PBS,轻轻震荡以悬浮细胞,1 000 r/min 4℃离心10 min,弃上清,重复2次。在各管中加200 μl Binding Buffer,轻轻吹悬,再各加入10 μl Annexin V-FITC(北京众康志恒生物公司),轻轻混匀,移至玻璃试管中,室温避光反应15 min。加入300 μl Binding Buffer、10 μl PI,反应5 min后(1 h内)上流式细胞仪检测细胞凋亡。
四、细胞周期分析
收集转染shBecl及shNC后48 h的细胞及经吉西他滨处理24 h的转染shBecl的细胞至EP管,1 000 r/min 4℃离心10min,弃上清,同上法用预冷PBS洗涤细胞3次,加入70%乙醇(PBS稀释)4℃固定24 h,1 000 r/min 4℃离心5 min后去上清,PBS洗2次,移至玻璃试管中,加入2 μl RNase(10 mg/ml)、0.5%的PI ,4℃避光20 min,上流式细胞仪检测细胞周期。
五、统计学处理
结 果
一、细胞转染效率
通过波长480 nm的蓝光激发,FAM-siRNA在荧光显微镜下显示为绿色荧光(图1)。转染率达75%。
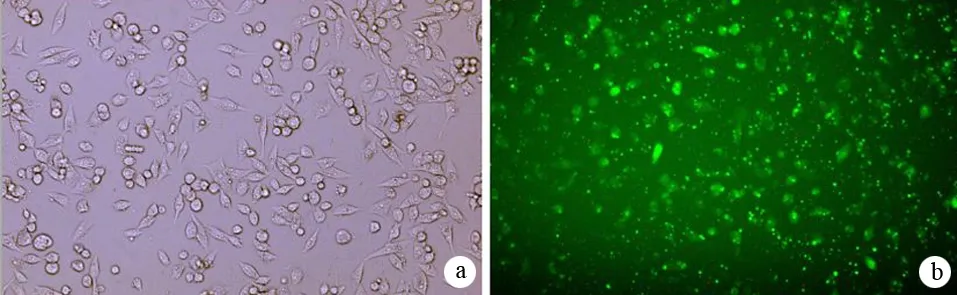
图1 FAM-siRNA转染MiaPaCa-2细胞后6 h的光镜(a)及荧光镜(b)图(×100)
二、转染后细胞Beclin1蛋白和mRNA的表达
3条siBecl插入质粒后转染MiaPaCa-2细胞,以转染插入siBecl-3质粒的MiaPaCa-2细胞的Beclin1蛋白表达最低(图2),抑制效果最佳。后续实验均取该质粒转染的细胞进行。
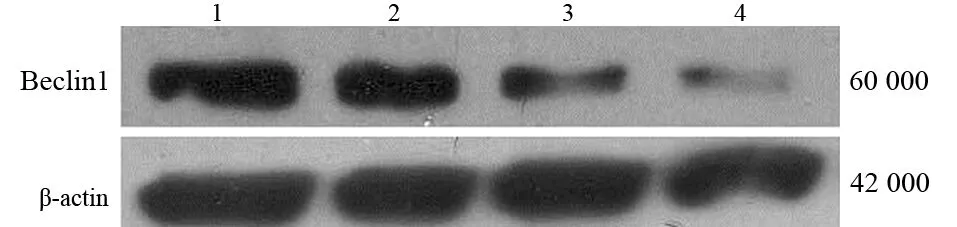
图2 阴性对照siRNA(1)及3条靶向Beclin1基因的siRNA(2、3、4)转染MiaPaCa-2细胞48 h后Beclin1蛋白的表达
转染siNC质粒细胞的Beclin1 mRNA表达量为1.0,转染siBecl质粒细胞的Beclin1 mRNA表达量为0.295,表达明显受到抑制(图3)。

图3 转染siBecl质粒48 h后MiaPaCa-2细胞Beclin1 mRNA的表达
三、吉西他滨对Beclin1基因沉默的MiaPaCa-2细胞周期的影响
转染siBecl质粒的MiaPaCa-2细胞的S、G2期细胞数较转染siNC质粒的MiaPaCa-2细胞减少,而G1期细胞增多(表1)。转染siBecl质粒的MiaPaCa-2细胞经吉西他滨处理后,其S期细胞数较吉西他滨未处理的转染siBecl质粒的MiaPaCa-2细胞进一步减少,而G1、G2期细胞增多(表1)。
四、吉西他滨对Beclin1 基因沉默的MiaPaCa-2细胞凋亡的影响
Beclin1基因沉默的MiaPaCa-2细胞经吉西他滨处理后,细胞凋亡率被显著抑制(0.06%比29.13%,P<0.01,图4)。

图4 转染siNC(a)和转染siBec1(b)细胞经吉西他滨处理后的凋亡细胞数
讨 论
肿瘤的发生、发展是细胞无限增殖和凋亡受抑制的结果,自噬与凋亡之间存在着复杂的联系,并参与肿瘤发生的调控。Beclinl主要通过与Ⅲ型PI3K形成复合体的途径调节其他自噬相关蛋白在自噬前体结构中定位,从而调节自噬活性[4]。Beclin1有4个重要的结构域,它们分别与UVRAG、Vps34、Ambra1、Bcl-2蛋白形成复合体,其中Bcl-2与Beclin1的BH3结构域结合后对自噬起负性调节作用[5]。已有研究显示,Beclin1与凋亡抑制因子Bcl-2相互发生作用,并与Bcl-2蛋白的拮抗因子Bax以及Bax相互作用因子-1(Bif-1)作用均可以促进细胞自噬,其中Bif-1通过UVRAG与Beclin1相互结合,正向调节PI3K通路。Beclin1基因缺失或Bif-1基因敲除后肿瘤的形成率显著增高。自噬对于肿瘤凋亡究竟起促进作用还是抑制作用目前尚不清楚。本研究结果显示,Beclin1基因沉默后MiaPaCa-2细胞的凋亡未受到明显影响,提示可能存在更为复杂的调节机制。有研究显示,处于G0、G1期的肿瘤细胞Bcl-2表达明显增加,通过其抑制细胞凋亡而延长生存期,增加癌基因突变的可能性[6]。本研究也显示,Beclin1基因沉默后明显影响了肿瘤细胞的周期分布,但是否与Bcl-2的调节作用有关,有待于进一步研究证实。
表1 转染siBecl及siNC的Mia PaCa-2细胞给于吉西他滨处理前后的细胞周期分布
吉西他滨是一种目前用于治疗胰腺癌疗效显著的细胞周期特异性抗代谢类抗癌药。它主要作用于DNA合成期(即S期)的肿瘤细胞,也可以阻断细胞由G1期向S期进展。它在细胞内经核苷激酶转化为具有活性的二磷酸盐(dFdCDP)和三磷酸盐(dFdCTP),抑制DNA的合成。本研究结果显示,吉西他滨处理Beclin1基因沉默的MiaPaCa-2细胞可导致细胞周期阻滞于S期,提示Beclin1的沉默可能影响了吉西他滨的正常生物学效应,即Beclin1可能有拮抗吉西他滨抑制胰腺癌细胞的生长作用。当然亦可能由于质粒中的序列片段影响了吉西他滨抑制肿瘤细胞DNA合成的途径。虽然Beclin1基因沉默对MiaPaCa-2细胞的凋亡未产生影响,但却明显抑制了吉西他滨诱导的MiaPaCa-2细胞凋亡。Wen等[7]报道,自噬与Caspase依赖的细胞凋亡发生相关,Beclin1可通过增强Caspase-9的活性参与化疗药物CDDP诱导的人胃癌细胞MKN28的凋亡;肿瘤坏死因子相关的凋亡诱导配基TRAIL在人乳腺上皮细胞MCF-10A组织的形成过程中,诱导自噬形成也伴随着Caspase依赖的细胞凋亡发生[8]。本基因中Beclin1抑制吉西他滨诱导的MiaPaCa-2细胞凋亡的机制是否可能通过Caspase途径来实现尚需进一步研究。
参 考 文 献
[1] Qu X, Yu J, Bhagat G, et al. Promotion of tumorigenesis byheterozygous disruption of the beclin 1 autophagy gene[J]. J Clin Invest, 2003, 112(2):1809-1820.
[2] Amaravadi RK, Yu D, Lum JJ, et al. Autophagy inhibition enhances therapy-induced apoptosis in a Myc-induced model of lymphoma[J]. J Clin Invest, 2007, 117(2):326-336.
[3] Mizushima N, Levine B, Cuervo AM, et al. Autophagy fights disease through cellular self-digestion[J]. Nature, 2008, 451(7182):1069-1075.
[4] Meijer AJ, Codogno P. Regulation and role of autophagy in mammalian cells[J]. Int J Biochem Cell Biol, 2004, 36(12): 2445-2462.
[5] Sinha S, Levine B. The autophagy effector Beclin 1: a novel BH3-only protein[J]. Oncogene,2008,27(Suppl1):S137-S148.
[6] Kawasaki H, Toyoda M, Shinohara H, et al. Expression of survivin correlates with apoptosis, proleterati, and anglogenesis during human colorectal tumorigenesis[J]. Cancer, 2001, 91(11): 2026-2032.
[7] Wen X, Lin ZQ, Liu B, et al. Caspase-mediated programmed cell death pathways as potential therapeutic targets in cancer[J]. Cell Prolif, 2012, 45(3): 217-224.
[8] Marquez RT, Xu L. Bcl-2:Beclin 1 complex: multiple, mechanisms regulating autophagy/apoptosis toggle switch[J]. Am J Cancer Res, 2012, 2(2): 214-22.
