STAT3基因沉默对人胰腺癌SW1990细胞的裸鼠移植瘤生长的影响
2014-08-04徐向辉盛金鑫张坤东黄陈
徐向辉 盛金鑫 张坤东 黄陈
信号转导与转录激活因子3(signal transduction and activators of transcription, STAT3)是细胞内一关键的信号转导与转录激活蛋白,当其上游Janus激酶被细胞因子或生长因子激活后,进而激活STAT3,形成磷酸化STAT3(p-STAT3),2个p-STAT3分子相互作用形成二聚体进入细胞核,通过调控肿瘤细胞的增殖、凋亡、血管新生等参与肿瘤的进展,目前已经被定义为癌基因[1-2]。研究证实,STAT3和p-STAT3在胰腺癌组织中过表达,且p-STAT3与血管内皮生长因子(vascular endothelial growth factor,VEGF)的表达及微血管密度(microvessel density,MVD)相关[3-4],提示STAT3的激活在胰腺癌血管生成中起重要作用。本研究采用RNA干扰技术抑制SW1990细胞STAT3基因的表达,观察基因沉默后对细胞增殖及裸鼠移植性胰腺癌生长的影响,探讨其相关机制。
材料与方法
一、STAT3 shRNA表达载体的构建及细胞转染
参考Genscript公司设计siRNA的在线软件,选取针对STAT3编码区1819~1837、1025~1043、237~255三段碱基序列作为RNA干扰靶序列,将其插入pRNAT-U6.1/Neo质粒中,构建重组质粒pRNAT-STAT3 shRNA-Ⅰ、pRNAT-STAT3 shRNA-Ⅱ和pRNAT-STAT3 shRNA-Ⅲ,并同时设计阴性对照序列,构建阴性对照重组质粒pRNAT-Con。前期研究证明pRNAT-STAT3 shRNA-Ⅱ对STAT3具有最好的沉默效果[5],因此本研究选取pRNAT-STAT3 shRNA-Ⅱ稳定转染细胞。人胰腺癌细胞株SW1990购自ATCC(American Type Culture Collection),常规培养、传代。取对数生长期SW1990细胞,以每孔2×105个接种于6孔培养板中,按照Invitrogen公司说明书配制质粒-脂质体复合物,并转染细胞。应用G418(500 μg/ml)筛选稳转细胞株。实验分为SW1990组、SW1990-Con组和SW1990-RNAi组。
二、蛋白质印迹法
取各组对数生长期细胞,采用Santa Cruz公司的细胞总蛋白抽提试剂盒和Active Motif公司的细胞核蛋白抽提试剂盒分别提取各组细胞的总蛋白和核蛋白。采用常规蛋白质印迹法检测细胞的STAT3、VEGF、基质金属蛋白酶2(matrix metalloproteinase-2, MMP-2)蛋白的表达,以β-actin为内参。兔抗人STAT3、VEGF、MMP-2多抗分别购自Cell Signal公司及Santa Cruz公司,工作浓度均为1∶1000;羊抗兔辣根过氧化物酶耦联二抗购自Santa Cruz公司,工作浓度1∶5000。最后ECL(Santa Cruz公司)发光,X线曝光。以BAND SCAN图像分析软件扫描灰度值,目的条带与β-actin条带的灰度比值表示蛋白相对表达量。
三、裸鼠皮下移植瘤模型建立
BALB/c nu/nu裸鼠购自中国科学院上海实验动物中心,饲养于SPF级环境中。按完全随机法分为SW1990组、SW1990-Con组、SW1990-RNAi组,每组6只。于裸鼠右侧背部皮下组织分别注射100 μl(1×108/ml)SW1990细胞、SW1990-Con细胞、SW1990-RNAi细胞。饲养35 d后处死裸鼠,取肿瘤称重,用10%甲醛固定。
四、移植瘤MVD测定
取固定的移植瘤组织,采用免疫组织化学染色法检测移植瘤组织CD34的表达,以PBS代替一抗作为空白对照。参照Maeda等[6]方法计算MVD,即先在低倍镜(10×10)下寻找微血管最密集的区域,然后于高倍镜(10×40)下取5个视野观察,以CD34阳性的单个血管内皮细胞或血管内皮细胞丛作为一个可以计数的微血管,分别计数每个视野的微血管数,取均值。
五、统计学处理
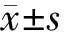
结 果
一、各组SW1990细胞STAT3、VEGF、MMP-2蛋白的表达
SW1990组、SW1990-Con组、SW1990-RNAi组细胞的STAT3蛋白表达量分别为84.69±9.31、82.00±7.76、7.93±1.24(图1),VEGF蛋白表达量分别为82.94±8.97、80.86±10.28、39.04±6.23,MMP-2蛋白表达量分别为40.88±5.09、38.26±5.71、12.54±2.15。SW1990-RNAi组细胞的表达量均显著低于SW1990组(F分别为115.094、24.547、35.014,P值均<0.05),而SW1990-Con组与SW1990组间细胞的3种蛋白表达量的差异均无统计学意义。
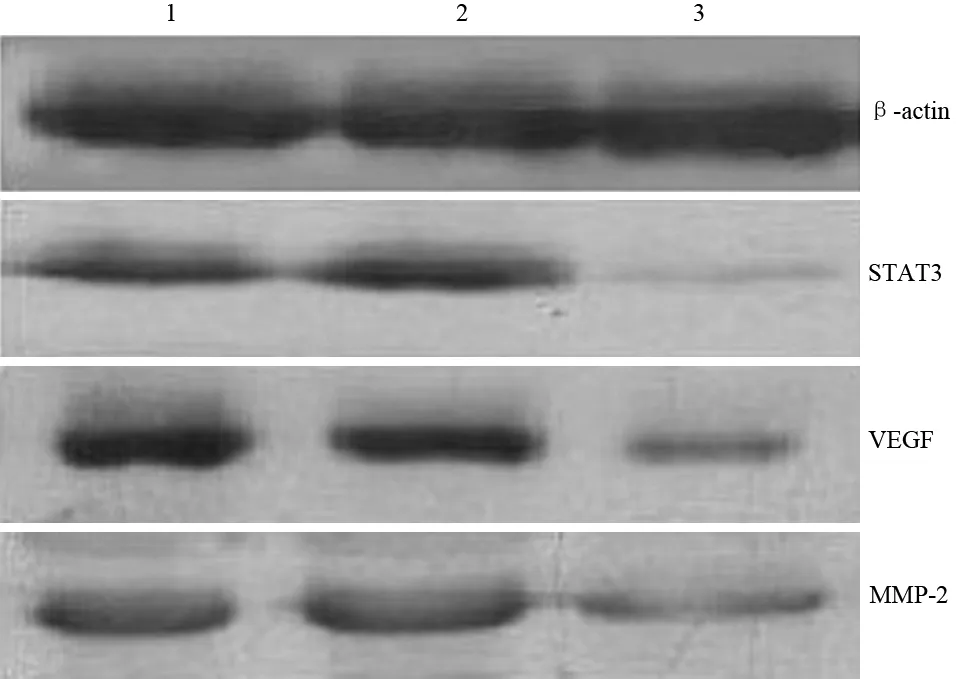
图1 SW1990组(1)、SW1990-Con组(2)、SW1990-RNAi组(3)细胞STAT3蛋白的表达
二、各组裸鼠移植瘤的生长
注射SW1990、SW1990-Con细胞的裸鼠背部移植瘤体积较大,而注射SW1990-RNAi细胞的裸鼠移植瘤体积较小(图2),3组移植瘤的重量分别为(2.2±0.4)、(2.2±0.3)、(0.5±0.3)g,SW1990-RNAi组的瘤重显著低于SW1990组和SW1990-Con组,差异有统计学意义(P<0.05),而SW1990组与SW1990-Con组间的差异无统计学意义。此外,SW1990组和SW1990-Con组的肿瘤血供丰富、质脆,而SW1990-RNAi组的肿瘤血管稀少,并有明显纤维化形成。
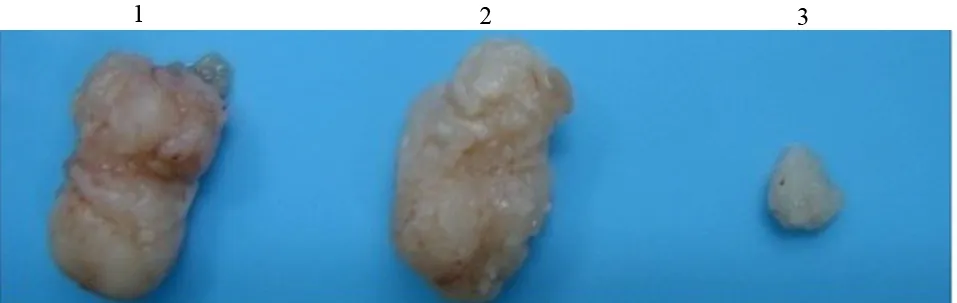
图2 SW1990组(1)、SW1990-Con组(2)、SW1990-RNAi组(3)裸鼠的移植瘤标本
三、各组裸鼠移植瘤的MVD
SW1990组、SW1990-Con组、SW1990-RNAi组移植瘤的MVD分别为每高倍视野(20.35±2.41)、(18.79±1.94)、(9.62±1.06)个(图3),SW1990-RNAi组显著少于其他两组,差异有统计学意义(F=25.299,P<0.01),而其他两组间的差异无统计学意义。
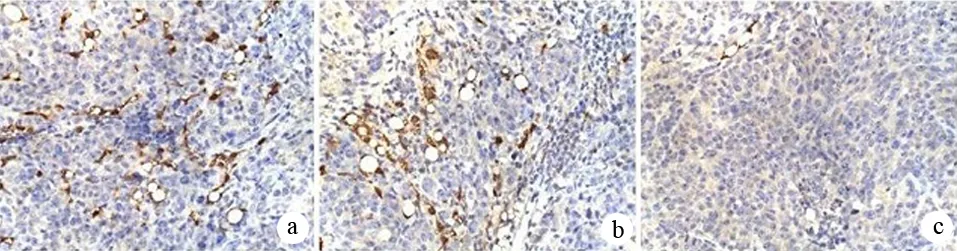
图3 SW1990组(a)、SW1990-Con组(b)、SW1990-RNAi组(c)移植瘤的MVD(免疫组化 ×100)
讨 论
研究表明,STAT3在多种肿瘤组织与细胞系中异常表达和激活,并与肿瘤的增殖分化、细胞凋亡、血管生成、侵袭转移和免疫逃逸密切相关[1-2]。
血管生成是一个多步骤的复杂过程,包括血管内皮细胞增殖、血管外基质降解、内皮细胞迁移及形成管腔等一系列过程[7]。肿瘤血管生成是肿瘤细胞生长和转移的基础,没有营养血管的支持,肿瘤直径一般不会超过2 mm[8]。肿瘤MVD是衡量肿瘤血管生成程度的标志,大量研究表明MVD是反映肿瘤预后的一个独立因素,高MVD往往提示预后不良或复发转移。
血管生成过程受许多细胞因子的调控,其中VEGF是目前已知最重要的促血管生成因子,调控着包括内皮细胞增殖、迁移、管腔形成等重要环节[9]。有研究报道,VEGF是血管内皮细胞强有力和特有的有丝分裂原,与胰腺癌的血管新生和预后密切相关[10]。Niu等[11]证实VEGF是STAT3的下游靶基因,并发现反义寡核苷酸阻断肿瘤细胞中STAT3的信号转导可下调VEGF的表达,抑制肿瘤新生血管形成。
在肿瘤的血管形成过程中,血管外基质降解、内皮细胞迁移亦起着重要作用。蛋白水解酶通过降解细胞外基质和基底膜,促进内皮细胞迁移,在肿瘤的血管形成中起着重要作用。MMP-2是蛋白水解酶的一种,与胰腺癌的血管形成和侵袭转移密切相关[12]。Xie等[13]证实MMP-2是STAT3下游靶基因,并发现STAT3可调控恶性黑色素瘤细胞中MMP-2表达,促进恶性黑色素瘤的血管形成和侵袭转移。
本研究应用RNAi技术抑制SW1990细胞的STAT3基因表达,并建立稳转的SW1990细胞株和裸鼠移植瘤模型。结果显示,SW1990细胞的STAT3表达被抑制后,细胞的VEGF和MMP-2表达下调,形成的裸鼠移植瘤的血管生成减少,瘤组织的MVD降低。提示STAT3信号通路在胰腺癌发生、发展中起着重要作用,沉默STAT3基因表达后能明显降低裸鼠移植瘤的生长,其机制可能通过下调VEGF及MMP-2的表达、抑制肿瘤血管生成所致。
参 考 文 献
[1] Haura EB,Turkson J,Jove R.Mechanisms of disease:Insights into the emerging role of signal transducers and activators of transcription in cancer[J].Nat Clin Pract Oncol,2005,2(6):315-324.
[2] Jing N,Tweardy DJ.Targeting Stat3 in cancer therapy[J]. Anticancer Drugs,2005,16(6):601-607.
[3] 黄陈,裘正军,孙晶, 等. p-STAT3与MMP-2、MMP-9在胰腺癌组织中表达及其临床意义[J]. 中华肝胆外科杂志,2007,13(12):851-853.
[4] 刘辰, 裘正军, 孙红成, 等. STAT3和VEGF在胰腺癌中的表达及其临床意义[J].中华肝胆外科杂志, 2006, 12(7): 471-473.
[5] 裘正军, 黄陈, 裘玮,等. STAT3短发卡RNA表达载体对胰腺癌细胞增殖凋亡的影响[J].中华普通外科杂志,2007,22(2):126-129.
[6] Maeda K, Chung YS, Ogawa Y, et al. Prognostic value of vascular endothelial growth factor expression in gastric marcinoma[J]. Cancer, 1996,77(5):858-863.
[7] Folkman J. Fundamental concepts of the angiogenic process[J]. Curr Mol Med, 2003,3(7):634-651.
[8] Folkman J. Angiogenesis in cancer, vascular, rheumatoid and other disease[J]. Nat Med, 1995, 1(1): 27-31.
[9] Carrato A, Galleqo-Plazas J, Guillen-Ponce C. Anti-VEGF therapy: a new approach to colorectal cancer therapy[J].Expert Rev Anticancer Ther, 2006, 6(10):1385-1396.
[10] Niedergethmann M, Hildenbrand R, Wostbrock B, et al. High expression of vascular endothelial growth factor predicts early recurrence and poor prognosis after curative resection for ductal adenocarcinoma of the pancreas[J]. Pancreas, 2002, 25(2):122-129.
[11] Niu G, Wright KL, Huang M, et al. Constitutive Stat3 activity up-regulates VEGF expression and tumor angiogenesis[J]. Oncogene, 2002, 21(13): 2000-2008.
[12] Matsuyama Y, Takao S, Aikou C, et al. Comparison of matrix metalloproteinase expression between primary tumors with or without liver metastasis in pancreatic and colorectal carcinomas[J]. J Surg Oncol, 2002, 80(2):105-110.
[13] Xie TX, Wei D, Liu M, et al. Stat3 activation regulates the expression of matrix metalloproteinase-2 and tumor invasion and metastasis[J]. Oncogene, 2004, 23(20):3550-3560.
