用一种新方法检测尼古丁减轻鱼藤酮对UPS的毒性
2014-06-27邓永宁屈秋民
石 婕,邓永宁,刘 洁,屈秋民
(西安交通大学医学院第一附属医院神经内科,陕西西安 710061)
帕金森病(Parkinson’s disease, PD)是一种以震颤、强直、运动迟缓为特征的常见的神经系统变性疾病,特征性病理改变为中脑黑质纹状体多巴胺能神经元进行性缺失,残存神经元胞质内出现α-Synuclein聚集形成的Lewy小体。泛素-蛋白酶系统(ubiquitin-proteasome system, UPS)是真核细胞内一条重要的蛋白降解途径,可降解细胞内突变、损伤、错位及有害的蛋白质,维持细胞的正常功能。当UPS功能障碍时,异常蛋白不能得到及时降解而大量累积,会给细胞带来很大毒性作用[1]。大量研究[2]证明,PD患者残存细胞内α-Synuclein聚集和Lewy小体形成与UPS功能障碍密切相关。目前,检测UPS活性主要是测定UPS环路中各个亚单位的含量和功能,不能反映UPS的整体功能,也不能进行动态检测,存在一定的局限性。本研究将采用一种新的方法,进行动态、全面的测量UPS的活性,并初步探讨尼古丁对鱼藤酮诱导的UPS功能障碍的影响。
1 材料与方法
1.1CL1-pEGFP-C1质粒的构建参考NONAKA等[3]的研究,选择5′-TCGAGCTTGTAAAAATTGGTTTTCTTCTTTATCTCATTTTGTTATTCA-TTTATAAG-3′和5′-GATCCTTATAAATGAAT-AACAAAATGAGATAAAGAAGAAAACCAAT-TTTTACAAG-3′作为插入序列CL1,由西安晶彩生物技术有限公司负责合成鉴定。将两条寡核苷酸链溶解于退火缓冲液,95 ℃加热15 min,缓慢降至室温,得到编码蛋白酶体降解信号CL1(ACKNWFSSLSHFVIHL)的DNA片断。将该片段与BamHⅠ和XhoⅠ双酶切的质粒pEGFP-C1连接,得到CL1-pEGFP-C1质粒。将改建的质粒转化入DH5α感受态细菌, 挑选单菌落送西安晶彩生物技术有限公司测序鉴定。选择序列正确的质粒扩增,提取CL1-pEGFP-C1质粒DNA。
1.2CL1-pEGFP-C1稳定转染细胞系的建立用TurbofectinvitroTransfection Reagent将CL1-pEGFP-C1质粒转染入PC12细胞,于37 ℃、50 mL/L CO2培养箱中培养48 h后,用含有800 μg/mL G418的培养基继续培养,每2~3 d更换一次培养基。2周后,无菌微量枪头挑取转染形成的单克隆,于96孔板中继续培养。如此挑取多个细胞克隆后,以维持剂量400 μg/mL G418继续筛选,继续培养2~4周后,建立稳定表达CL1-pEGFP-C1的细胞系。
1.3采用蛋白酶体抑制剂处理转染细胞将CL1-pEGFP-C1转染细胞接种于6孔细胞培养板,培养24 h,待细胞生长至70%~80%丰度时,分别加入不同剂量(1、10、100 μmol/L)的蛋白酶体抑制剂MG132,继续培养24 h,荧光显微镜观察细胞内GFP荧光强度,或提取细胞质进行免疫印迹,观察GFP表达。
1.4采用尼古丁和鱼藤酮处理转染细胞CL1-pEGFP-C1转染细胞接种于6孔细胞培养板,培养24 h,待细胞生长至70%~80%丰度时,分别加入不同剂量(1×10-6mol/L、1×10-4mol/L )尼古丁预处理30 min后给予鱼藤酮(5×10-6mol/L)继续培养24 h,或者直接给予鱼藤酮(5×10-6mol/L)培养24 h,随后用荧光显微镜观察检测各组荧光细胞出现的情况及用免疫印迹法观察GFP含量。
1.5荧光显微镜的观察CL1-pEGFP-C1转染细胞于6孔细胞培养板培养24 h,待细胞生长至70%~80%丰度时,进行相应处理,继续培养24 h,荧光显微镜下观察荧光强度并拍照。
1.6免疫印迹分析收集细胞,加细胞裂解液匀浆,转移到离心管中,4 ℃、12 000 r/min离心5 min,取上清以分光光度计检测样品蛋白含量,取等量蛋白样品用100 g/L SDS-PAGE胶进行电泳,恒压将蛋白转至PVDF膜,室温下将PVDF膜在含50 mL/L奶粉的PBS中封闭1 h,封闭后于兔抗鼠GFP抗体中(1∶800,华肽先锋)4 ℃孵育过夜。然后,在过氧化物酶标记的羊抗兔IgG(1∶5 000,皮尔斯)中孵育1 h,以上两步骤间用PBS充分漂洗。反应后的PVDF膜在化学发光试剂中反应5 min(避光),然后将X光片放在PVDF膜上曝光,手动冲洗胶片。
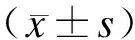
2 结 果
2.1CL1-pEGFP-C1稳定转染细胞系中GFP的表达CL1-pEGFP-C1稳定转染细胞中UPS功能正常,可特异性识别CL1降解信号,从而降解CL1-GFP蛋白,在荧光显微镜下无GFP荧光表达(图1)。

图1CL1-pEGFP-C1稳定转染细胞的荧光显微镜观察
Fig.1 Fluorescent microscopic observation of CL1-pEGFP-C1 cells
2.2MG132对UPS功能的影响应用不同浓度的UPS抑制剂MG132(1、10、100 μmol/L)处理CL1-pEGFP-C1转染细胞,荧光显微镜下观察细胞内绿色荧光强度。如图2所示,随着MG132浓度的增高,细胞内绿色荧光强度逐渐增加,提示GFP表达增多。收集细胞提取蛋白质,免疫印迹法检测GFP蛋白表达,可见随着MG132浓度的增高,GFP表达逐渐增多(图3)。
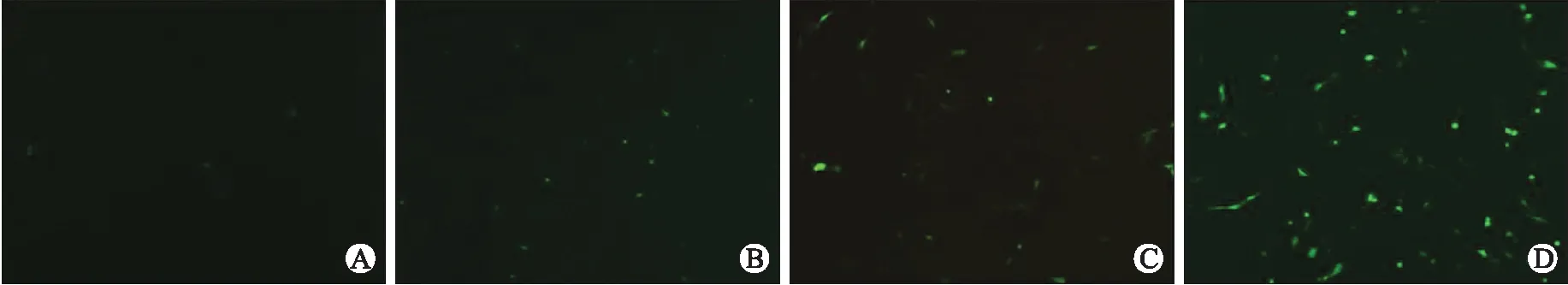
图2不同浓度MG132对CL1-pEGFP-C1转染细胞荧光强度的影响
Fig.2 The effect of MG132 on fluorescent intensity of GFP in CL1-pEGFP-C1 cells
A:CL1-pEGFP- C1转染细胞;B:1 μmol/L MG132处理的CL1-pEGFP-C1转染细胞;C:10 μmol/L MG132处理的CL1-pEGFP-C1转染细胞;D:100 μmol/L MG132处理的CL1-pEGFP-C1转染细胞。
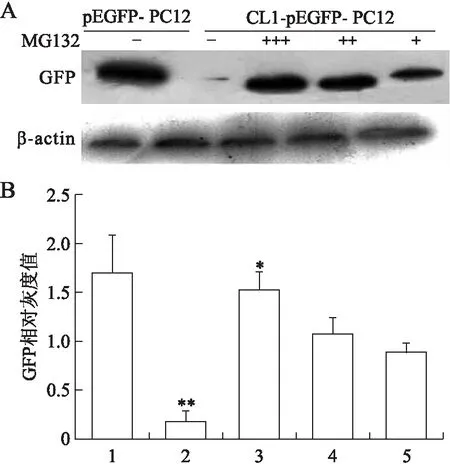
图3不同浓度MG132处理后CL1-pEGFP-C1转染细胞GFP蛋白的表达
Fig.3 GFP protein expression in CL1-pEGFP-C1 cells
1:pEGFP-C1转染细胞;2:CL1-pEGFP-C1转染细胞;3:100 μmol/L MG132处理的CL1-pEGFP-C1转染细胞;4:10 μmol/L MG132处理的CL1-pEGFP-C1转染细胞;5:1 μmol/L MG132处理的CL1-pEGFP-C1转染细胞。**P<0.05,vs. 3、4和5;*P<0.05,vs. 5。
2.3尼古丁和鱼藤酮对UPS功能的影响正常CL1-pEGFP-C1转染细胞无绿色荧光,而鱼藤酮处理后,CL1-pEGFP-C1转染细胞内绿色荧光明显增加。鱼藤酮+低浓度尼古丁处理后,细胞内绿色荧光明显较鱼藤酮单独处理组减少;鱼藤酮+高浓度尼古丁处理后,细胞内绿色荧光进一步减少。提示鱼藤酮可以损害UPS功能,而尼古丁可减轻鱼藤酮引起的UPS功能障碍(图4)。
免疫印迹法检测细胞内GFP表达显示,正常CL1-pEGFP-C1转染细胞GFP表达很少,而鱼藤酮处理组GFP表达明显增加。鱼藤酮+低浓度尼古丁处理组GFP表达明显低于鱼藤酮单独处理组;鱼藤酮+高浓度尼古丁处理组细胞内GFP表达进一步减少。提示鱼藤酮可以抑制UPS功能,减少细胞内GFP降解,而尼古丁可剂量依赖性减轻鱼藤酮引起的UPS功能障碍(图5)。
3 讨 论
UPS是真核细胞内降解异常蛋白的重要途径。UPS功能障碍与PD患者脑内α-Synuclein聚集及Lewy小体形成密切相关,是PD发病的重要环节。调节UPS的功能,对于延缓PD发生、发展具有重要意义。
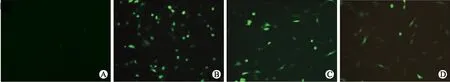
图4尼古丁和鱼藤酮对CL1-pEGFP-C1转染细胞GFP荧光强度的影响
Fig.4 The effect of rotenone and nicotine on fluorescent intensity of GFP in CL1-pEGFP-C1 cells
A:CL1-pEGFP-C1转染细胞;B:5×10-6mol/L鱼藤酮处理的CL1-pEGFP-C1转染细胞;C:5×10-6mol/L鱼藤酮+低浓度尼古丁(1×10-6mol/L)处理的CL1-pEGFP-C1转染细胞;D:5×10-6mol/L鱼藤酮+高浓度尼古丁(1×10-4mol/L)处理的CL1-pEGFP-C1转染细胞。
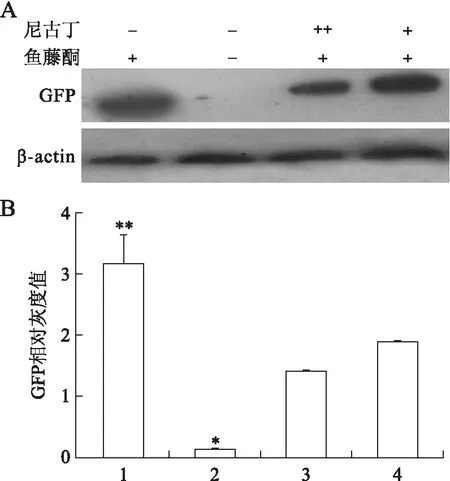
图5尼古丁和鱼藤酮对CL1-pEGFP-C1转染细胞GFP蛋白表达的影响
Fig.5 GFP expression in CL1-pEGFP- C1 cells treated with rotenone and nicotine
1:5×10-6mol/L鱼藤酮处理组;2:CL1-pEGFP-C1转染细胞;3:5×10-6mol/L鱼藤酮+高浓度尼古丁(1×10-4mol/L)处理组;4:5×10-6mol/L鱼藤酮+低浓度尼古丁(1×10-6mol/L)处理组。**P<0.01,vs. 2、3和4;*P<0.01,vs. 3和4。
目前,常用的测量UPS功能的方法有如下几种:一种是给予UPS通路中的关键酶(糜蛋白酶、胰蛋白酶、谷氨酰水解酶)特异性荧光底物,通过荧光酶标仪检测未被分解的底物含量来反映关键酶的活性,从而间接反映UPS的功能[4]。然而, 该方法只能检测UPS中3种关键酶的活性,不能反映UPS降解过程的其他步骤(如泛素化等)。另一种方法是将蛋白酶体降解底物进行同位素标记,体外泛素化后再与蛋白酶体孵育,通过测定放射性的变化反映蛋白酶体活性[5]。但是,该方法同样不能反映降解底物的泛素化等过程。还有研究通过测量UPS中某些组分含量来反映UPS功能,但这样不能全面的反映UPS。而且用以上方法检测组织中的蛋白酶体活性时, 必须将被检测组织制成匀浆,而在某些疾病的发生中,UPS活性的下降只是发生在某种或某些特定细胞中[6],这些检测方法不能检测活细胞内的UPS活性,更不能检测单个细胞内的UPS活性的变化。
GILON等[7]发现了一系列多肽序列, 其可被UPS特异性降解,这类多肽序列称为UPS降解信号。有研究[7]将其中一种被称为CL1的降解信号和GFP融合并转染入细胞,从而使GFP的半衰期明显缩短,用蛋白酶体抑制剂处理可使GFP-CL1在细胞内出现剂量依赖性累积,从而建立了一种检测UPS活性的新方法。我们根据前人的研究将CL1与GFP融合,成功地建立了CL1-pEGFP-C1稳定转染细胞系。当UPS功能正常时,细胞内表达的CL1-GFP蛋白可以迅速被降解,细胞不表达绿色荧光;当UPS功能障碍时,细胞内表达的CL1-GFP蛋白不能被及时降解,细胞表达绿色荧光。蛋白酶体抑制剂MG132可特异性抑制UPS功能,MG132处理后细胞内绿色荧光显著增加,且随着MG132浓度增加,GFP表达剂量依赖性增高。说明本研究建立的CL1-pEGFP-C1稳定转染细胞系能够全面、动态的反映UPS功能。
鱼藤酮诱导的PC12细胞损伤是常用的PD细胞模型,其机制可能与鱼藤酮引起UPS功能障碍,神经元损伤有关。研究发现,鱼藤酮可引起NO和过氧化物水平的升高从而引起UPS功能障碍[8];引起20S蛋白酶体活性降低及20S蛋白酶亚基免疫反应[9],通过被氧化的蛋白或者氧化修饰的蛋白酶体自身聚集来诱导UPS功能障碍[10]。还有研究提示鱼藤酮诱导的UPS功能障碍可能与由氧化应激、微管蛋白障碍引起的蛋白酶体成分降解有关[11]。本研究使用CL1-pEGFP-C1稳定转染细胞系发现,鱼藤酮处理后,细胞内绿色荧光显著增加,免疫印迹检测GFP表达显著增加,证明鱼藤酮可损伤UPS功能,减少细胞内CL1-GFP蛋白的降解。
吸烟是PD的保护因素,可能通过尼古丁与多巴胺能神经元神经末梢上的尼古丁受体(nAChRs)结合发挥作用[12]。有研究显示,尼古丁可上调UPS功能,发挥神经保护作用[13]。KANE等[14]研究发现,尼古丁可上调泛素、泛素结合酶、20S、19S蛋白酶体的功能;人体研究发现,吸烟者的呼吸道上皮中UCHL1含量上升,而UCHL1是UPS的重要组成成分之一[15]。但是,这些研究仅检测UPS中某些成分的含量,而非UPS的整体功能。本研究采用鱼藤酮诱导的PD细胞模型研究发现,尼古丁处理后,细胞内绿色荧光强度较鱼藤酮处理组显著减少,GFP表达显著降低,尤其高浓度尼古丁处理后,细胞内绿色荧光减少及GFP蛋白表达降低更加显著,说明尼古丁可以增加UPS对细胞内CL1-GFP蛋白的降解,可以改善鱼藤酮诱导的UPS功能障碍,从而发挥神经保护作用。
通过本研究,我们建立了一种能够动态、全面观测UPS功能的方法,利用该方法研究发现,鱼藤酮可引起UPS功能障碍,而尼古丁可减轻鱼藤酮的这一毒性作用。为研究UPS在PD发病中的作用以及药物作用的机制提供了有效方法。
参考文献:
[1] MCNAUGHT KS, OLANOW CW, HALLIWELL B, et al. Failure of the ubiquitin-proteasome system in Parkinson’s disease[J]. Nat Rev Neurosci 2001, 2(8):589-594.
[2] EBRAHIMI-FAKHARI D, WAHLSTER L, MCLEAN PJ. Protein degradation pathways in Parkinson’s disease: curse or blessing[J]. Acta Neuropathol, 2012, 124(2):153-172.
[3] NONAKA T, HASEGAWA M. A cellular model to monitor proteasome dysfunction by alpha-synuclein[J]. Biochemistry, 2009, 48(33):8014-8022.
[4] JANA NR, ZEMSKOV EA, WANG GH, et al. Altered proteasomal function due to the expression of polyglutamine-expanded truncated N-terminal huntingtin induces apoptosis by caspase activation through mitochondrial cytochrome c release[J]. Hum Mol Gen, 2001, 10(10):1049-1059.
[5] BENNETT EJ, BENCE NF, JAYAKUMAR R, et al. Global impairment of the ubiquitin-proteasome system by nuclear or cytoplasmic protein aggregates precedes inclusion body formation[J]. Molecular Cell, 2005, 17(3):351-365.
[6] VALERA AG, DIAZ-HERNANDEZ M, HERNANDEZ F, et al. The ubiquitin-proteasome system in Huntington’s disease[J]. Neuroscientist, 2005, 11(6):583-594.
[7] GILON T, CHOMSKY O, KULKA RG. Degradation signals for ubiquitin system proteolysis in Saccharomyces cerevisiae[J]. Embo J, 1998, 17(10):2759-2766.
[8] BENCE NF, SAMPAT RM, KOPITO RR. Impairment of the ubiquitin-proteasome system by protein aggregation[J]. Science, 2001, 292(5521):1552-1555.
[9] SAMANTARAY S, RAY SK, BANIK NL. Calpain activation and moto neuron apoptosis in spinal cord of lewis rats with rotenone-induced experimental parkinsonism[J]. J Neurochem, 2006, 96(8):127.
[10] REN Y, ZHAO JH, FENG J. Parkin binds to alpha/beta tubulin and increases their ubiquitination and degradation[J]. J Neurosci, 2003, 23(8):3316-3324.
[11] CHOU AP, LI S, FITZMAURICE AG, et al. Mechanisms of rotenone-induced proteasome inhibition[J]. Neurotoxicology, 2010, 31(4):367-372.
[12] QUIK M, WONNACOTT S. alpha6 beta2 and alpha4 beta2 nicotinic acetylcholine receptors as drug targets for Parkinson's disease[J]. Pharmacol Rev, 2011, 63(4):938-966.
[13] CHATTERJEE PK, YEBOAH MM, DOWLING O, et al. Nicotinic acetylcholine receptor agonists attenuate septic acute kidney injury in mice by suppressing inflammation and proteasome activity[J]. Plos One, 2012, 7(5):35361.
[14] KANE JK, KONU O, MA JZ, et al. Nicotine coregulates multiple pathways involved in protein modification/degradation in rat brain[J]. Mol Brain Res, 2004, 132(2):181-191.
[15] CAROLAN BJ, HEGUY A, HARVEY BG, et al. Up-regulation of expression of the ubiquitin carboxyl-terminal hydrolase L1 gene in human airway epithelium of cigarette smokers [J]. Cancer Res, 2006, 66(22):10729-10740.
