ADAM9在小鼠肾发育中的表达
2014-06-27薄双玲马太芳白慧健宋小峰
薄双玲,马太芳,白慧健,宋小峰,田 鹤
(1.山西医科大学汾阳学院组织胚胎学教研室,山西汾阳 032200; 2.辽宁医学院组织胚胎学教研室,辽宁锦州 121001)
去整合素金属蛋白酶9(a disintegrin and metalloproteinase 9, ADAM9)是ADAM家族的重要成员之一,功能活跃,广泛表达于各种组织,具有多种生物活性。ADAM9主要通过胞外域脱落、基质降解和细胞接触来发挥作用,有多种配体,涉及不同信号通路及信号分子,从而调节胞内信号传导过程[1]。ADAM9参与了多种生理和病理过程[1-3]。YAN等人已报道了ADAM9在发育小鸡的脊髓、耳蜗、晶状体等处的表达情况[4-5],然而关于ADAM9与小鼠肾发育方面的研究尚少见报道。本研究采用免疫组织化学技术结合体视学方法及免疫印迹法检测ADAM9 在小鼠肾发育中的时空表达及其含量变化,从而探讨ADAM9 与肾分化发育的关系。
1 材料与方法
1.1组织取材及标本制备成年健康昆明系小白鼠雌、雄(1∶1)同窝饲养,每日早晚8∶00时检查雌鼠妊娠情况,以观察到阴道栓脱落的最早时间计为胚龄(embryonic days, E)0 d。孕鼠分笼饲养2周后,每日早晚8∶00时观察其生产情况,以观察到仔鼠出生的最早时间计为生后(postnatal, P)0 d。孕鼠共分为10组,每组4只,从每只孕鼠取2只胎鼠或仔鼠,分别取胚龄11、14、16、18 d胎鼠和生后1、3、7、14、28、40 d仔鼠肾。孕鼠经0.1 g/mL水合氯醛麻醉后剖腹取出胎鼠,胚龄11 d胎鼠全胚固定,胚龄14、16、18 d胎鼠取其左肾固定;仔鼠0.1 g/mL水合氯醛麻醉后,经腹后壁取出左肾,用排刀法沿横轴将肾切开,入0.04 g/mL多聚甲醛固定,常规脱水透明,石蜡定向包埋,做厚5 μm连续切片。右肾均入液氮迅速冷冻,-85 ℃保存,供免疫印迹法测定用。
1.2试剂兔抗小鼠ADAM9多克隆抗体由上海凯博生化试剂有限公司提供;Post Vaccination(PV)兔试剂盒由中杉金桥生物技术有限公司提供;Polyvinylidene Fluoride(PVDF)膜、Bovine Serum Albumin(BSA)、Sodium Dodecyl Sulfate(SDS)、Nitro-Blue-Tetrazolium/5-Bromo-4-Chloro-3-Indolyl Phosphate(NBT/BCIP)、Tween-20、Phenylmethanesulfonylfluoride(PMSF)均由Sigma公司提供。
1.3免疫组织化学染色、灰度评分及体视学测定石蜡切片脱蜡至水后微波修复10 min,加0.3 g/mL H2O2室温孵育10 min,滴加兔抗小鼠ADAM9一抗(1∶100)4 ℃过夜,生物素标记的羊抗兔二抗,37 ℃孵育30 min,SABC 37 ℃孵育30 min,DAB-H2O2显色,苏木精复染。用PBS代替一抗作阴性对照。细胞质呈棕黄色为ADAM9的阳性表达。
免疫组织化学结果采用CIAS-1000细胞图像分析系统进行图像分析。每个标本取5张切片,在400倍光镜下,每张切片“S”形随机选取5个阳性视野,以切片背景色为参照,对肾小体、肾小管进行分析。以灰度值来表示ADAM9的表达量,灰度值越大,ADAM9表达量越少。
每个标本取5张切片,在油镜下按“S”形选取5个视野,采用方格测试系统,交点计数法分别测算肾小体、皮质肾小管阳性反应表达的体密度值(volume density),计算公式为Vv =ΣPX/ΣPC,其PX为测试系统落在阳性表达的肾小体或肾小管的点数,Pc为落在参照系(肾)的点数。
1.4免疫印迹法取冷冻待用的右肾组织,每组加入4倍体积裂解液,超声粉碎机粉碎后0 ℃静置30 min,离心,用考马斯亮蓝法测定总蛋白含量。每组样品取25 μg湿转至PVDF膜上。0.05 g/mL脱脂奶粉封闭后与ADAM9抗体(1∶400)4 ℃过夜,碱性磷酸酶标记二抗(1∶700)室温1 h,BCIP/NBT试剂显色,用Gene Tools软件分析电泳条带吸光度值(A)。
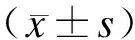
2 结 果
2.1免疫组织化学染色结果E11 d,ADAM9 即开始在输尿管芽表达(图1A)。E14 d表达在逗号小体(Ⅰ期)[6]及S小体(Ⅱ期)的裂隙中(图1B)。E16 d,在毛细血管袢阶段(Ⅲ期)表达微弱。至E18 d,在较成熟阶段(Ⅳ、Ⅴ期)的肾小体内和早期肾小管中均可见ADAM9表达,而在生肾区表达较弱。从P1 d至P7 d,在发育各期肾小体和皮质肾小管ADAM9的表达逐渐增强(图1C),在髓质小血管可见表达(图1D)。P7 d ADAM9的表达达到高峰之后逐渐减少,但在髓放线没有表达(图1E)。P40 d生肾区消失,ADAM9仅表达于较成熟阶段的肾小体中,并趋于稳定;在成熟期的皮质肾小管ADAM9表达微弱,同时可见小动脉有阳性表达(图1F)。而其在集合管的表达始终较弱。
2.2免疫组织化学染色灰度评分结果随着肾的发育,ADAM9表达的灰度值在肾小体呈逐渐降低后趋于平稳,而肾小管则为先降低后升高的趋势(图2)。
2.3体视学测量结果随着胚(日)龄的增加,ADAM9在各期肾小体的体密度值逐渐增加,P7 d时达到最大并趋于稳定,而在皮质肾小管表达的体密度值则呈现先增后减的趋势(图3)。
2.4免疫印迹法测定结果应用Gene Tools软件对ADAM9蛋白表达的电泳条带分析显示,随着胚(日)龄的增加ADAM9在小鼠肾组织的A值呈先增后减的趋势(图4)。

图1ADAM9在小鼠肾脏组织中的表达
Fig.1 ADAM9 expression in the developing kidney detected by immunohistochemistry
A:E11 d;B:E14 d;C:P1 d;D:P7 d;E:P7 d;F:P40 d(放大倍数:E为×400,余均为×1 000)

图2小鼠不同发育阶段ADAM9在肾小体和肾小管表达的灰度值
Fig.2 Gray scale of ADAM9 in the developing renal corpuscles and tubules
与前一组比较,*P<0.05,n=200;A:肾小体的灰度值变化;B:肾小管的灰度值变化。
图3小鼠发育各阶段肾小体、皮质肾小管ADAM9阳性表达的体密度值
Fig.3 Volume density of ADAM9 in the glomeruli and tubules of developing kidneys of mice
与前一组比较,*P<0.05,n=200;A:肾小体的体密度值变化;B:肾小管的体密度值变化。
3 讨 论
ADAM9 属于跨膜蛋白家族,即去整合素(解聚素)金属蛋白酶家族(a disintegrin and metalloproteinase, ADAM),这个家族可以通过影响细胞黏附、迁移、蛋白质水解和信号转导等,参与多种生理和病理过程。在胚胎发育中,其主要通过调控细胞与细胞、细胞与基质的粘附参与形态构建和组织形成,尤其与神经发生、细胞迁移、引导轴突生长以及细胞分化等过程密切相关[5]。研究报道在小鼠发育期的间充质、心脏和脑等部位均有ADAM9的高度表达,这提示ADAM9对多种器官的发育分化都发挥一定的作用[7]。
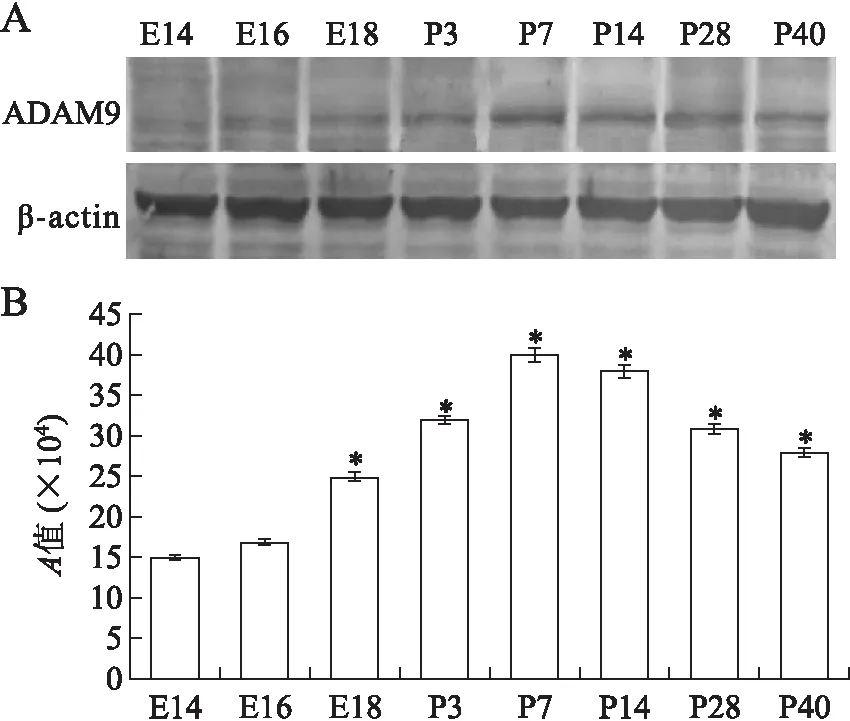
图4小鼠发育过程中肾内ADAM9表达的免疫印迹结果
Fig.4 Expression of ADAM9 in the developing mouse kidney detected by immunoblot
与前一组比较,*P<0.05,n=8。A:免疫印迹蛋白条带;B:ADAM9在小鼠肾组织的A值的变化。
为探讨ADAM9与肾脏发育的关系,本实验通过免疫组织化学技术结合体视学方法及免疫印迹法检测ADAM9在小鼠肾发育中的表达及其含量变化。结果发现,ADAM9在胚胎11 d时即表达于输尿管芽,这表明ADAM9在输尿管芽与生后肾组织相互诱导分支过程中,就可能发挥一定的作用。随后在各期肾小体及皮质迷路肾小管均有表达,且从生后1 d开始在肾小体和肾小管的表达都逐渐增强,生后7 d达到顶峰后肾小体的表达趋于稳定,而肾小管的表达则逐渐减弱。这说明ADAM9在肾脏发育过程中的表达具有一定的时空性,且肾小管的表达主要集中在皮质浅层,而较成熟的肾小管的表达却很弱,故我们认为ADAM9可能与肾小管的发育成熟有关。ADAM9表达于髓质小血管和成熟后小动脉,说明其在胚胎血管生成及成熟血管的维持和构建也发挥一定的作用。根据文献报道和本课题组的前期研究证明,后肾发育开始于胚胎11 d,至生后7 d时生肾区消失,肾小管和肾小体基本发育完毕,生后40 d时,小鼠肾脏与成鼠完全相同,这表明ADAM9在肾脏发育早期作用较大,而在肾脏后期的成熟过程中,作用较弱。
早在1998年,YASUSHI[8]已经证实ADAM9形成的复合物调节Pro-HB-EGF和HB-EGF(肝素结合表皮生长因子)释放,故ADAM9通过生长因子或受体蛋白水解脱落而影响细胞的发育和分化,适当的生长因子受体对于正常的胚胎发育,成体内环境的稳定是必需的。也有研究表明,ADAM9在大鼠肾脏各型去整合素金属蛋白酶表达中占支配优势,ADAM9广泛表达于肾小体,肾小管(近端、远端)的上皮细胞[9-10],而且与含有β1链的整合素蛋白高度共表达,影响整合素与Ⅳ型胶原、层黏连蛋白以及纤维黏连蛋白的相互作用,调节细胞与细胞外基质的黏附,与多种肾脏疾病的发生发展关系密切。
综上所述,在ADAM家族中,ADAM9是一个非常活跃的蛋白酶,可以通过多种途径发挥其生理作用,尤其在肾脏发育过程中,其与细胞发育分化密切相关,然而关于这一现象的详细机制还有待于我们进一步的研究。
参考文献:
[1] ZHOU C, LIU J, LI Y, et al. microRNA-1274a, a modulator of sorafenib induced a disintegrin and metalloproteinase 9 (ADAM9) down-regulation in hepatocellular carcinoma[J]. FEBS Lett, 2011, 585(12):1828-1834.
[2] ENGLISH WR, COROVL P, MURPHY G. LPS activates ADAM9 dependent shedding of ACE from endothelial cells[J]. Biochem Biophys Res Commun, 2012, 421(1):70-75.
[3] PEDUTO L.ADAM9 as a potential target molecule in cancer[J]. Curr Pharm Des, 2010, 15(20):2282-2287.
[4] YAN X, LIN J, ROLFS A, et al. Expression patterns of ADAMs in the developing chicken lens[J]. J Mol Histol, 2012, 43(2):121-135.
[5] LIN J, YAN X, WANG H, et al. Expression of seven members of the ADAM family in developing chicken spinal cord[J]. Dev Dyn, 2010, 239(4):1246-1254.
[6] 金红英,田鹤,郭敏. 肝细胞生长因子受体在小鼠肾发育中的表达[J]. 解剖学杂志, 2009, 32(4):459-462.
[7] WESKAMP G, CAI H, BRODIE TA,et al. Mice lacking the metalloprotease-disintegrin MDC9 (ADAM9) have no evident major abnormalities during development or adult life[J]. Mol cell Biol, 2002, 22(5):1537-1544.
[8] REISS K, SAFTIG P. The “a disintegrin and metalloprotease” (ADAM) family of sheddases: physiological and cellular functions[J]. Semin Cell Dev Biol, 2009, 20(2):126-137.
[9] MAHIMKAR RM, BARICOS WH, VISAYA O, et al.Identification, cellular distribution and potential function of the metalloprotease-disintegrin MDC9 in the kidney[J]. J Am Soc Nephrol, 2000, 11(4):595-603.
[10] MAHIMKAR RM, VISAYA O, POLLOCK AS, et al. The disintegrin domain of ADAM9: a ligand for multiple beta1 renal integrins[J]. Biochem J, 2005, 385(Pt 2):461-468.
