G250抗原肽与HBcAg融合基因原核表达载体的构建 及表达蛋白的免疫分析
2014-06-27孙泽强刘庆勇王司军杨广笑王全颖
刘 波,孙泽强,刘庆勇,陈 杰,王司军,杨广笑,王全颖
(1. 山东大学医学院,山东济南 250012;2. 山东大学附属济南市中心医院 泌尿外科,山东济南 250013;3. 西安华广生物工程公司,陕西西安 710025)
肾癌是一种免疫原性很强的肿瘤,生物免疫治疗对其有良好的治疗效应,疫苗研究成为目前肾癌免疫治疗的热点之一[1]。G250抗原是碳酸酐酶家族成员之一,它与具有碳酸酐酶活性的细胞黏附因子:碳酸酐酶IX(MN/CA IX)的基因结构完全相同,因此也称为CA IX(简称G250)[2],其在肾癌组织中高度特异性表达,成为目前肾癌诊断、治疗、预后的理想靶点[3-4]。研究证实,肾癌特异性G250抗原中氨基酸249~268形成的抗原肽(G250肽/249),同时包含CTL表位和Th表位,可诱导CD4+及CD8+的T细胞免疫反应,可刺激机体产生针对该肽的抗肾癌免疫反应,故G250肽/249为肾癌肽疫苗治疗的理想靶点[5-6]。目前,以G250抗原表位肽为基础的肾癌肽疫苗研究已完成相应临床报告。研究结果表明,单纯G250抗原表位肽存在免疫原性弱、在体内不能产生理想的抗肾癌治疗效应等弱点,而不同免疫佐剂在治疗效应方面具有重要作用,故寻找理想的免疫佐剂,增强其免疫原性成为以G250抗原表位肽为基础的肾癌肽疫苗治疗的研究热点之一[7-8]。故本实验使用HBcAg作为免疫佐剂,期待提高G250肽/249的免疫原性,将编码鼠G250肽/249的基因片段插入到HBcAg的主要免疫优势区(MIR),最终构建出原核表达质粒pET28a(+)/C-G250肽-C,通过原核表达和纯化,成功获得融合蛋白,并进一步分析其免疫原性,为下一步研究该融合蛋白疫苗在小鼠肾癌模型治疗效应方面奠定基础。
1 材料与方法
1.1材料pGEM-T Easy质粒、删除了MIR区的重组质粒pGEMEX/HBcAg、原核表达质粒pET28a(+)、大肠杆菌E.coliDH5α和E.coliBL21、完全弗氏佐剂、不完全弗氏佐剂等试剂由西安华广生物工程公司提供;T4 DNA连接酶、限制性内切酶、羊抗小鼠IgG-HRP购自华美生物工程公司;Ni2+-NTA亲和层析蛋白纯化柱购自Novagen公司;G250肽/249由西安蓝晶生物科技有限公司合成;BALB/c小鼠(6只,雌性,6~8周,体质量15~20 g)购自西安交通大学医学院实验动物中心;引物合成、DNA测序由北京奥科鼎盛生物技术有限公司完成。
1.2方法
1.2.1PCR扩增编码鼠G250肽特异性抗原表位的基因片段 根据在GenBank上查询编码小鼠的G250肽(249~268)基因序列(GenBank:AB086322.1),采用非对称互补引物合成方法,设计正负两条引物,正向引物的5'端加入保护碱基C及XhoⅠ酶切位点(CTCGAG),负向引物5'端加入BamHⅠ酶切位点(GGATCC)及保护碱基C,为后续的融合基因连入载体奠定了基础。
设计引物如下:F:5′-CCTCGAGGAGATCCACGTGGTGCACCTCAGTACTGCTTTCTCCG-AAC-3′,R:5′-CGGATCCGCGGCCCAAGGCTTC-ATGAAGTTCGGAGAAAGC-3′。反应条件为:94 ℃预变性5 min,94 ℃变性50 s,35 ℃退火50 s,72 ℃延伸50 s,共30个循环,72 ℃延伸5 min。
1.2.2构建重组质粒pGEM-T/G250肽 回收并纯化PCR产物,将其连接入 pGEM-T Easy载体,构建重组质粒pGEM-T/G250肽,并转化入感受态E.coliDH5α中,使用Amp+培养基筛选阳性菌株,挑取单菌落接种于含Amp+的LB液体培养基中振荡培养,碱性裂解法小提质粒,BamHⅠ及XhoⅠ酶切鉴定并基因序列测序。
1.2.3构建重组质粒pGEMEX-C-G250肽-C 碱性裂解法大量提取质粒pGEM-T/G250肽,XhoⅠ及BamHⅠ双酶切pGEM-T/G250肽,回收并纯化G250肽目的基因片段,将其连接入删除了MIR区的pGEMEX/HBcAg中,构建重组质粒pGEMEX-1/C-G250肽-C,然后转化入感受态细菌E.coliDH5α中,将阳性表达菌株接种于含Amp+的LB液体培养基中振荡培养,扩增细菌,碱性裂解法小提质粒,将鉴定正确的重组克隆进行DNA序列分析。
1.2.4PCR扩增C-G250肽-C基因片段 pGEMEX/C-G250肽-C重组质粒中C-G250肽-C融合基因两端的酶切位点分别为EcoRⅠ和SacⅡ,为下一步构建原核表达质粒pET28 a(+)/C-G250肽-C,需将SacⅡ酶切位点更换为SalⅠ酶切位点,故以pGEMEX/C-G250肽-C为模板,设计合成两条正负引物,PCR扩增C-G250肽-C基因片段。正向引物的5'端加入保护碱基G且酶切位点为EcoRⅠ(GAATTC),负向引物5'端加入保护碱基G且设计酶切位点为SalⅠ(GTCGAC)。
F:5′-GGAATTCATGATTACGCCAAGCTTGGG;R:5′-GGTCGACTCACGGAAGTGTTGATAGGA。反应条件为:94 ℃预变性5 min,94 ℃变性50 s,60 ℃退火50 s,72 ℃延伸50 s,共30个循环,72 ℃延伸5 min。
1.2.5构建重组质粒pGEM-T/C-G250肽-C 回收并纯化PCR产物,将其连接入pGEM-T Easy 载体,构建重组质粒pGEM-T/C-G250肽-C,然后转化入感受态细菌E.coliDH5α中,将阳性表达菌株接种于含Amp+的LB液体培养基中振荡培养,扩增细菌,碱性裂解法小提质粒,EcoRⅠ及SalⅠ酶切鉴定,将鉴定正确的重组克隆进行DNA序列分析。
1.2.6构建原核表达质粒pET28 a(+)/C-G250肽-C 碱性裂解法大量提取质粒pGEM-T/C-G250肽-C,通过EcoRⅠ、SalⅠ分别酶切pGEM-T/C-G250肽-C及pET28a(+),制备含有相同黏性末端的目的片段,并分别回收、纯化酶切产物,通过T4DNA酶连接,最终构建原核表达质粒pET28a(+)/C-G250肽-C,然后转化入感受态E.coliDH5α大肠杆菌中,将阳性表达菌株接种于含Kana+的LB液体培养基中振荡培养,扩增细菌,经EcoRⅠ、SalⅠ酶切鉴定及测序证实重组质粒构建成功。
1.2.7重组质粒pET28 a(+)/C-G250肽-C的原核诱导表达 原核表达质粒 pET28a(+)/C-G250肽-C 转化感受态细菌E.coliBL21(DE3),使用Kana+培养基筛选阳性菌株,随机挑选单菌落接种于含Kana+的LB液体培养基中振荡培养至A600为0.4,然后将培养液加入到200 mL含Kana+的LB的培养液中继续振荡培养10 h,加IPTG至终浓度为1 mmol/L,继续振荡培养8 h。
1.2.8原核表达蛋白的分离和纯化 使用裂解缓冲液洗及超声细胞粉碎机裂解诱导表达的细菌沉淀,将沉淀充分溶解于8 mol/L尿素中,室温20 h,收集上清入透析袋中透析48 h。按Novagen公司操作方法,采用Ni2+-NTA亲和层析法分离纯化目的蛋白,采用凝血酶酶切去掉氨基端(N端)的组氨酸标记(His-TagD)等多肽,最后再次经Ni2+-NTA柱洗脱,未结合蛋白质即为纯化的融合蛋白,在经SDS-PAGE分析、考马斯亮蓝染色,通过吸光度扫描分析融合蛋白纯度。
1.2.9动物免疫 免疫方案:BALB/c小鼠6只,每周腹腔注射免疫1次,200 μL/只,第1次免疫用等体积的弗氏完全佐剂与融合蛋白的乳化混合物,第2次免疫用弗氏不完全佐剂与融合蛋白的乳化混合物,此后免疫时仅用融合蛋白而不加佐剂,共免疫6次。分别于初次免疫前和2次免疫后每周剪鼠尾采血分离血清。
1.2.10间接ELISA法检测血清抗体 用包被缓冲液稀释融合蛋白,包被96孔板,每孔100 μL,洗涤液洗涤后,加入1~6号小鼠免疫前血清和不同稀释度的免疫后血清(从1∶2 000开始倍比稀释),37 ℃孵育1 h,再次洗涤后加入HRP标记的山羊抗鼠IgG(1∶5 000),37 ℃孵育1 h,TMB显色10 min后H2SO4终止反应,用酶标仪测定A450值,以免疫前血清为阴性对照,P/N>2.1者判为阳性。
1.2.11间接ELISA法检测表达蛋白的抗原特异性 分别制备G250肽/249和HBcAg包被板,一抗为不同稀释度的免疫后血清(从1∶1 000开始倍比稀释),二抗为HRP标记的山羊抗鼠IgG(1∶5 000),TMB显色10 min后H2SO4终止反应,用酶标仪测定A450值,P/N>2.1者判为阳性。
2 结 果
2.1G250肽PCR产物的凝胶电泳鉴定采用非对称互补引物模板法PCR扩增G250肽/249目的基因,理论上为74 bp。在10 g/L琼脂糖凝胶电泳中,可见到与理论值相符的DNA条带(图1)。
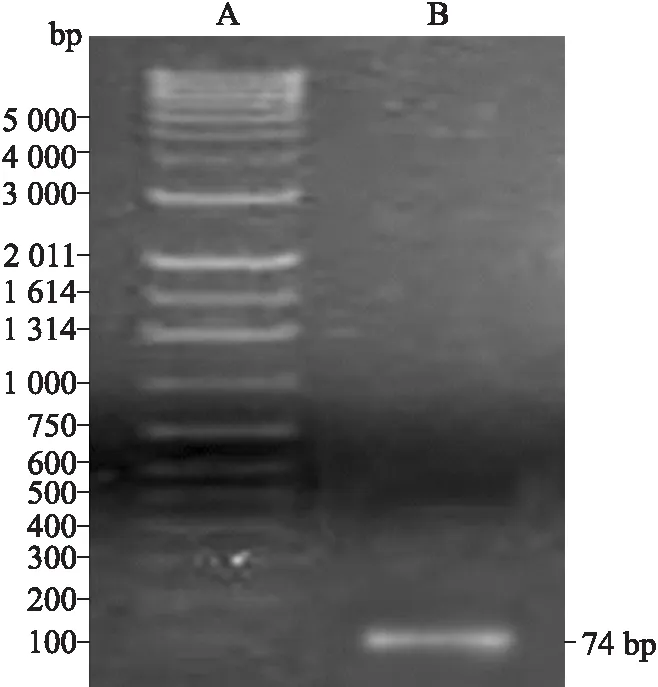
图1G250肽PCR产物的琼脂糖凝胶电泳鉴定
Fig.1 Result of G250 peptide PCR
A:DNA marker;B:G250 PCR产物。
2.2重组质粒pGEM-T/G250肽的酶切鉴定及测序结果①酶切鉴定: 通过XhoⅠ及BamHⅠ双酶切鉴定重组质粒pGEM-T/G250肽,10 g/L琼脂糖凝胶电泳结果显示在66 bp处可见与G250肽/249理论值相符的一明显条带(图2)。②基因测序:经DNA-SIS软件分析,结果显示融合基因序列与理论序列完全相符。

图2重组质粒pGEM-T/G250肽的双酶切鉴定
Fig.2 Identification of plasmid pGEM-T/G250 peptide by double enzyme digestion
A:DNA marker;B:经XhoⅠ及BamHⅠ双酶切的pGEM-T/G250肽重组质粒;C:pGEM-T/G250肽重组质粒。
2.3重组质粒pGEMEX-C-G250肽-C的酶切鉴定及测序结果①酶切鉴定:通过EcoRⅠ及SalⅠ双酶切鉴定,理论上应可切出3 986 bp和508 bp两个片段。10 g/L琼脂糖凝胶电泳结果可见与理论值相符的明显DNA条带(图3)。②基因测序:经DNA-SIS软件分析,结果显示融合基因序列与理论序列完全相符。

图3重组质粒pGEMEX-C-G250肽-C的双酶切鉴定
Fig.3 Identification of plasmid pGEMEX-C-G250 peptide-C peptide-C by double enzyme digestion
A:DNA marker;B:经EcoRⅠ及SaLⅠ双酶切的pGEMEX-C-G250肽-C重组质粒;C:pGEMEX-C-G250肽-C重组质粒。
2.4C-G250肽-CPCR产物的凝胶电泳鉴定以pGEMEX/C-G250肽-C为模板,设计合成2条正负引物,PCR扩增C-G250肽-C基因片段,理论上为511 bp。在10 g/L琼脂糖凝胶电泳图中可见到与理论值相符的一条DNA带(图4)。
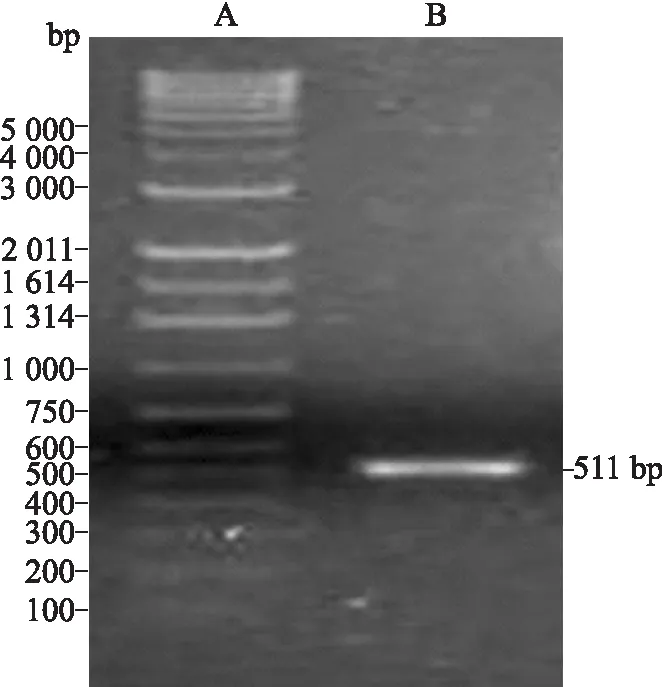
图4C-G250肽-CPCR产物的琼脂糖凝胶电泳鉴定
Fig.4 Result of C-G250 peptide-C PCR product
A:DNA marker;B:C-G250肽-C PCR产物。
2.5重组质粒pGEM-T/C-G250肽-C的酶切鉴定与测序结果①酶切鉴定:通过EcoRⅠ及SaLⅠ双酶切鉴定,理论上应可切出4 218 bp和508 bp两个片段。10 g/L琼脂糖凝胶电泳结果可见与理论值相符的明显DNA条带(图5)。②基因测序:经DNA-SIS软件分析,结果显示融合基因序列与理论序列完全相符。
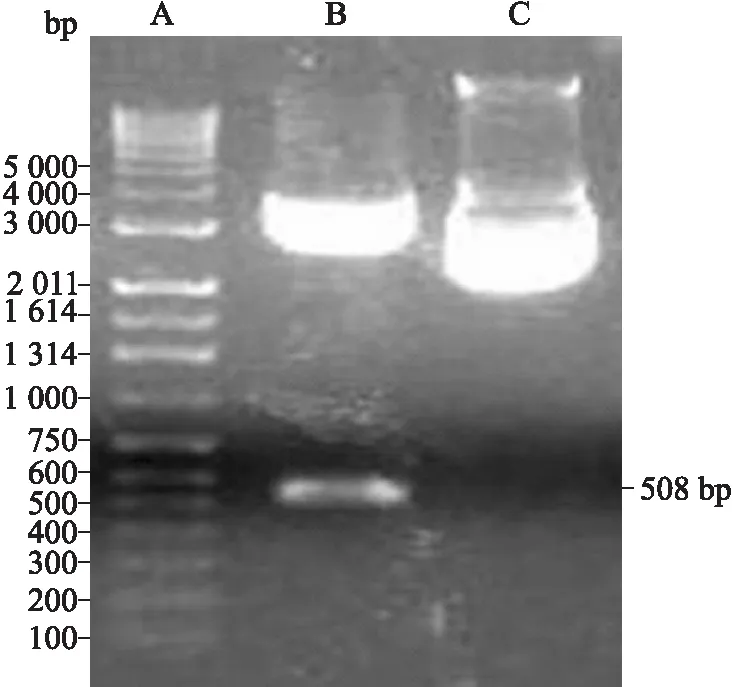
图5重组质粒pGEM-T/C-G250肽-C的双酶切鉴定
Fig.5 Identification of plasmid pGEM-T/C-G250 peptide-C by double enzyme digestion
A:DNA marker;B:经EcoRⅠ及SaLⅠ双酶切的pGEM-T/C-G250肽-C重组质粒;C:pGEM-T/C-G250肽-C重组质粒。
2.6原核表达质粒pET28a(+)/C-G250肽-C的构建与鉴定结果①酶切鉴定:通过EcoRⅠ及SaLⅠ双酶切鉴定重组质粒pET28 a(+)/C-G250肽-C,理论上应切出5 434 bp和508 bp两个片段。在10 g/L琼脂糖凝胶电泳结果可见与理论值相符的明显DNA条带(图6)。②基因测序:经DNA-SIS软件分析,结果显示融合基因序列与理论序列完全相符。

图6重组质粒pET28a(+)/C-G250肽-C的双酶切鉴定
Fig.6 Identification of plasmid pET28a(+)/C-G250 peptide-C by double enzyme digestion
A:DNA marker;B:经EcoRⅠ及SaLⅠ双酶切的pET28a(+)/C-G250肽-C重组质粒;C:pET28a (+)/C-G250肽-C重组质粒。
2.7重组质粒pET28a(+)/C-G250肽-C的原核表达和纯化结果使用裂解缓冲液洗及超声细胞粉碎机裂解诱导表达的细菌沉淀,8 mol/L尿素中洗涤后收集上清并透析,Ni2+-NTA亲和层析法分离纯化目的蛋白,凝血酶酶切去掉氨基端(N端)的组氨酸标记(His-TagD)等多肽,最后再次经Ni2+-NTA柱洗脱,最后获得了纯度达95%以上的融合蛋白,经SDS-PAGE和考马斯亮蓝染色后,在相对分子质量约为22.35处可见1条新的蛋白条带,与融合蛋白的理论值相符 (图7)。
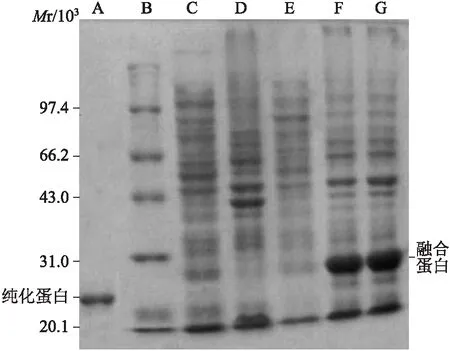
图7融合蛋白的SDS-PAGE电泳分析
Fig.7 SDS-PAGE analysis of the recombinant protein
A:纯化融合蛋白;B:蛋白marker;C:pET28a(+)诱导表达上清;D:pET28a(+)诱导表达沉淀;E:pET28a(+)/C-G250肽-C诱导表达上清;F:pET28a(+)/C-G250肽-C诱导表达沉淀(1/2稀释);G:pET28a(+)/C-G250肽-C诱导表达沉淀(1/4稀释)。
2.8血清抗体的检测结果免疫4周后,所有小鼠血清中均可检测到中和抗体,免疫第6周其血清中抗体滴度均可达到1∶2.56×105,最高抗体滴度可达到1∶5.12×105(表1)。
表1间接ELISA法检测血清抗体滴度
Tab.1 Serum antibody titer detected by indirect ELISA

(n=6)
2.9免疫小鼠血清中抗G250肽及HBcAg抗体滴度免疫4周后,6只小鼠中有5只血清中抗-G250肽/249抗体的滴度可达到1∶8×103, 检测不到抗-HBc抗体,免疫6周后所有小鼠血清中抗-HBc抗体滴度不超过1∶4×103,抗-G250肽/249抗体最高达1∶6.4×104(表2)。
表2间接ELISA法检测血清抗G250肽/249抗体滴度
Tab.2 Serum antibody titer of anti-G250 peptide/249 detected by indirect ELISA (n=6)

3 讨 论
研究证实,肾癌对免疫治疗有较好的反应性,开展有效的肾癌疫苗免疫治疗显得尤为重要。G250抗原及其表位肽良好的肾癌肿瘤特异性成为肾癌疫苗主动免疫及靶向治疗的理想靶点。目前,在各种疫苗研究中,肽疫苗具有能诱发特异的免疫应答,且分子结构简单,生产、纯化、保存方便及安全等优点成为研究热点之一。然而,由于抗原肽分子量小、免疫原性弱,在临床上获得的治疗效果有限[9]。目前,G250抗原表位肽在肾癌肽疫苗治疗研究中,多采用不同的方式增强其免疫原性,产生更强的肾癌免疫治疗效应。KIM等[10]制备G250肽-鲍氏不动杆菌外膜蛋白A融合蛋白,并冲击树突状细胞去治疗RENCA小鼠肾癌肿瘤模型,获得了理想的针对G250抗原肽的特异性抗肾癌免疫反应。另外,包括G250抗原肽联合IFN-r、完全弗氏佐剂等肾癌免疫治疗及G250抗原肽冲击树突状细胞促进CD4+的活化、增殖,提高免疫反应等已完成相应的实验研究[11-12]。
HBcAg颗粒能激发机体较强的体液免疫及细胞免疫应答,在HBcAg的刺突尖部78~83 氨基酸是HBcAg的MIR区,是插入外源基因的理想部位,在此部位融合,即可显著增强外源基因的免疫原性,同时并可以废除或降低HBcAg本身的免疫原性[13],在实验及临床应用研究中证实了其可作为理想的载体[14-15]。本研究室曾将β淀粉样肽基因及表皮生长因子受体Ⅲ型突变体的pep-3抗原表位(EGFRvⅢ/ pep-3)基因成功插入HBcAg的MIR区,通过原核表达获得的融合蛋白具有良好的免疫原性,可诱导产生高效价抗体[16-17]。基于以上理论基础,本实验通过基因工程技术将编码鼠G250肽的基因片段插入HBcAg的MIR区,构建原核表达质粒pET28a(+)/C-G250肽-C,通过原核表达成功获得融合蛋白。该融合蛋白其N端的His纯化标签和凝血酶蛋白酶切位点,利于后续的分离纯化及在纯化完成后切除上述融合标签, 最终获得纯度达95%以上的融合蛋白。间接ELISA法检测显示,该融合蛋白能诱导小鼠产生高滴度和高特异性的中和抗体,且血清抗体中抗-G250肽/249抗体,最高达1∶6.4×104。由于G250肽/249抗原表位代替了HBcAg的MIR区,使HBcAg的抗原性显著下降,抗-HBc抗体滴度不超过1∶4×103。在本研究设计中使用鼠源性G250肽/249的目的主要为便于下一步可直接使用小鼠RENCA肾癌模型进行治疗效应研究,首先证实该融合蛋白是否可以在小鼠体内诱导产生理想的抗肿瘤治疗效应,为进一步研究人源性G250肽/249与HBcAg融合基因奠定基础。
综上所述,我们成功制备了鼠G250肽/249与HBcAg重组基因的纯化融合蛋白,该融合蛋白具有较强的免疫原性,能诱导小鼠产生高滴度和高特异性的抗体,为进一步研究该融合蛋白疫苗在小鼠RENCA肾癌模型中治疗效应奠定了基础。
参考文献:
[1] LJUNGBERG B, COWAN NC, HANBURY DC, et al. EAU guidelines on renal cell carcinoma:the 2010 update[J]. Eur Urol, 2010, 58(3):398-406.
[2] OPAVSKY R, PASTOREKOVS, ZELNK V, et al. Human MN/CA9 gene, a novel member of the carbonic anhydrase family:structure and exon to protein domain relationships[J]. Genomics, 1996, 33(3):480-487.
[3] GRABMAIER K, DE WM, UEMURA H, et al. Renal cell carcinoma-associated G250 methylation and expression:invivoandinvitrostudies[J]. Urology, 2002, 60(2):357-362.
[4] TOSTAIN J, LI G, GENTIL-PERRET A, et al. Carbonic anhydrase 9 in clear cell renal cell carcinoma: a marker for diagnosis, prognosis and treatment[J]. Eur J Cancer, 2010, 46(18):3141-3148.
[5] VISSERS ML, VRIES MI, ENGELEN HP, et al. Renal cell carcinoma-associated antigen G250 encodes a naturally processed epitope presented by human leukocyte antigen-DR molecules to CD4(+)T lymphocytes[J]. Int J Cancer, 2002, 100(4):441-444.
[6] VISSERS JL, DEVRIES IJ, SCHREURS MW, et al. The renal cell carcinoma-associated antigen G250 encodes a human leukocyte antigen (HLA)-A2.1-restricted epitope recognized by cytotoxic T lymphocytes[J]. Cancer Res, 1999, 59(21):5554-5559.
[7] BLEUMER I, TIEMESSEN DM, OOSTERWIJK-WAKKA JC, et al. Preliminary analysis of patients with progressive renal cell carcinoma vaccinated with CA9-peptide-pulsed mature dendritic cells[J]. J Immunother, 2007, 30(1):116-122.
[8] VAN PH, JONIAU S, VAN SG. Vaccine therapy in patients with renal cell carcinoma[J]. Eur Urol, 2009, 55(6):1333-1342.
[9] CLAESSON MH. Why current peptide-based cancer vaccines fail:lessons from the three Es? [J]. Immunotherapy, 2009, 1(4):513-516.
[10] KIM BR, YANG EK, KIM DY, et al. Generation of anti-tumour immune response using dendritic cells pulsed with carbonic anhydrase IX-acinetobacter baumannii outer membrane protein a fusion proteins against renal cell carcinoma[J]. Clin Exp Immunol, 2012, 167(1):73-83.
[11] SUEKANE S, NISHITANI M, NOGUCHI M, et al. Phase I trial of personalized peptide vaccination for cytokine-refractory metastatic renal cell carcinoma patients[J]. Cancer Sci, 2007, 98(12):1965-1968.
[12] UEMURA H, FUJIMOTO K, TANAKA M, et al. A phase I trial of vaccination of CA9-derived peptides for HLA-a24-positive patients with cytokine-refractory metastatic renal cell carcinoma[J]. Clin Cancer Res, 2006, 12(6):1768-1775.
[13] BORISOVA G, BORSCHUKOVA WO, MEZULE G, et al. Spatial structure and insertion capacity of immunodominant region of hepatitis B core antigen[J]. Intervirology, 1996, 39(1/2):16-22.
[14] SCHOTSAERT M, DE FM, FIERS W, et al. Universal M2 ectodomain-based influenza a vaccines:preclinical and clinical developments[J]. Expert Rev Vaccines, 2009, 8(4):499-508.
[15] GREGSON AL, OLIVEIRA G, OTHORO C, et al. Phase I trial of an alhydrogel adjuvanted hepatitis B core virus-like particle containing epitopes of plasmodium falciparum circumsporozoite protein[J]. PLoS One, 2008, 3(2):e1556.
[16] 冯改丰,胡海涛,李月英,等. 重组基因c-Aβ-c的构建及其表达蛋白的免疫原性分析[J]. 细胞与分子免疫学杂志,2005,21(5):533-537.
[17] 段小艺,王健生,郭佑民,等. EGFRvⅢ/PEP-3 cDNA与HBcAg重组基因原核表达载体的构建、表达与免疫分析[J]. 细胞与分子免疫学杂志,2007, 23(1):21-24.
