鱼藤酮诱导神经毒性机制的研究进展
2018-04-23沈建平
周 谦, 陈 斌,曹 鹏,沈建平
(1. 南京中医药大学附属中西医结合医院,江苏 南京210028; 2. 江苏省中医药研究院,江苏 南京 210028;3. 南京野生植物综合利用研究院,江苏 南京 210042)
鱼藤酮是鱼藤酮类植物家族成员之一,是一种从豆科鱼藤属(Derris)和醉鱼豆属(Lonhocarpus)植物萃取的天然毒性物质[1]。鱼藤酮光下易分解。一般情况,其有毒成分5~6天分解,而阳光充足的夏天,仅需2~3天。鱼藤酮在泥土和水中也易降解。半衰期仅1~3天[2]。由于鱼藤酮半衰期短,易分解,不污染环境,因此在世界各地都普遍应用于农作物虫害治理和鱼塘清理,被视为是一种天然低毒且高效的杀虫剂[3]。
1 鱼藤酮危害人体的方式
鱼藤酮作为农药而大规模使用,因此进入人体的最可能途径是呼吸摄入[1]。但是,资料显示鱼藤酮在胃肠道吸收缓慢且不完全,而肝脏又能有效解毒,鱼藤酮进入全身血液循环十分困难。因此,鱼藤酮由于呼吸摄入而诱发Parkinson’s disease (PD)存在质疑。有一个证据与这个假说相一致,小鼠通过雾化方式染毒鱼藤酮24个月,并未导致神经系统损伤相关疾病发生[4]。
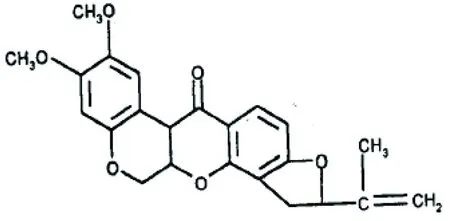
图1 鱼藤酮的分子结构[1]
2 鱼藤酮的神经毒性
鱼藤酮高度亲脂,能透过血脑屏障,极易跨膜且不需跨膜受体,因此极易造成中枢神经系统损伤,特别是对神经元的损伤[5-6]。数据显示,小鼠静脉注射鱼藤酮后,仅需15 min,鱼藤酮便在中枢系统积累并达到最高浓度[7]。此外,鱼藤酮是一种与线粒体复合物Ⅰ具有高亲和力的非竞争性抑制剂[3, 8],鱼藤酮进入神经细胞后,能够在线粒体中集聚,损坏呼吸链的氧化磷酸化,抑制ATP的合成[9]。近期一个NIH的病例显示,鱼藤酮职业暴露的人患PD的风险是不接触鱼藤酮人的2.5倍[10]。此外,一项来自得克萨斯州的农业调查显示,农业使用鱼藤酮会增加PD的患病风险[11]。
3 鱼藤酮诱发神经毒性的潜在机制
研究表明,鱼藤酮作为线粒体复合物Ⅰ抑制剂,能够从多方面触发神经毒性。可能的机制包括抑制线粒体功能,诱导氧化应激,触发凋亡,聚集/降解蛋白,诱发兴奋性中毒,抑制细胞周期等,或是以上众多因素综合作用的结果[3, 11-12]。
3.1 鱼藤酮抑制线粒体
Kweon等学者指出,鱼藤酮能够通过抑制线粒体复合物Ⅰ,降低线粒体活力,抑制ATP的合成[13-14]。暗示着鱼藤酮导致的线粒体功能受损可能是PD发生的诱因。Moon等学者指出,小鼠原代神经元暴露低剂量鱼藤酮,会造成线粒体去极化、激活caspase凋亡通路、导致DNA断裂等触发多巴胺能神经元死亡[15]。此外,鱼藤酮作用于复合物Ⅰ,会降低线粒体膜电位,诱导线粒体膜通透性转换(MPT),并触发凋亡[16]。暗示鱼藤酮关联的线粒体功能受损是鱼藤酮诱发神经毒性的一个因素。
3.2 鱼藤酮诱导氧化应激
体内体外大量研究结果表明,鱼藤酮会通过诱导活性氧簇(ROS)和活性氮簇(NOS)的高涨,线粒体氧化磷酸化失衡,脂质过氧化等触发神经毒性,且毒性作用可以被抗氧化剂抑制[17-19]。资料显示,慢性鱼藤酮染毒小鼠在第30天和第60天,神经细胞的NO和脂质过氧化产物TBARS水平上升。并且,还出现了PD相关的行为学特征,如麻痹和强直[20]。数据表明,鱼藤酮模型中的抗氧化物酶,如GSH和SOD活性下降[21],而一些过氧化物如过氧硝酸盐的含量上升[22],证明了鱼藤酮模型中氧化应激的产生。此外,PD病人脑内也会发生氧化应激,表现包括GSH含量降低,DNA磷脂,蛋白的过氧化等。Tada-Oikawa指出,鱼藤酮能够刺激人源细胞HL-60和NJAB H2O2水平高涨,推测为存在一种鱼藤酮诱导- H2O2机制诱发神经毒性[12, 23]。以上数据暗示鱼藤酮会通过氧化应激关联神经系统损伤。
3.3 鱼藤酮触发凋亡
凋亡发生常涉及两条经典通路,分别是Fas介导的Caspase-8和应急压力介导的caspase-9,两条通路最终于caspase-3汇聚,激活,导致核降解和细胞形态改变[24]。资料显示,鱼藤酮在诱导神经毒性时,能够触发多种凋亡指标,包括:细胞膜电位下降、caspase-3和caspase-9激活、Bax和细胞色素C释放等[25]。如Wang等研究发现鱼藤酮能够以剂量依赖的方式触发caspase-3的激活[26]。Ethell于2009年指出,鱼藤酮诱导的氧化应激会导致脂质过氧化和蛋白错折叠,诱使神经细胞通过Bcl-2家族级联的方式死亡[18]。Abdin等人发现,在慢性鱼藤酮染毒的小鼠动物模型中,随着纹状体线粒体复合物Ⅰ活性下降、ATP合成抑制、血浆和纹状体Q10活性降低、抗凋亡蛋白Bcl-2活性却增强。他给予的解释是鱼藤酮在诱导神经毒性时触发了线粒体的抗凋亡保护路径。
3.4 鱼藤酮导致蛋白集聚
鱼藤酮能够高度复制PD的病理特征,其一就是形成淀粉样集聚蛋白-Lewy小体[27],Lwey小体的主要成分是α-synuclein,为一种广泛分布于中枢神经系统突触前末梢的小分子蛋白,其正常生理功能尚不明确,推测可能是与突触的可塑性和多巴胺神经递质传递等有关[28-30]。应激条件下,α-synuclein易发生错误折叠、集聚,并最终形成不溶性纤维结构,导致细胞死亡[28, 31]。Uversky等人研究显示鱼藤酮能够显著加速α-synuclein纤维化和聚集[28]。此外Huang等人指出,鱼藤酮还能够诱导管家蛋白GADPH易位,使分子间二硫键的形成,导致GADPH在胞浆中聚集[32]。
3.5 鱼藤酮导致蛋白降解
泛素-蛋白酶系统(UPS)和自嗜-溶酶体系统(ALP)是机体正常修复、清除机体错误折叠或异常集聚蛋白质的重要途径[33]。然而近年来研究显示,这两条途径在PD病理学的发生中起着重要作用[34]。Ren等人指出PD相关蛋白parkin能够对错误折叠的微管蛋白起到泛素化降解作用,可能是机体保护神经细胞避免PD发生的一个机制[35]。
目前尚无直接证据表明自噬直接参与了鱼藤酮关联PD。但是,Pan等指出自噬增强子雷帕霉素(Rapamycin)能够通过加强自噬,削弱鱼藤酮诱导的神经细胞凋亡。暗示Rapamycin触发的自噬或因参与清除不需要的集聚蛋白或损伤的线粒体起到神经保护作用[36]。
3.6 鱼藤酮导致兴奋中毒
兴奋中毒是指各种原因引起脑损伤时,兴奋性神经递质从神经末梢释放增加,受体过度激活,引起兴奋毒性,兴奋毒性参与了多种神经系统疾病的发生,如中风、脑损伤、多发性硬化和神经变性疾病的发生坏死和凋亡[37]。谷氨酸是机体中一种重要的兴奋性的神经递质,存在于50%以上的神经组织,并在神经元兴奋中起到扮演重要角色。在病理状态如能量不足、氧化应激、线粒体功能紊乱、钙超载等时,谷氨酸释放过多,产生兴奋毒性,对神经元细胞产生损伤[37-38]。Wu等人分别于2007年和2009年报道,鱼藤酮能够加强谷氨酸兴奋中毒诱导多巴胺神经元产生毒性。这个结果出现,暗示鱼藤酮触发的中脑多巴胺能神经元毒性可能与兴奋中毒有关[39-40]。
3.7 鱼藤酮耗竭神经元营养因子
资料显示,神经营养因子在鱼藤酮诱发的神经变性疾病中起着关键作用[41-43]。Ming等人在2009年发现人视网膜内皮细胞会分泌源于神经胶质细胞的和大脑的神经营养因子以保护多巴胺能神经元免于鱼藤酮诱导的神经毒性[43]。之后,Xiong等人发现鱼藤酮会导致血管内皮生长因子(VEGF)在中脑的表达显著降低[44]。这两个结果的出现,暗示了鱼藤酮诱导的神经毒性涉及了相关神经营养因子耗竭。
3.8 鱼藤酮与衰老
PD是三大神经变性疾病之一,其发病率仅次于AD。证据表明,PD是一个与年龄相关的神经变性疾病[45]。而Cannon 2009年报道,不同年龄的雄性小鼠(3,7,12~14个月),以腹腔注射的方式摄入鱼藤酮,中年鼠相比于年轻小鼠对鱼藤酮更加敏感,更易产生神经毒性[46]。暗示衰老参与鱼藤酮诱导的神经毒性并关联PD的发生。
3.9 鱼藤酮与Ca2+过载
资料显示,胞内Ca2+稳态失衡,会造成急性神经损伤,诱导神经毒性和神经凋亡,并参与神经系统疾病的发生[47-48]。Wang等学者发现,鱼藤酮在诱导SH-SY5Y细胞凋亡时相伴着 Ca2+通道开放,胞内Ca2+水平高涨[26]。表明Ca2+稳态失衡可能是鱼藤酮诱导的神经毒性的因素之一。
3.10 鱼藤酮与多巴胺
多巴胺是中枢系统的一种神经递质,能够帮助调节机体运动和机械行为,此外,它又是下丘脑神经内分泌轴的一个重要成分,对合成去甲肾上腺素、肾上腺素和中枢神经系统都起着重要作用[12]。资料显示,多巴胺神经传递畸参与了多种神经系统疾病,如AD、PD的发生[49]。然而,有关鱼藤酮关联多巴胺导致神经毒性的假说存在分歧。比如Abdin等人报道鱼藤酮能够以剂量依赖的方式导致中脑纹状体电压降低、线粒体去极化、氨基酸和多巴胺的释放增加,诱发神经毒性[14]。而Bayersdorfer指出,胞内多巴胺水平降低,会减小神经毒性,并对多巴胺神经能元起到保护作用[50]。暗示多巴胺内功能稳态对多巴胺能神经元活性起着关键作用。
3.11 鱼藤酮与细胞周期
近年来,迷乱的细胞周期被认为与神经死亡和神经系统疾病的发生有关[51]。证据表明鱼藤酮会导致细胞周期紊乱,诱导细胞凋亡[52-53]。如Wang等人发现,鱼藤酮能以浓度依赖的方式,使SH-SY5Y细胞停滞停留在G2/M期,而用胞内Ca2+螯合剂BAPTA能够抑制鱼藤酮导致的G2/M期停滞,并起到抑制凋亡,保护神经的作用[54]。
3.12 其他机制
成人脑神经元的新生主要发生在两个区域,脑室下区和海马齿状回颗粒下层,这两个脑区同样也是神经干细胞的来源,神经干细胞能够迁移到黑质致密部并分化成多巴胺能神经元[3]。而Ishido等人证明鱼藤酮暴露能以浓度依赖的方式抑制体外模型中神经干细胞的迁移和增殖,诱导神经细胞凋亡[55]。这个证据也首次证明了鱼藤酮的神经毒性涉及了功能受损的神经干细胞。
此外,鱼藤酮还能通过激活MAPK信号级联的c-Jun,,JNK和P38诱导神经细胞的凋亡,关联PD的发生[56-57],如Wu等人发现鱼藤酮能够激活p38(MAPK), P-p38(MAPK), p53, 和Bax蛋白能诱发神经毒性[57]。这些结果表明鱼藤酮触发的神经毒性涉及了信号通路的参与。
4 小 结
鱼藤酮原本是农业上广泛运用的植物源杀虫剂,现在却被认为具有神经毒性,能够高度复制PD的病理学和临床学相关特征,如多巴胺能神经元凋亡以及淀粉蛋白Lwey小体的集聚,关联PD的发生。然而,目前关于鱼藤酮诱发神经毒性的机制并不全面,有些问题尚为查明。比半衰期短,降解快,难以进入全身血液循环的鱼藤酮是以何种机制进入人体、如何抑制线粒体功能复合物Ⅰ、如何诱导氧化应激、诱导氧化应激的具体成分、其中是否存在重要信号通路交叉共同作用等。因而,更加深入研究鱼藤酮诱发神经毒性的分子机制,可为更好寻找鱼藤酮相关的神经系统疾病治疗提供实验基础和理论依据,对人类健康起着重要意义。
参考文献:
[1] BOVE J, PROU D, PERIER C, et al. Toxin-induced models of Parkinson's disease [J]. Neurorx, 2005, 2(3): 484-494.
[2] HISATA J S. Lake and stream rehabilitation: rotenone use and health risks [M]. Final Supplemental Environmental Impact Statement. Olympia: Washington Department of Fish and Wildlife, 2002,
[3] XIONG N, LONG X, XIONG J, et al. Mitochondrial complex I inhibitor rotenone-induced toxicity and its potential mechanisms in Parkinson's disease models [J]. Crit Rev Toxicol, 2012, 42(7): 613-632.
[4] MARKING L L. Oral toxicity of rotenone to mammals [M]. US Department of the Interior, Fish and Wildlife Service, 1988.
[5] BOVE J, PERIER C. Neurotoxin-based models of Parkinson's disease [J]. Neuroscience, 2012, 211:51-76.
[6] TANNER C M, KAMEL F, ROSS G W, et al. Rotenone, paraquat, and Parkinson's disease [J]. Environ Health Perspect, 2011, 119(6): 866-872.
[7] TALPADE D J, GREENE J G, HIGGINS D S, et al. In vivo labeling of mitochondrial complex I (NADH:ubiquinone oxidoreductase) in rat brain using [(3)H]dihydrorotenone [J]. J Neurochem, 2000, 75(6): 2611-2621.
[8] SCHAPIRA A H. Mitochondrial complex I deficiency in Parkinson's disease [J]. Adv Neurol, 1993, 60:288-291.
[9] SCHULER F, CASIDA J E. Functional coupling of PSST and ND1 subunits in NADH:ubiquinone oxidoreductase established by photoaffinity labeling [J]. Biochim Biophys Acta, 2001, 1506(1): 79-87.
[10] NISTICO R, MEHDAWY B, PICCIRILLI S, et al. Paraquat- and rotenone-induced models of Parkinson's disease [J]. Int J Immunopathol Pharmacol, 2011, 24(2): 313-322.
[11] DHILLON A S, TARBUTTON G L, LEVIN J L, et al. Pesticide/environmental exposures and Parkinson's disease in East Texas [J]. Journal of Agromedicine, 2008, 13(1): 37-48.
[12] UVERSKY V N. Neurotoxicant-induced animal models of Parkinson's disease: understanding the role of rotenone, maneb and paraquat in neurodegeneration [J]. Cell Tissue Res, 2004, 318(1): 225-241.
[13] KWEON G R, MARKS J D, KRENCIK R, et al. Distinct mechanisms of neurodegeneration induced by chronic complex I inhibition in dopaminergic and non-dopaminergic cells [J]. J Biol Chem, 2004, 279(50): 51783-5192.
[14] ABDIN A A, HAMOUDA H E. Mechanism of the neuroprotective role of coenzyme Q10 with or without L-dopa in rotenone-induced parkinsonism [J]. Neuropharmacology, 2008, 55(8): 1340-6.
[15] MOON Y, LEE K H, PARK J H, et al. Mitochondrial membrane depolarization and the selective death of dopaminergic neurons by rotenone: protective effect of coenzyme Q10 [J]. J Neurochem, 2005, 93(5): 1199-208.
[16] ISENBERG J S, KLAUNIG J E. Role of the mitochondrial membrane permeability transition (MPT) in rotenone-induced apoptosis in liver cells [J]. Toxicol Sci, 2000, 53(2): 340-351.
[17] PRZEDBORSKI S, ISCHIROPOULOS H. Reactive oxygen and nitrogen species: weapons of neuronal destruction in models of Parkinson's disease [J]. Antioxid Redox Signal, 2005, 7(5-6): 685-693.
[18] ETHELL D W, FEI Q. Parkinson-linked genes and toxins that affect neuronal cell death through the Bcl-2 family [J]. Antioxidants & Redox Signaling, 2009, 11(3): 529-540.
[19] RADAD K, RAUSCH W D, GILLE G. Rotenone induces cell death in primary dopaminergic culture by increasing ROS production and inhibiting mitochondrial respiration [J]. Neurochem Int, 2006, 49(4): 379-386.
[20] BASHKATOVA V, ALAM M, VANIN A, et al. Chronic administration of rotenone increases levels of nitric oxide and lipid peroxidation products in rat brain [J]. Exp Neurol, 2004, 186(2): 235-241.
[21] XIONG N, HUANG J, ZHANG Z, et al. Stereotaxical infusion of rotenone: a reliable rodent model for Parkinson's disease [J]. PLoS One, 2009, 4(11): e7878.
[22] CHOU A P, LI S, FITZMAURICE A G, et al. Mechanisms of rotenone-induced proteasome inhibition [J]. Neurotoxicology, 2010, 31(4): 367-372.
[23] TADA-OIKAWA S, HIRAKU Y, KAWANISHI M, et al. Mechanism for generation of hydrogen peroxide and change of mitochondrial membrane potential during rotenone-induced apoptosis [J]. Life Sci, 2003, 73(25): 3277-3288.
[24] UEDA S, MASUTANI H, NAKAMURA H, et al. Redox control of cell death [J]. Antioxid Redox Signal, 2002, 4(3): 405-414.
[25] AHMADI F A, LINSEMAN D A, GRAMMATOPOULOS T N, et al. The pesticide rotenone induces caspase-3-mediated apoptosis in ventral mesencephalic dopaminergic neurons [J]. J Neurochem, 2003, 87(4): 914-921.
[26] WANG X, QIN Z H, LENG Y, et al. Prostaglandin A1 inhibits rotenone-induced apoptosis in SH-SY5Y cells [J]. J Neurochem, 2002, 83(5): 1094-1102.
[27] DAUER W, PRZEDBORSKI S. Parkinson's disease: mechanisms and models [J]. Neuron, 2003, 39(6): 889-909.
[28] UVERSKY V N, LI J, FINK A L. Pesticides directly accelerate the rate of alpha-synuclein fibril formation: a possible factor in Parkinson's disease [J]. FEBS Lett, 2001, 500(3): 105-108.
[29] TIEU K. A guide to neurotoxic animal models of Parkinson's disease [J]. Cold Spring Harb Perspect Med, 2011, 1(1): a009316.
[30] GEORGE S, MOK S S, NURJONO M, et al. alpha-Synuclein transgenic mice reveal compensatory increases in Parkinson's disease-associated proteins DJ-1 and parkin and have enhanced alpha-synuclein and PINK1 levels after rotenone treatment [J]. J Mol Neurosci, 2010, 42(2): 243-254.
[31] SHERER T B, KIM J H, BETARBET R, et al. Subcutaneous rotenone exposure causes highly selective dopaminergic degeneration and alpha-synuclein aggregation [J]. Exp Neurol, 2003, 179(1): 9-16.
[32] HUANG J, HAO L, XIONG N, et al. Involvement of glyceraldehyde-3-phosphate dehydrogenase in rotenone-induced cell apoptosis: relevance to protein misfolding and aggregation [J]. Brain Res, 2009, 1279:1-8.
[33] GOLDBERG A L. Protein degradation and protection against misfolded or damaged proteins [J]. Nature, 2003, 426(6968): 895-899.
[34] PAN T, KONDO S, LE W, et al. The role of autophagy-lysosome pathway in neurodegeneration associated with Parkinson's disease [J]. Brain, 2008, 131(Pt 8): 1969-1978.
[35] REN Y, ZHAO J, FENG J. Parkin binds to α/β tubulin and increases their ubiquitination and degradation [J]. The Journal of Neuroscience, 2003, 23(8): 3316-3324.
[36] PAN T, RAWAL P, WU Y, et al. Rapamycin protects against rotenone-induced apoptosis through autophagy induction [J]. Neuroscience, 2009, 164(2): 541-551.
[37] MEHTA A, PRABHAKAR M, KUMAR P, et al. Excitotoxicity: bridge to various triggers in neurodegenerative disorders [J]. Eur J Pharmacol, 2013, 698(1-3): 6-18.
[38] ISHIKAWA M. Abnormalities in glutamate metabolism and excitotoxicity in the retinal diseases [J]. Scientifica (Cairo), 2013(3), 2013(3):528-940.
[39] WU Y N, JOHNSON S W. Rotenone reduces Mg2+-dependent block of NMDA currents in substantia nigra dopamine neurons [J]. Neurotoxicology, 2009, 30(2): 320-325.
[40] WU Y N, JOHNSON S W. Rotenone potentiates NMDA currents in substantia nigra dopamine neurons [J]. Neurosci Lett, 2007, 421(2): 96-100.
[41] FALK T, ZHANG S, SHERMAN S J. Vascular endothelial growth factor B (VEGF-B) is up-regulated and exogenous VEGF-B is neuroprotective in a culture model of Parkinson's disease [J]. Mol Neurodegener, 2009, 4:49.
[42] CHO H S, KIM S, LEE S Y, et al. Protective effect of the green tea component, L-theanine on environmental toxins-induced neuronal cell death [J]. Neurotoxicology, 2008, 29(4): 656-662.
[43] MING M, LI X, FAN X, et al. Retinal pigment epithelial cells secrete neurotrophic factors and synthesize dopamine: possible contribution to therapeutic effects of RPE cell transplantation in Parkinson's disease [J]. J Transl Med, 2009, 7(1):53.
[44] XIONG N, ZHANG Z, HUANG J, et al. VEGF-expressing human umbilical cord mesenchymal stem cells, an improved therapy strategy for Parkinson's disease [J]. Gene Ther, 2011, 18(4): 394-402.
[45] REEVE A, SIMCOX E, TURNBULL D. Ageing and Parkinson's disease: Why is advancing age the biggest risk factor? [J]. Ageing Res Rev, 2014, 14C:19-30.
[46] CANNON J R, TAPIAS V, NA H M, et al. A highly reproducible rotenone model of Parkinson's disease [J]. Neurobiol Dis, 2009, 34(2): 279-290.
[47] LAZAREWICZ J W. Calcium transients in brain ischemia: role in neuronal injury [J]. Acta Neurobiol Exp (Wars), 1996, 56(1): 299-311.
[48] MATTSON M P. Calcium and neuronal injury in Alzheimer's disease. Contributions of beta-amyloid precursor protein mismetabolism, free radicals, and metabolic compromise [J]. Ann N Y Acad Sci, 1994, 747:50-76.
[49] MORGAN D G, MAY P C, FINCH C E. Dopamine and serotonin systems in human and rodent brain: effects of age and neurodegenerative disease [J]. J Am Geriatr Soc, 1987, 35(4): 334-45.
[50] BAYERSDORFER F, VOIGT A, SCHNEUWLY S, et al. Dopamine-dependent neurodegeneration in Drosophila models of familial and sporadic Parkinson's Disease [J]. Neurobiology of Disease, 2010, 40(1): 113-119.
[51] ZHANG Z, CAO X, XIONG N, et al. DNA polymerase-β is required for 1-methyl-4-phenylpyridinium-induced apoptotic death in neurons [J]. Apoptosis, 2010, 15(1): 105-15.
[52] GONCALVES A P, MAXIMO V, LIMA J, et al. Involvement of p53 in cell death following cell cycle arrest and mitotic catastrophe induced by rotenone [J]. Biochim Biophys Acta, 2011, 1813(3): 492-499.
[53] ARMSTRONG J S, HORNUNG B, LECANE P, et al. Rotenone-induced G2/M cell cycle arrest and apoptosis in a human B lymphoma cell line PW [J]. Biochem Biophys Res Commun, 2001, 289(5): 973-978.
[54] WANG X J, XU J X. Possible involvement of Ca2+signaling in rotenone-induced apoptosis in human neuroblastoma SH-SY5Y cells [J]. Neurosci Lett, 2005, 376(2): 127-32.
[55] ISHIDO M, SUZUKI J. Inhibition by rotenone of mesencephalic neural stem-cell migration in a neurosphere assay in vitro [J]. Toxicol In Vitro, 2010, 24(2): 552-557.
[56] CHOI B S, KIM H, LEE H J, et al. Celastrol from 'Thunder God Vine' protects SH-SY5Y cells through the preservation of mitochondrial function and inhibition of p38 MAPK in a rotenone model of Parkinson's disease [J]. Neurochem Res, 2014, 39(1): 84-96.
[57] WU F, WANG Z, GU J H, et al. p38(MAPK)/p53-Mediated Bax induction contributes to neurons degeneration in rotenone-induced cellular and rat models of Parkinson's disease [J]. Neurochem Int, 2013, 63(3): 133-140.
