二氯乙酸通过抑制HIF-1α、激活p53凋亡通路 增强替莫唑胺的化疗作用
2014-06-27徐高峰王茂德白晓斌谢万福李瑞春李传坤
徐高峰,王茂德,白晓斌,谢万福,李瑞春,李传坤
(西安交通大学医学院第一附属医院神经外科,陕西西安 710061)
恶性肿瘤实体内存在缺氧微环境,肿瘤细胞的有氧糖酵解异常活跃,这种代谢表型被称为W效应[1],有利于肿瘤增殖并使肿瘤细胞对化疗药物的敏感性降低[2]。人脑胶质瘤是对化疗最具抵抗性的肿瘤之一。替莫唑胺(temozolomide, TMZ)是治疗胶质瘤的一线药物,但其有效率仍然很低。TMZ治疗胶质瘤的主要机制之一是诱导肿瘤细胞凋亡。最近的研究发现,TMZ可通过抑制低氧诱导因子(hypoxia-inducible factor-1 alpha, HIF-1α)影响肿瘤细胞代谢[3]。二氯乙酸(dichloroacetate, DCA)通过抑制肿瘤细胞糖酵解、恢复肿瘤细胞线粒体膜电位而促进肿瘤细胞凋亡、抑制肿瘤细胞生长。由于DCA具有逆转肿瘤糖酵解的作用,使其成为很有吸引力的肿瘤化疗增敏剂[4-6]。目前,鲜有文献报道DCA对TMZ的化疗增敏作用。由此,我们将探讨DCA能否增强TMZ对人脑胶质瘤的治疗作用及其机制。
1 材料与方法
1.1材料人脑胶质瘤细胞株SHG44、U87(中科院上海细胞研究所);人正常胶质细胞(HA)(西安交通大学医学院神经解剖实验室保存);RPMI1640培养基、胎牛血清、胰酶、青链霉素双抗 (Gibco公司);3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(3-(4,5-dimethyl-thiazol-2)-2,5-diphenyl tetrazolium bromide,MTT)(美国Sigma公司);TMZ(天津天士力);DCA(美国Sigma公司);兔抗人HIF-1α、p53、Bax、Bcl2多克隆抗体(武汉博士德生物工程有限公司);流式细胞仪(美国BD Biosciences公司)。
1.2细胞培养SHG44、U87、HA细胞用含有100 mL/L胎牛血清,100 U/mL青霉素,100 μg/mL链霉素的RPMI 1640培养基,于37 ℃、50 mL/L CO2培养箱中培养。平均2~3 d传代1次,以保持细胞的对数生长。
1.3MTT法检测细胞增殖取生长状态良好处于对数生长期细胞,制成1×106cells /mL细胞悬液,接种于96孔板,每孔100 μL(设5个复孔)。培养72 h,计算相对生存率。
1.4流式细胞仪方法检测细胞凋亡百分率使用Annexin V-FITC细胞凋亡检测试剂盒,流式细胞仪检测细胞凋亡情况。流式细胞仪检测到带有绿色荧光的荧光探针FITC标记的Annexin V,直接反映与Annexin V结合的磷酯酰丝氨酸外翻这一细胞凋亡早期的重要特征及荧光探针PI标记的细胞坏死的重要特征。按预设实验分组分别取4组六孔板培养细胞,严格按照Annexin V-FITC试剂操作说明进行,反应时间结束后流式细胞仪检测凋亡率及坏死率。
1.5激光共聚焦显微镜方法检测线粒体膜电位用终浓度5 μmol/L JC-1 37 ℃孵育细胞30 min,PBS洗去残留的荧光染料。激光扫描共聚焦显微镜观察。激发光为490 nm,分别在530 nm和590 nm处采集发射光的荧光强度。阳离子荧光染色剂JC-1对膜电位高度敏感,可特异性的进入线粒体。线粒体膜电位的高低变化决定了JC-1的分布浓度。膜电位高、JC-1形成聚集体,浓度高,荧光显色为红色或橘红色,反之,则为绿色,膜电位的去极化体现为由红光到绿光的转变。激发波长为490 nm,散发波长为590 nm,获得红色荧光单位;激发波长为490 nm,散发波长为530 nm,获得绿色荧光单位;红色荧光单位/绿色荧光单位最终获得荧光比值,比值高表明线粒体膜电位较高。
1.6流式细胞仪方法检测细胞内活性氧以2.5 mL/L胰蛋白酶消化为单细胞悬液,移入离心管,离心5 min,弃上清。加入1 mL PBS+5 μL DCFDA储存液,轻轻混匀。培养箱内37 ℃孵育30 min。弃去液体,加入RPMI 1640+100 mL/L胎牛血清,孵育20 min。离心后弃上清,流式细胞仪于激发波长488 nm、发射波长525 nm条件下检测细胞内荧光特异性探针DCFDA,平均荧光强度代表细胞内活性氧水平。
1.7Westernblot方法检测蛋白的表达水平收集细胞并提取蛋白,加入适量蛋白裂解液,冰上裂解,SDS-PAGE电泳。电转至PVDF膜。50 mL/L牛奶封闭非特异性反应。一抗:HIF-1α(1∶500);p53(1∶1 000);Bax(1∶1 000);Bcl2(1∶1 000);β-actin(1∶1 000)。4 ℃孵育过夜。抗兔二抗孵育1 h,化学发光显示目的条带(按试剂盒进行操作)。扫描成像后分析其灰度值。
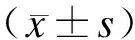
2 结 果
2.1细胞增殖的变化首先应用MTT实验对TMZ和DCA单药对SHG44、U87及HA细胞增殖的影响进行了研究。96孔板中种植人SHG44、U87及HA细胞(1×106cells/mL),每组至少5个平行孔,用MTT法检测药物对细胞增殖能力的影响。MTT结果表明:DCA(0、2、5、10、15、20 mol/mL)作用于SHG44、U87细胞72 h后,呈剂量依赖性的抑制SHG44、U87细胞增殖。TMZ(0、25、50、100、200、300 μg/mL)作用于SHG44、U87细胞72 h后,呈剂量依赖性的抑制SHG44细胞增殖。对人正常胶质细胞HA则没有抑制作用(图1A、1B)。进而,我们应用MTT实验研究DCA是否能增强TMZ对胶质瘤细胞的抑制作用。药物联合的方案为:TMZ(0、25、50、100、200、300 μg/mL)+DCA(5 mol/mL)。MTT结果表明:DCA联合TMZ作用于SHG44和U87细胞72 h后,呈剂量依赖性的抑制SHG44细胞增殖(P<0.05)。二者联合应用较TMZ单药显示出更加明显的生长抑制作用(P<0.05);二者联合情况下,TMZ的IC50剂量明显减低(图1C、1D)。TMZ(100 μg/mL)+DCA(5 mol/mL)对SHG44和U87细胞的抑制作用明显强于TMZ和DCA单独使用(P<0.05),对人正常胶质细胞HA细胞无抑制作用(图1E)。最终,我们选择TMZ(100 μg/mL)+DCA(5 mol/mL)联合针对SHG44细胞进行抑制作用的机制研究。
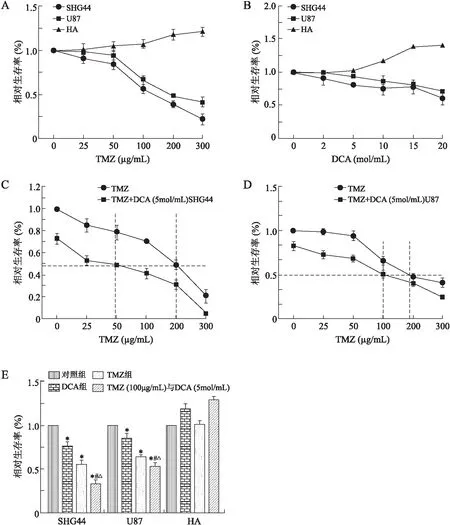

图1 DCA单药、TMZ单药及二者联合对胶质瘤细胞增殖的影响Fig.1 Effects of DCA alone, TMZ alone and DCA/TMZ combination on proliferation of glioma cells A:不同浓度TMZ对SHG44、U87、HA细胞增殖的影响;B:不同浓度DCA对SHG44、U87、HA细胞增殖的影响;C:TMZ与DCA(5mol/mL)联合对SHG44细胞增殖的影响;D:TMZ与DCA(5mol/mL)联合对U87细胞增殖的影响;E:TMZ单药及TMZ/DCA联合对SHG44细胞增殖的影响。与对照组比较,*P<0.05;与DCA组比较,#P<0.05;与TMZ组比较,△P<0.05。
2.2细胞线粒体膜电位和细胞内活性氧的变化通过激光共聚焦显微镜对SHG44细胞线粒体膜电位(mitochondrial membrane potential, MMP)进行了检测,结果显示DCA和TMZ均可有效降低线粒体膜电位,二者联合降低线粒体膜电位的效果强于二者单独使用(P<0.05)(表1,图2A、2B)。与此相似的是,DCA和TMZ联合较二者单用提高细胞内活性氧(reactive oxygen species, ROS)含量作用明显增强(P<0.05)(表1,图2C、2D)。
2.3细胞凋亡的变化为了探讨DCA是否能够增强TMZ对SHG44细胞诱导凋亡的作用,对TMZ单药、DCA单药以及二者联合处理SHG44细胞72 h后细胞凋亡情况进行了流式细胞检测。采用的方法是Annxin V-FITC、PI双标记流式细胞仪技术。在散点图中,左下象限代表正常细胞,右下象限代表早期凋亡细胞,右上象限代表晚期凋亡细胞,左上象限代表坏死细胞。结果显示,TMZ单药和DCA单药对SHG44细胞都有不同程度的诱导凋亡的作用,与对照组相比,有显著性差异(P<0.05)。二者联合,诱导凋亡较二者单独应用细胞凋亡明显增加,显著性差异明显(P<0.05)(表1,图2E、2F)。
表1DCA、TMZ单药及二者联合对SHG44细胞线粒体膜电位、细胞内活性氧及细胞凋亡的影响
Tab.1 Effects of DCA alone, TMZ alone and DCA/TMZ combination on apoptosis, production of ROS, and MMP in SHG44 cells

(n=5,
与对照组比较,*P<0.05; 与DCA组比较,#P<0.05;与TMZ组比较,△P<0.05。
2.4Westernblot结果在细胞凋亡过程中,有很多凋亡相关蛋白对细胞凋亡进行调控。为了探讨是否TMZ、DCA或二者联合通过统一信号通路诱导细胞凋亡,对SHG44细胞的HIF-1α、p53、Bax、Bcl-2蛋白利用Western blot法进行检测。将1×106cells/mL细胞接种于培养板,待细胞长到8分满时,加入100 μg/mL的TMZ 5 mol/mL的DCA以及二者联用处理SHG44细胞,72 h收集细胞内蛋白萃取液,进行Western blot检测(图3A)。将几种蛋白与内参表达进行吸光度定量分析,绘制相对表达量的柱状图。结果显示,TMZ/DCA联合对HIF-1α的表达有明显抑制作用(P<0.05)。二者联用明显提高p53、Bax表达,而降低Bcl-2的表达(P<0.05)。这些结果显示,TMZ/DCA联合能显著抑制HIF-1α的表达并通过p53凋亡通路诱导细胞凋亡(图3B)。
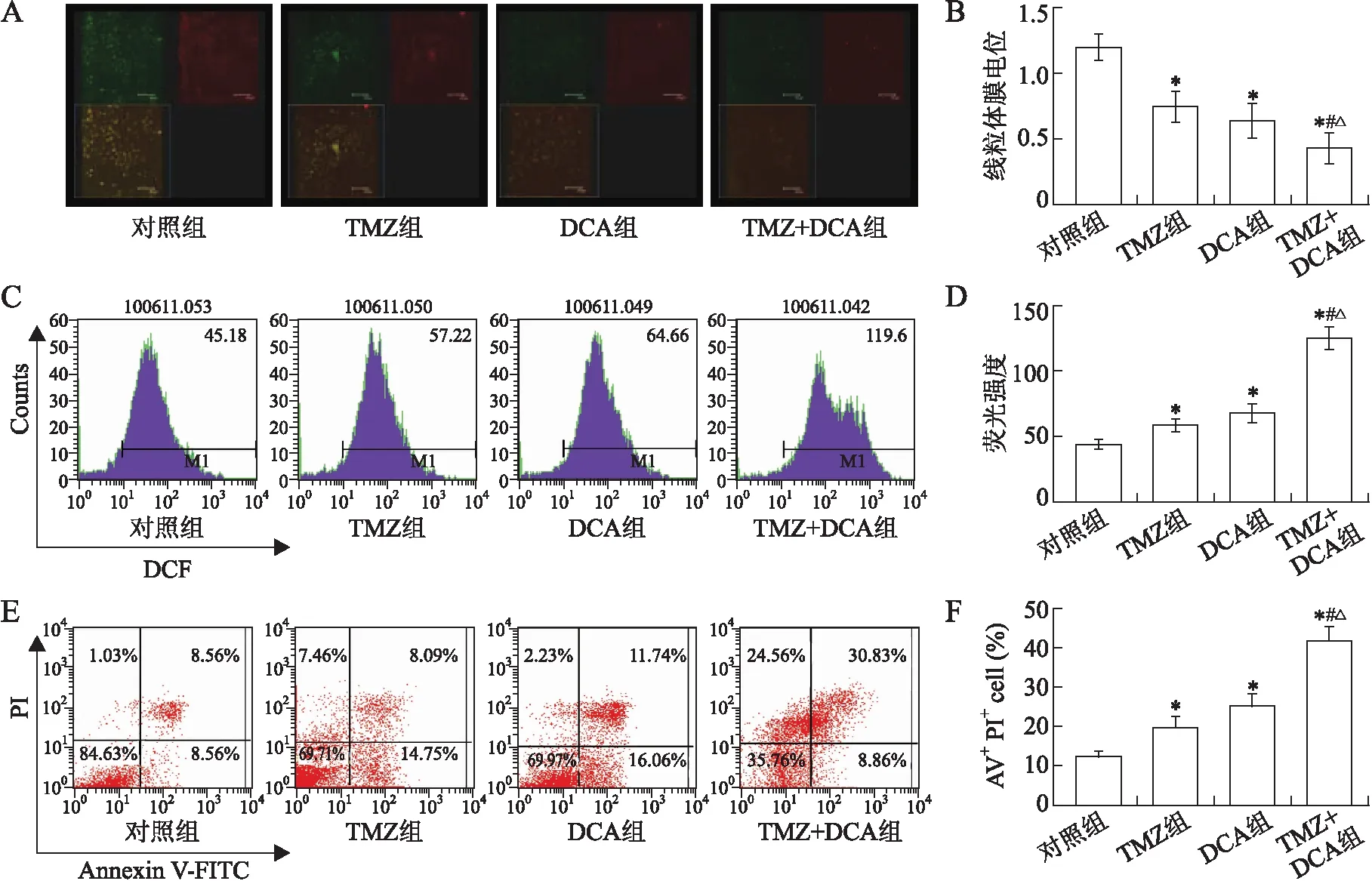
图2DCA单药、TMZ单药及二者联合对SHG44细胞线粒体膜电位、细胞内活性氧含量及细胞凋亡的影响
Fig.2 Effects of DCA alone, TMZ alone and DCA/TMZ combination on the induction of MMP, production of ROS and apoptosis of SHG44 cells
A、B: DCA、TMZ单药及二者联合对SHG44细胞线粒体膜电位的影响(bar:150 μmol/L):C、D: DCA、TMZ单药及二者联合对SHG44细胞内活性氧的影响;E、F:DCA、TMZ单药及二者联合对SHG44细胞凋亡的影响。与对照组比较,*P<0.05;与DCA组比较,#P<0.05;与TMZ组比较,△P<0.05。
3 讨 论
近年来的许多文献指出:糖酵解表型在大多数肿瘤中普遍存在并赋予肿瘤细胞凋亡抵抗的特性;具有较多缺氧区域的肿瘤,其治愈率通常较低,这提示肿瘤内部的缺氧微环境可能与肿瘤细胞抗药性有关[7-8]。大多数恶性肿瘤的线粒体功能异常,线粒体膜电位处于超极化状态,这是肿瘤微环境的主要特征之一,也是凋亡抵抗产生的主要原因[9-11]。随着对恶性肿瘤病理机制认识的加深,靶向肿瘤微环境治疗肿瘤越来越引起人们的关注。抑制肿瘤生长理想的治疗策略是诱导肿瘤细胞凋亡。而要实现这一目标,最好是恢复肿瘤细胞线粒体功能,逆转线粒体的超极化状态。

图3SHG44细胞蛋白提取液中HIF-1α、p53、Bax、Bcl-2蛋白的表达
Fig.3 Effect of DCA alone, TMZ alone and DCA/TMZ combination on the expressions of HIF-1α, p53, Bax and Bcl-2 in SHG44 cells by Western blotting
A:SHG44细胞蛋白提取液中HIF-1α、p53、Bax、Bcl-2蛋白表达;B:SHG44细胞蛋白提取液中HIF-1α、p53、Bax、Bcl-2蛋白表达定量分析柱状图。与对照组比较,*P<0.05;与DCA组比较,#P<0.05;与TMZ组比较,△P<0.05。
HIF-1α在肿瘤细胞缺氧适应过程中起着调节核心的作用,控制着一系列复杂的转录过程以帮助肿瘤细胞生存并获得侵袭增殖的能力[12-13]。在糖酵解途径的下游,有很多可供选择的治疗靶点,其中PDK1在影响线粒体功能上起着关键作用[14-15]。DCA作为PDK1特异性的药物性抑制剂能明显降低线粒体膜电位,增加ROS含量,恢复线粒体功能,使细胞内ROS含量增加,使线粒体凋亡途径激活,从而抑制肿瘤增殖[16-17]。本研究结果显示,DCA在体外能抑制胶质瘤SHG44、U87细胞增殖,并且能明显增强TMZ对SHG44、U87体内外模型的抑制作用。而对于正常胶质细胞HA细胞却没有抑制作用。二者联合应用能明显诱导SHG44细胞凋亡。DCA能明显降低线粒体膜电位,增加ROS含量,说明DCA能恢复线粒体功能,使细胞内ROS含量增加,使线粒体凋亡途径激活,从而抑制肿瘤增殖。
TMZ抗肿瘤作用主要是由于它能促进肿瘤细胞凋亡。一个影响TMZ对胶质瘤化疗效果的因素是p53状态。在GBM中,p53功能的缺失是普遍存在的现象。p53功能的缺失使肿瘤细胞凋亡的发生受抑制,并与GBM的进展有关[18]。作为最常见的抑癌基因,p53的功能丧失,诱使肿瘤细胞代谢和线粒体的变化,参与形成肿瘤细胞糖酵解表型[19-20]。另外,p53能够抑制HIF-1α,因为p53和HIF-1α竞争同一转录因子,p53的失活,以HIF-1α依赖的方式促进Warburg效应。这些研究证明了p53与肿瘤细胞代谢之间的密切关系[21-22]。最近有研究发现,TMZ能够抑制GBM中HIF-1α的表达[3]。这些发现将TMZ的细胞毒性作用与肿瘤代谢联系起来。DCA能有效恢复肿瘤细胞线粒体膜电位,促进细胞凋亡。在影响细胞代谢这一点上,DCA和TMZ具有共同点。这是二者联合具有协同作用的可能的基础。TMZ通常会提高肿瘤细胞p53的表达。那么,TMZ就有可能通过上调p53的表达来抑制HIF-1α,从而抑制肿瘤糖酵解、逆转酸性环境来治疗肿瘤。本节实验通过Western blot检测显示,TMZ和DCA都能够降低SHG44细胞HIF-1α的表达,而p53的表达升高,激活p53凋亡通路,促进细胞凋亡。证实TMZ可能通过抑制HIF-1α而抑制SHG44细胞糖酵解,这种作用可能是TMZ上调p53表达的结果。
总之,本研究显示DCA能增强TMZ对人脑胶质瘤的抑制作用,其机制与抑制HIF-1α,激活p53凋亡信号通路有关。
参考文献:
[1] WARBURG O, WIND F, NEGELEIN E. The metabolism of tumors in the body[J]. J Gen Physiol, 1927, 8 (23):519-530.
[2] KAMB A, WEE S, LENGAUER C. Why is cancer drug discovery so difficult?[J]. Nat Rev Drug Discov, 2007, 6(2):115-120.
[3] MATHIEU V, LE MERCIER M, DE NEVE N, et al. Galectin-1 knockdown increases sensitivity to temozolomide in a B16F10 mouse metastatic melanoma model[J]. J Invest Dermatol, 2007, 127 (10):2399-2410.
[4] BONNET S, ARCHER SL, ALLAUNIS-TURNER J, et al. A mitochondria-K+channel axis is suppressed in cancer and its normalization promotes apoptosis and inhibits cancer growth[J]. Cancer Cell, 2007, 11(1):37-51.
[5] CAIRNS RA, PAANDREOU I, SUTPHIN PD, et al. Metabolic targeting of hypoxia and HIF1 in solid tumors can enhance cytotoxic chemotherapy[J]. Proc Natl Acad Sci USA, 2007, 104(22): 9445-9450.
[6] CAO W, YACOUB S, SHIVERICK KT, et al. Dichloroacetate (DCA) sensitizes both wild-type and over expressing Bcl-2 prostate cancer cellsinvitroto radiation[J]. Prostate, 2008, 68(11):1223-1231.
[7] KROEMER G, POUYSSEGUR J. Tumor cell metabolism: cancer’s Achilles’ heel[J]. Cancer Cell, 2008, 13 (6):472-482.
[8] VANDER HEIDEN MG, CANTLEY LC, THOMPSON CB. Understanding the Warburg effect: the metabolic requirements of cell proliferation[J]. Science, 2009, 324 (5930):1029-1033.
[9] LOEZ-RIOS F, SANCHEZ-ARAGO M, GARCIA E, et al. Loss of the mitochondrial bioenergetic capacity underlies the glucose avidity of carcinomas[J]. Cancer Res, 2007, 67(19):9013-9017.
[10] CHEN LB. Mitochondrial membrane potential in living cells[J]. Annu Rev Cell Biol, 1988, 4: 155-181.
[11] KROEMER G, GALLUZZI L, BRENNER C. Mitochondrial membrane permeabilization in cell death[J]. Physiol Rev, 2007, 87(1):99-163.
[12] SEMENZA GL. HIF-1: upstream and downstream of cancer metabolism[J]. Curr Opin Genet Dev, 2010, 20(1):51-56.
[13] KIM JW, TCHERNYSHYOV I, SEMENZA GL, et al. HIF-1-mediated expression of pyruvate dehydrogenase kinase: a metabolic switch required for cellular adaptation to hypoxia[J]. Cell Metab, 2006, 3(3):177-185.
[14] KIM JW, DANG CV. Cancer's molecular sweet tooth and the Warburg effect[J]. Cancer Res, 2006, 66(18):8927-8930.
[15] MICHLAKIS ED, SUTENDRA G, DROMPARIS P, et al. Metabolic modulation of glioblastoma with dichloroacetate[J]. Sci Transl Med, 2010, 2(31):31-34.
[16] WONG JY, HUGGINS GS, DEBIDDA M, et al. Dichloroacetate induces apoptosis in endometrial cancer cells[J]. Gynecol Oncol, 2008, 109(3):394-402.
[17] ZAMZAMI N, LAROCHETTE N, KROEMER G. Mitochondrial permeability transition in apoptosis and necrosis[J]. Cell Death Differ, 2005, 12 (Suppl 2):1478-1480.
[18] TURCOTTE ML, PARLIAMENT M, FRANKO A, et al. Variation in mitochondrial function in hypoxiasensitive and hypoxia-tolerant human glioma cells[J]. Br J Cancer, 2002, 86(4): 619-624.
[19] CORCORAN CA, HUANG Y, SHEIKH MS. The regulation of energy generating metabolic pathways by p53[J]. Cancer Biol Ther, 2006, 5(12):1610-1613.
[20] MA W, SUNG HJ, PARK JY, et al. A pivotal role for p53: balancing aerobic respiration and glycolysis[J]. J Bioenerg Biomembr, 2007, 39(3):243-246 .
[21] BENSAAD K, TSURUTA A, SELAK MA, et al. TIGAR, a p53-inducible regulator of glycolysis and apoptosis[J]. Cell, 2006, 126(1):107-120.
[22] GREEN DR, CHIPUK JE. p53 and metabolism: Inside the TIGAR[J]. Cell, 2006, 126(1):30-32.
