兔动员外周血间充质干细胞集落形成能力 与神经元诱导分化研究
2014-06-27刘小慧刘金伟刘祖林汤宁宁
刘小慧,章 涛,张 潜,刘金伟,刘祖林,汤宁宁
(1. 遵义医学院附属医院贵州省细胞工程重点实验室,贵州遵义 563099; 2. 遵义医学院人体解剖学教研室,贵州遵义 563003)
间充质干细胞(mesenchymal stem cells, MSCs)因其具有体外扩增能力强和多向分化潜力而成为成体干细胞研究的主要种子细胞来源[1-4],尤其是围绕骨髓来源的间充质干细胞(bone marrow derived mesenchymal stem cells, BMMSCs)的研究最为广泛和深入[5-6]。尽管BMMSCs有其固有的优势,并具备良好的应用前景,然而抽取一定量的骨髓会给患者带来痛苦并有一定的安全风险,且随着年龄的增大,BMMSCs的数量和增殖、分化能力将明显下降[7]。因此,寻找具有临床应用前景的MSCs新来源已成为干细胞研究的新的关注点。
外周血是否存在具有MSCs特性的干细胞(peripheral blood derived mesenchymal stem cells, PBMSCs)尚存争议。相悖的研究报道可能与不同作者采用的分离、培养体系和方案存在差异有关[8-11]。外周血是否存在PBMSCs及其生物学特性还有待深入研究方可确定。若PBMSCs存在并具有与BMMSCs一样的增殖和分化能力,其具有的取材方便无痛苦等优势,有望成为MSCs新的替代资源之一。本实验采用动员后兔外周血,对其进行MSCs集落形成能力分析,并对分离、培养的兔PBMSCs进行神经元诱导分化,以验证PBMSCs的存在并确定其含量,并为今后PBMSCs治疗神经系统疾病研究提供有价值的实验依据。
1 材料与方法
1.1实验动物成年新西兰大白兔,雌雄不拘,体质量1.5~2 kg,由重庆腾鑫技术有限公司提供。本研究所采用的动物实验及操作程序经遵义医学院实验动物伦理委员会审议批准。
1.2主要试剂与仪器粒细胞集落刺激因子G-CSF(北京四环生物制药有限公司);α-MEM培养基、胎牛血清(Gibco公司);胰蛋白酶、L-谷氨酰胺(Glu,美国Hyclone公司);Ficoll分离液(天津美德太平洋科技有限公司);全反式维甲酸(Sigma公司);神经元特异性烯醇化酶(NSE)单克隆抗体、山羊血清封闭液(武汉博士德生物工程有限公司);神经元核蛋白(NeuN)单克隆抗体(Millipore公司);EnVision法HRP标记二抗(DAKO公司);DAB(Gene Tech公司);细胞计数及存活率分析仪(Beckman Coulter, USA);倒置显微镜(DMIRB DIC,Leica, Germany);自动显微照相装置(PM20-35, Olympus, Japan)。
1.3兔PBMSCs的分离、培养G-CSF按30 μg/(kg·d)剂量给予兔皮下注射,连用6 d,于第7天抽取兔抗凝外周血20 mL,按1︰1比例加入PBS液稀释,再加入到含Ficoll分离液的离心管中,离心后吸取白膜层细胞(富含单个核细胞层),采用红细胞溶解液裂解红细胞,PBS液洗涤后,细胞存活率分析仪计数细胞数和细胞活力,用含150 mL/L FBS、100 U/mL青霉素和100 μg/mL链霉素的α-MEM培养基,置于37 ℃、50 mL/L CO2饱和湿度条件下进行原代培养。待细胞生长汇合度达80%左右时,用1.25 g/L的胰蛋白酶消化细胞,进行传代培养。实验同时采集未经G-CSF动员的兔外周血,按相同方法进行PBMSCs的分离、培养。
1.4兔PBMSCs的集落形成率参考文献报道的方法[12]对兔外周血样品进行间充质干细胞集落形成率(CFE)的检测与计算,大致步骤为:分别将分离的未动员及动员后的兔外周血单个核细胞计数后,按5×105/cm2接种于6孔板中,用含150 mL/L FBS、100 U/mL青霉素和100 μg/mL链霉素的α-MEM培养基置于37 ℃、50 mL/L CO2饱和湿度条件下进行培养,3 d后换液,14 d后100 mL/L甲醛固定,结晶紫染色5 min,置解剖镜下观察,对细胞数目超过50个的集落(也称集落形成单位,CFU)进行计数。集落形成率=集落形成数/接种细胞数(单位用/106表示)。
1.5兔PBMSCs向神经元诱导分化取第2代细胞,用1.25 g/L胰蛋白酶消化后接种到预置盖玻片的6孔板中,细胞接种密度调整为2.5×104/cm2,待细胞生长汇合度达50%时(通常为培养24 h),弃去原培养基,诱导组细胞换成含1 μmol/L全反式维甲酸(ATRA)、200 mmol/L Glu和100 mL/L FBS的α-MEM培养基(2 mL/孔诱导培养液)。对照组仍用150 mL/L FBS的α-MEM培养基换液,两组于37 ℃、50 mL/L CO2饱和湿度下培养,每48 h换液1次,倒置显微镜观察形态变化,培养96 h 后采用免疫细胞化学染色对培养细胞的NeuN、NSE表达进行检测:一抗为抗兔NSE或NeuN单克隆抗体,4 ℃孵育过夜,再滴加HRP标记二抗,DAB显色,自来水冲洗(NSE需做苏木素复染30 s),自然干燥后倒置显微镜观察并拍照。
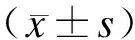
2 结 果
2.1兔PBMSCs的培养特点细胞存活分析仪分析显示,经密度梯度离心和红细胞裂解后的分离外周血单个核细胞经细胞活力均在95%以上。动员后的外周血单个核细胞原代培养24 h后,镜下可见较多短梭形及多角形贴壁细胞散在生长,3 d首次换液弃去未贴壁细胞,贴壁细胞出现集落样生长(图1A),接种10 d左右细胞生长汇合度达80%以上;传代培养的PBMSCs形态均一,呈长梭形漩涡状生长(图1B)。而未动员PBMSCs原代培养24 h后,较少细胞贴壁生长(图1C),培养10 d左右,仅有少量集落形成,且细胞易老化,传代培养均告失败(图1D)。

图1兔PBMSCs生长形态
Fig.1 Morphology of cultured rabbit PBMSCs (×100)
A:动员组PBMSCs原代培养第3天;B:动员组PBMSCs培养第2代生长形态;C:未动员组PBMSCs原代培养第3天;D:未动员组PBMSCs原代培养第10天。
2.2兔PBMSCs集落形成率本实验中共采集8份动员后兔外周血标本,均成功获得集落形成;4份未动员外周血标本,仅1份形成集落,3份均未能形成集落(图2)。以每百万个单个核细胞中集落形成单位数计算的集落形成率,动员组在2.8~10.8个/106之间,未动员组为0~3个/106之间。换言之,动员组外周血成纤维样细胞集落形成率为每百万单个核细胞中有(6.76±2.42)个,明显高于未动员组(0.75±1.29)个的水平(P<0.01)。

图2兔PBMSCs集落形成率
Fig.2 Colony forming efficiency of rabbit PBMSCs
A:未动员兔外周血成纤维样细胞集落形成单位(CFU-Fs);B:动员兔外周血成纤维样细胞集落形成单位(CFU-Fs)。放大倍数:左图×7,右图×40。
2.3兔PBMSCs神经元诱导分化能力本实验分离培养的兔PBMSCs经神经元诱导培养96 h后细胞胞体回缩,细胞出现双极或多极细胞突起,并向胞体周围伸展,类似神经元形态(图3A);经鉴定,这些细胞表达神经元特异性分子NSE和NeuN(图3C、3D)。而未诱导组细胞形态无明显变化(3B),也不表达上述神经元特异性标志。
3 讨 论
外周血中是否存在具有MSCs特性的干细胞尚存争议,其存在频率及生物学特性仍需进一步深入研究。鉴于此,本实验采用G-CSF对兔进行动员,通过未动员和动员后PBMSCs原代培养和集落形成率实验,对动员兔外周血中是否存在MSCs及其存在频率进行分析。PBMSCs原代培养结果显示,动员后的PBMSCs贴壁细胞较多,集落形成能力强,且传代后细胞呈均一长梭形漩涡状生长;而未动员PBMSCs则贴壁细胞少,易老化,传代培养失败,说明了动员后兔PBMSCs增殖能力强,细胞活性好。集落形成率结果显示,动员后外周血样品均成功获得MSCs集落形成,外周血MSCs集落形成率为(6.76±2.42)/106,

图3兔PBMSCs神经元诱导后96h镜下观察结果
Fig.3 Neuron differentiation of rabbit PBMSCs at 96 h of induction (×200)
A:神经元诱导组;B:未诱导组;C:诱导组细胞神经元特异性核蛋白(NeuN)染色;D:诱导组细胞神经元特异性烯醇化酶(NSE)染色。
远高于未动员的外周血样品(0.75±1.29)/106,动员组外周血MSCs集落形成率已接近骨髓MSCs的数量级(其报道的集落形成率为1/105)[13-14]。上述结果证明,经G-CSF动员后的兔外周血中存在着MSCs,其PBMSCs在每百万个外周血单个核细胞中含量为2.8~10.8个。此外,本实验获得的兔PBMSCs增殖能力强,细胞活性高,实验重复性好,能够稳定从外周血中分离培养出PBMSCs。
本实验还采用ATRA体外成功诱导了PBMSCs向神经元细胞分化,诱导后的细胞表达NSE和NeuN,未经诱导的细胞则不表达这些神经元细胞特异标志,说明了ATRA具有促进PBMSCs向神经细胞分化的作用。研究表明,ATRA主要是通过细胞核膜上的维甲酸受体(RAR)介导信号转导,影响下游基因的转录调控从而发挥其生物学效应[15]。RARs包含由不同基因编码的α、β与γ 3个亚型,其中RARβ是一种在神经细胞特异表达的受体,对神经元表型的决定和维持有重要作用[16]。BI等[17]发现,MSCs中几乎不表达RARβ,ATRA作用后可以增强其RARβ的表达,促进其向成神经分化,提示RARβ可能是维甲酸信号转导途径参与MSCs成神经分化的重要因素。随后他们又利用针对RARβ的siRNA腺病毒,在大鼠MSCs中证实其能有效抑制ATRA诱导的RARβ内源性表达增高,同时抑制MSCs的体外神经分化,进一步说明了RARβ在MSCs向神经元分化过程中的重要作用[18]。本实验用ATRA成功诱导了PBMSCs向神经元细胞分化,其作用机制可能是ATRA通过上调RARβ激活维甲酸信号途径,并产生相应效应有关。
目前为止,干细胞向神经细胞分化能力研究仍集中于对胚胎干细胞、神经干细胞、诱导多能干细胞和骨髓源间充质干细胞的探讨。比较而言,外周血来源的干细胞具有取材方便、基本无创伤,加之自体外周血干细胞移植也无伦理限制等优势,规避了干细胞治疗应用中的免疫排斥反应和供体缺乏两个关键问题与担忧。本实验结果表明,从动员后的外周血中能稳定分离培养出高增殖能力的PBMSCs,适宜条件下可向神经元细胞分化,这为今后临床应用PBMSCs治疗神经系统疾病提供了新的有价值的实验依据。
参考文献:
[1] BIANCO P, ROBEY PG, SIMMONS PJ. Mesenchymal stem cells:revisiting history, concepts, and assays[J]. Cell Stem Cell, 2008, 2(4):313-319.
[2] ALLICKSON JG, SANCHEZ A, YEFIMENKO N, et al. Recent studies assessing the proliferative capability of a novel adult stem cell identified in menstrual blood[J]. Open Stem Cell J, 2011, 3(2011):4-10.
[3] HE Q, WAN C, LI G. Concise review:multipotent mesenchymal stromal cells in blood[J]. Stem Cells, 2007, 25(1):69-77.
[4] FAAST R, HARRISON SJ, BEEBE LF, et al. Use of adult mesenchymal stem cells isolated from bone marrow and blood for somatic cell nuclear transfer in pigs[J]. Cloning Stem Cells, 2006, 8(3):166-173.
[5] LUONG-VAN E, GRØNDAHL L, SONG S, et al. Theinvivoassessment of a novel scaffold containing heparan sulfate for tissue engineering with human mesenchymal stem cells[J]. J Mol Histol, 2007, 38(5):459-468.
[6] GOLDBERG ED, DYGAI AM, ZYUZ'KOV GN, et al. Mechanisms of mobilization of mesenchymal precursor cell under the effect of granulocytic colony-stimulating factor and hyaluronidase[J]. Bull Exp Biol Med, 2007, 144(6):802-805.
[7] PEKOVIC V, HUTCHISON CJ. Adult stem cell maintenance and tissue regeneration in the ageing context:the role for A-type lamins as intrinsic modulators of ageing in adult stem cells and their niches[J]. J Anat, 2008, 213(1):5-25.
[8] ZVAIFLER NJ, MARINOVA-MUTAFCHIEVA L, ADAMS G, et al. Mesenchymal precursor cells in the blood of normal individuals[J]. Arthritis Res, 2000, 2(6):477-488.
[9] TONDREAU T, MEULEMAN N, DELFORGE A, et al. Mesenchymal stem cells derived from CD133-positive cells in mobilized peripheral blood and cord blood:proliferation, Oct4 expression, and plasticity[J]. Stem Cells, 2005, 23(8):1105-1112.
[10] WEXLER SA, DONALDSON C, DENNING-KENDALL P, et al. Adult bone marrow is a rich source of human mesenchymal stem cells but umbilical cord and mobilized adult blood are not[J]. Br J Haematol, 2003, 121(2):368-374.
[11] OJEDA-URIBE M, BRUNOT A, LENAT A, et al. Failure to detect spindle-shaped fibroblastoid cell progenitors in PBPC collections[J]. Acta Haematol, 1993, 90(3):139-143.
[12] KUZNETSOV SA, MANKANI MH, ROBEY PG. Effect of serum on human bone marrow stromal cells:exvivoexpansion andinvivobone formation[J]. Transplantation, 2000, 70(12):1780-1787.
[13] GNECCHI M, MELO LG. Bone marrow-derived mesenchymal stem cells:isolation, expansion, characterization, viral transduction, and production of conditioned medium[J]. Methods Mol Biol, 2009, 482(2):281-294.
[14] MARTINS AA, PAIVA A, MORGADO JM, et al. Quantification and immunophenotypic characterization of bone marrow and umbilical cord blood mesenchymal stem cells by multicolor flow cytometry[J]. Transplant Proc, 2009, 41(3):943-946.
[15] NEZZAR H, CHIAMBARETTA F, MARCEAU G, et al. Molecular and metabolic retinoid pathways in the human ocular surface[J]. Mol Vis, 2007, 13:1641-1650.
[16] MARK M, GHYSELINCK NB, CHAMBON P. Function of retinoid nuclear receptors:lessons from genetic and pharmacological dissections of the retinoic acid signaling pathway during mouse embryogenesis[J]. Annu Rev Pharmacol Toxicol, 2006, 46(1):451-480.
[17] BI Y, GONG M, ZHANG X, et al. Pre-activation of retinoid signaling facilitates neuronal differentiation of mesenchymal stem cells[J]. Dev Growth Differ, 2010, 52(5):419-431.
[18] 毕杨,龚敏,何昀,等. 腺病毒介导siRNA抑制全反式维甲酸诱导的骨髓间充质干细胞RARβ表达[J]. 生物工程学报,2012, 28(5):632-642.
