香石竹毛状根诱导、离体培养及其植株再生
2014-06-24施和平朱远锋王蓓孙蒋兵黄胜琴
施和平,朱远锋,王蓓,孙蒋兵,黄胜琴
华南师范大学生命科学学院广东省植物发育生物工程重点实验室,广东广州510631
组织工程与细胞培养
香石竹毛状根诱导、离体培养及其植株再生
施和平,朱远锋,王蓓,孙蒋兵,黄胜琴
华南师范大学生命科学学院广东省植物发育生物工程重点实验室,广东广州510631
为了探讨利用发根农杆菌遗传转化所产生的毛状根来创新香石竹种质的可能性,本文采用叶盘法,建立了发根农杆菌Agrobacterium rhizogenes对香石竹Dianthus caryophyllus L.叶片外植体的遗传转化及其植株再生体系。结果表明,发根农杆菌ATCC15834感染香石竹幼嫩叶片外植体12 d后,从叶片外植体切口中脉处产生白色毛状根,21 d后约90%的叶片外植体产生毛状根。所获得的无菌毛状根能在无外源激素的MS固体和液体培养基中快速自主生长。PCR扩增和硅胶薄层层析结果显示发根农杆菌Ri质粒的rol B和rol C基因以及冠瘿碱合成酶基因已在香石竹毛状根基因组中整合并得到表达。将毛状根置于MS+6-BA 1.0−3.0 mg/L +NAA 0.1−0.2 mg/L中培养15 d后产生淡黄绿色的疏松愈伤组织。愈伤组织不定芽分化的最适培养基为MS+6-BA 2.0 mg/L+NAA 0.02 mg/L,培养6周后不定芽分化率为100%;平均每个愈伤组织产生30−40个不定芽;将不定芽转至1/2 MS或1/2 MS+0.5 mg/L NAA的培养基中10 d后产生不定根,发育成再生植株。再生植株移植于栽培基质中20 d后,成活率达95%以上。
香石竹,发根农杆菌,毛状根,植株再生
毛状根(Hairy roots)是发根农杆菌Agrobacterium rhizogenes Ri质粒的含生根基因(rol gene)的T-DNA片段在植物细胞基因组中插入、整合和表达所产生的结果[1]。与根癌农杆菌A.tumefaciens相比,发根农杆菌介导的遗传转化具有许多优点,如毛状根为单细胞起源(即每一条毛状根都是由一个细胞被T-DNA遗传转化表达的结果),具激素自主型生长,不含致瘤基因,不仅容易再生形成转化植株,而且其再生植株不会出现根癌农杆菌遗传转化常出现的嵌合体等[2-3],因而在高等植物基因工程及植物种质创新和性状改良等方面更具应用价值。目前已建立了发根农杆菌对百余种植物的遗传转化,获得了其毛状根及其再生转化植株[3-4],而且这些转化植株常表现出一些形态、生长习性或观赏性状方面的变异,如天竺葵Pelargonium sp.观赏特性的改良和芳香气味的产生[5]、菊苣Cichorium intybus的无需春化即可开花[5]、长寿花Kalanchoe blossfeldiana和紫高杯花Nierembergia scoparia的植株矮化[7-8]、长春花花叶形态改变[9]、碧冬茄的提早开花[10]、比利时菊苣的开花习性改变等[11];彰示出发根农杆菌介导的遗传转化在植物性状改良及新的有益性状培育方面具有的巨大潜力,表明毛状根完全可用作园艺植物种质创新、新品种培育和性状改良的有效工具。
香石竹Dianthus caryophyllus L.又名康乃馨、麝香石竹,是世界上商业性栽培最重要的四大切花之一。但国内市场流行的品种大都为引进的国外品种,且极少有自主培育的新品种[12]。因而,目前国内有关香石竹的研究大都集中在其快速繁殖[13]、切花保鲜[14-15]、试管内开花[16]等方面;而有关其种质创新和性状改良的研究则大都是利用根癌农杆菌介导的遗传转化来提高其抗病性[17]或瓶插寿命[18]等;少见有关利用含生根基因的发根农杆菌对香石竹的遗传转化及其毛状根植株再生以及利用毛状根多态性来进行其种质创新或新品种培育的研究报道。为了探讨利用发根农杆菌遗传转化所产生的毛状根多态性来创新香石竹的种质,培育出具有自主知识产权的新品种,本文报道发根农杆菌对香石竹叶片外植体的遗传转化以及其可自主生长的毛状根组织培养和植株再生的结果,旨在为今后从毛状根再生植株中筛选出花色变异的新品种及开展毛状根的多倍体育种奠定实验和技术基础。
1 材料与方法
1.1 细菌菌株及培养
农杆碱型发根农杆菌ATCC15834由德国马丁·路德大学的Peter Lindemann博士提供。挑取该农杆菌单菌落,接种于添加20 μmol/L乙酰丁香酮的YEB液体培养基中,28℃振荡(160 r/m in)培养30 h后,供感染用。
1.2 外植体制备
实验所用的香石竹Dianthus caryophyllus L.购自广州花博园。取香石竹的幼嫩叶片用0.1%升汞消毒8 min,无菌水漂洗后,切成1.5−2.5 cm2左右的叶片外植体,接种于无外源激素的MS培养基[19]预培养24 h后,用于转化。
1.3 毛状根的诱导和培养
将上述预培养的叶片外植体浸入用MS培养基稀释2倍的发根农杆菌ATCC15834菌悬液中15 min,取出、吸干多余菌液并放回原培养基上共培养2 d后,转入MS+500 mg/L头胞噻肟钠的无外源激素的MS培养基上,在25℃每天14 h散射光下诱导毛状根。切取从外植体产生的毛状根置于含500 mg/L头胞噻肟钠的无外源激素的MS培养基上进行单根除菌培养,直到获得无菌的毛状根。
1.4 毛状根遗传转化鉴定
采用Ri质粒TL-DNA(T-DNA左臂)rol基因的PCR扩增和TR-DNA(T-DNA右臂)的冠瘿碱合成酶基因的表达产物冠瘿碱的硅胶薄层层析来对香石竹毛状根及其再生植株进行遗传转化鉴定。
1.4.1 毛状根rol基因的PCR扩增
取能在无外源激素的培养基上快速自主生长的无菌毛状根500 mg,按Edwards等[20]的方法提取毛状根基因组DNA,纯化后用作PCR扩增的模板。以非转化植株根的基因组总DNA作对照。根据Furner等[21]和Choi等[4]发表的序列,设计用于扩增rol B、rol C和vir C的PCR引物,其序列如表1所示,均由中国科学院上海细胞生物研究所合成。
在0.2 m L的硅化离心管中加入模板DNA 50 ng,Taq DNA聚合酶2 U,PCR反应总体积为50 μL。PCR扩增参数如下:rol B和rol C基因扩增条件相同,其PCR扩增的反应参数为:94℃热变性3 m in;94℃变性1 m in,53.5℃退火1 m in和72℃延伸反应1 m in,进行35个循环;最后72℃延伸10 m in。而vir C基因的扩增条件为:94℃起始热变性5 m in,30个循环,每个循环包括94℃变性45 s,55℃退火45 s和72℃延伸反应2 m in,最后72℃延伸7 m in。扩增产物采用0.8%琼脂糖凝胶电泳和EtBr染色进行分析。
1.4.2 冠瘿碱的硅胶薄层层析
参照Tanaka等[22]的方法进行并略加修改:取香石竹毛状根,或其毛状根再生植株、发根农杆菌菌体各适量,充分研磨成粉状,加入70%乙醇,浸泡过夜,次日离心取上清液浓缩,点样于硅胶薄层层析板(GF254型,10 cm×20 cm,青岛海洋化工厂出品)上,展层、染色和拍照。
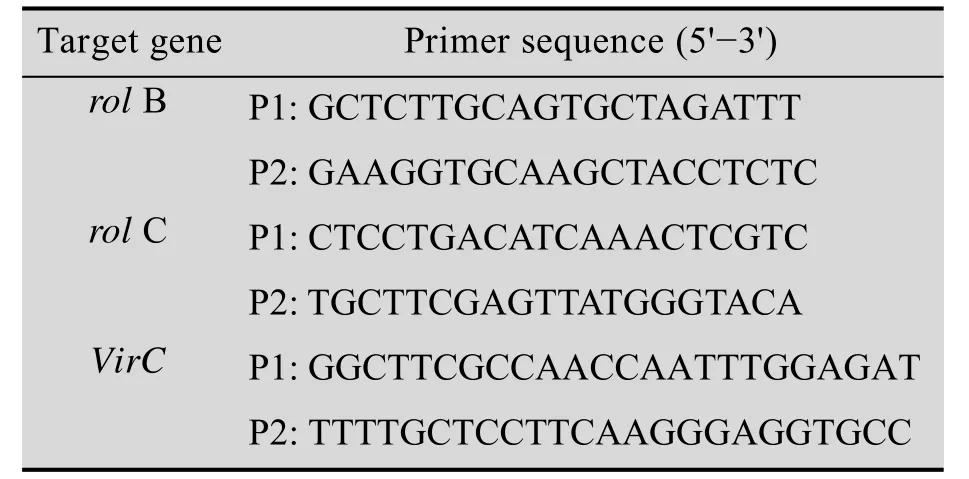
表1 PCR扩增所用的引物及其序列Tab le 1 Prim er sequences used for the PCR am p lification
1.5 毛状根愈伤组织诱导及其植株再生
将上述遗传转化鉴定呈阳性的香石竹毛状根切成2−3 cm的根段,接入MS+6-BA 1.0−3.0 mg/L +NAA 0.1−0.2 mg/L培养基中诱导愈伤组织;30 d后,将愈伤组织转入MS+6-BA 1.0−2.0 mg/L+NAA 0.01−0.02 mg/L进行不定芽分化,待所产生的不定芽长至3−4 cm时,接入1/2 MS无激素培养基或1/2 MS+NAA 0.5 mg/L的固体培养基中诱导生根,长成完整植株。
1.6 再生植株的盆栽及其性状观察
移栽前,去掉封口膜,将生根良好的再生植株置于散射光下炼苗4−5 d后取出,洗去根部的琼脂培养基后,移植在含椰糠:泥炭土(1∶2)营养基质的花盆中,并用保鲜膜覆盖3−4 d后,转入25℃温室中培养,并观察记录再生植株生长发育情况。
2 结果与分析
2.1 香石竹毛状根的诱导和培养
未感染的香石竹叶片外植体在无外源激素的MS+500 mg/L头胞噻肟钠的培养基上连续培养1个月后无一生根,仅可见大部分的叶片外植体边缘部分变黄或变褐;而感染发根农杆菌ATCC15834的香石竹叶片外植体培养12 d后,从其叶片外植体切口中脉处或附近表面产生白色、被短根毛的毛状根(图1A);21 d后约90%的叶片外植体产生毛状根。将所产生的毛状根切下并置于MS+500 mg/L头胞噻肟钠中单根除菌培养,每隔7 d左右转接1次,约5−6次后即可完全除菌。无菌毛状根可在无外源激素的MS固体或液体培养基上快速自主生长,且具较多分枝(图1B和1C)。所获得的可自主快速生长的无菌毛状根置于无外源激素的MS培养基中继代保存,供进行遗传转化鉴定用。
2.2 毛状根rol基因的PCR扩增
rol B和rol C是发根农杆菌Ri质粒TL-DNA(T-DNA左臂)上的2个生根基因。而vir C是Ri质粒中参与T-DNA转化过程但本身并不整合入植物基因组中的毒性基因之一。以rolB、rol C和vir C的引物分别从香石竹对照根、毛状根基因组DNA及发根农杆菌单菌落扩增产物的电泳结果如图2。从图2可见,利用rol B和rol C的PCR引物能从香石竹毛状根的总DNA及发根农杆菌ATCC15834单菌落克隆中分别扩增到期望的540 bp和770 bp左右的特异性DNA片段,而从非转化根的总DNA中扩增不到任何片段(图2);而以vir C引物仅能从发根农杆菌菌落中扩增出约650 bp条带,而不能从香石竹毛状根和非转化根基因组DNA中扩增出任何片段。这说明,发根农杆菌含rol基因的TL-DNA(T-DNA左臂)已在香石竹毛状根基因组中整合并得到表达。
当发根农杆菌Ri质粒的TR-DNA(T-DNA右臂)部分整合到宿主植物细胞DNA中后,在转化细胞中就能合成特异的冠瘿碱(Opines);而发根农杆菌Ri质粒本身虽有冠瘿碱合成酶基因,但该基因只在真核生物中表达,其自身(菌体)不能合成冠瘿碱[2]。如果香石竹毛状根及其再生植株为Ri质粒所转化,那么它们细胞中就会有冠瘿碱的合成,硅胶薄层层析显色结果应成阳性。因而,冠瘿碱的有无也可作为Ri质粒转化的指标之一。图3为香石竹毛状根及其再生植株冠瘿碱的硅胶薄层层析检测结果。从图3可见,上述经rol基因PCR扩增呈阳性的发根农杆菌ATCC15834菌株诱导香石竹叶片外植体产生的毛状根及其再生植株能检测到冠瘿碱(甘露碱),而对照植株及发根农杆菌菌体中则没有检测到冠瘿碱(甘露碱)的存在。这说明,除发根农杆菌Ri质粒的rol基因外,Ri质粒的含编码冠瘿碱合成酶基因的TR-DNA也已在香石竹毛状根及其再生植株基因组中整合并得到表达。

图1 香石竹(康乃馨)毛状根诱导,离体培养及其植株再生Fig.1 Induction and in vitro culture of hairy roots and its plant regeneration of D.caryophyllus.(A)Hairy root formation from cut surface of leaf explants inoculated w ith A.rhizogenes ATCC15834 for 12 d.(B)Solid culture of hairy roots for 14 d.(C)Liquid culture of hairy roots for 40 d.(D)Adventitious shoot formation of hairy roots after cultured for 25 d in liquid phytohormone-free MS medium.(E)Adventitious shoots formation from hairy roots after cultured on solid MS+6-BA 1.0 mg/L.(F)Callus formation from hairy roots cultured on MS+6-BA 3.0 mg/L+NAA 0.1 mg/L.(G)Adventitious shoots formation from callus when cultured on MS+6-BA 2.0+NAA 0.02 for 28 d.(H) Proliferation culture of adventitious shoots cultured in liquid medium MS+6-BA 2.0 mg/L+NAA 0.02 mg/L(I) Pot-grown untransformed plants(left)and hairy roots-regenerated plants(right).
2.3 毛状根愈伤组织诱导及其不定芽分化
将上述遗传转化鉴定呈阳性的香石竹毛状根切成2−3 cm的根段,转入MS+6-BA 1.0−3.0 mg/L+ NAA 0.1−0.2 mg/L的培养基中进行愈伤组织诱导。接种8 d后毛状根根段开始变粗、膨大,并逐渐产生出浅绿色疏松愈伤组织,15 d后所有毛状根根段均形成愈伤组织,并随着培养时间延长,其愈伤组织体积迅速增大(图1F)。将上述毛状根根段形成的浅绿色疏松愈伤组织转入MS+6-BA 1.0−2.0 mg/L+NAA 0.2−0.02 mg/L的培养基中继续培养35 d后,可见从膨大的愈伤组织表面逐渐分化出绿色芽点,并发育成丛生不定芽(图1G)。在供试的各培养基中,香石竹毛状根愈伤组织不定芽分化的最适培养基为MS+6-BA 2.0 mg/L+NAA 0.02 mg/L,培养6周后不定芽分化率为100%;平均每个愈伤组织产生30−40个不定芽。同时发现,将愈伤组织所产生的不定芽置于MS+6-BA 2.0 mg/L+NAA 0.02 mg/L中液体振荡培养时,不仅不定芽能增殖,而且在不定芽增殖同时还能从不定芽基部产生出白色不定根(图1H);另外,虽然在液体培养基产生的不定芽存在轻度的玻璃化现象,但当玻璃化再生苗转至MS固体培养基培养2周后,仍能发育成健壮的植株。此外,在实验中还发现,香石竹毛状根系在无外源激素的液体MS培养基中振荡培养30 d后,也可直接从毛状根起始根段处产生出少量不定芽(图1D)。另外,当毛状根根段在仅加1.0 mg/L 6-BA的MS固体培养基中培养35 d后,也可从少数毛状根的起始根段顶端产生出绿色芽点,并逐渐分化出不定芽;但其幼芽诱导率仅为25%(图1E)。该法与上述先形成愈伤组织再继代培养再生不定芽的方法相比,虽然不定芽诱导率相对较低,分化的不定芽数也较少,平均每个毛状根产生的不定芽数目仅为4−6;但其不需继代,不仅实验操作简单,且获得再生植株的时间也较短。

图2 香石竹毛状根vir C、rol B和rol C基因的PCR扩增产物的凝胶电泳分析Fig.2 Gel electrophoresis analysis of PCR fragments of Vir C,rol B and rol C genes amplified from the genome DNA of D.caryophyllu hairy roots.1:1 kb DNA marker;2−5:fragments w ith vir C primers;6−9: fragments w ith rol B primers;10−13:fragments w ith rol C primers;2,6 and 10:fragments amplified from the colony of A.rhizogenes ATCC15834;3,7 and 11: fragments from untransformed roots;4,5,8,9,12 and 13:fragments amplified from hairy roots.

图3 香石竹毛状根及其再生植株冠瘿碱的硅胶薄层层析检测Fig.3 Detection of opines in hairy roots and its regenerated plants of D.caryophyllus by silica gel thin layer chromatography.1:extract of agrobacterium;2: control root extract;3:transformed plant extract;4: hairy root extract;Man:mannopine.
2.4 不定芽生根诱导及移栽
切取高3−4 cm的健壮不定芽分别转接到不含或含有0.5 mg/L NAA的1/2 MS固体培养基进行生根诱导,约接种10 d后从不定芽基部逐渐分化出白色不定根,且随着培养时间的延长,不定根的数量逐渐增加,不定根不断伸长,发育成完整植株;其中,尤以不定芽在添加0.5 mg/L NAA的培养基中产生的不定根更多而粗。
待再生植株根长到3−5 cm时,打开香石竹无菌苗封口膜,并在恰当光强下炼苗3−4 d后,取出并洗去根部的培养基,移植至盛椰糠:泥炭土(1∶2)的花盆中,并用保鲜膜覆盖和置于散射光下培养,待3−5 d后香石竹植株叶片逐渐恢复正常生长后,去掉保鲜膜,转入25℃温室中光照培养。20 d后统计,再生植株的移栽成活率达95%以上(图1I);并可观察到部分毛状根再生植株叶片较对照略变宽,或节间略缩短,或顶端优势减弱,而更多有关毛状根再生植株的生长形态及观赏性状变化正在观察中。
3 讨论
迄今为止,利用发根农杆菌Ri质粒的T-DNA片段在植物细胞基因组中的整合和表达所产生的生长迅速的毛状根培养物来进行园艺植物种质创新或改良园艺植物的观赏性状,已在紫高杯花Nierembergia scoparia和长寿花Kalanchoe blossfeldiana等多种园艺植物中获得成功[7-8]。国内外也有学者开展了发根农杆菌对石竹科植物康乃馨遗传转化的研究报道;如利用发根农杆菌对其带节茎段的转化,获得了康乃馨D.caryophyllus L.品种“Indios”的毛状根[23];但少见有关发根农杆菌对石竹属植物香石竹其他品种遗传转化的系统研究报道。与已有的研究相比,在本实验中我们用含野生农杆碱型Ri质粒的发根农杆菌ATCC15834对香石竹叶片外植体的遗传转化,不仅获得了可自主生长的毛状根;而且通过组织培养途径,无论是直接再生途径还是间接再生途径都获得了香石竹毛状根的再生植株。此外,在本实验中还观察到,发根农杆菌感染香石竹叶片外植体后可不经愈伤组织阶段直接从其切口部位产生根原基,发育成毛状根,而这与Ri质粒转化胡萝卜Daucus carota L.块根切片和烟草Nicotiana tabacum L.茎切段时,仅由形成的愈伤组织再产生毛状根的方式不同[24]。然而,马铃薯叶片外植体和块茎切块被发根农杆菌感染后则直接产生毛状根,但其茎段外植体则从形成的愈伤组织上长出毛状根[25]。而发根农杆菌转化甘草Glycyrrhiza uralensisi Fisch子叶和下胚轴时,毛状根既可直接从切口处产生,也可从切口处形成的愈伤组织上长出[26]。此外,我们曾用发根农杆菌感染药用植物商陆Phytolacca esculenta van Houtte叶柄外植体时,则不经愈伤组织阶段,直接从其切口部分产生根原基,发育成毛状根,而其叶片外植体则可直接从切口表面或从形成的愈伤组织上形成毛状根[27]。这表明,发根农杆菌侵染植物细胞后,毛状根的形态发生方式可因植物种类和感染部位等不同而有所差异。
能否从毛状根产生出再生植株,是利用发根农杆菌遗传转化产生的毛状根多态性来进行园艺植物种质创新和品种改良的前提和关键。已有的研究表明,发根农杆菌遗传转化产生的毛状根可通过直接分化出芽获得再生植株;也可以先形成愈伤组织,再从愈伤组织分化出芽获得再生植株[3,28]。如玉米毛状根可在培养基上先形成愈伤组织,然后再逐渐分化出芽获得再生植株[3]。而且,同一植物的毛状根也可以通过两种或两种以上的方式获得再生植株。如张继栋等发现木本曼陀罗Datura arborea L.毛状根在适宜培养基上可直接诱导不定芽;也可以先在适宜培养基上诱导出愈伤组织,然后再诱导出不定芽[28]。而这与本实验结果有些相似。在本实验中,香石竹毛状根也可先在愈伤组织诱导培养基上形成愈伤组织,然后再通过将愈伤组织转入添加不同浓度6-BA和NAA组合的不定芽分化培养基中诱导出不定芽而获得再生植株;同时也发现,香石竹毛状根也可仅在无激素液体MS培养基中无需继代,培养30 d后直接再生出不定芽;或在仅加1 mg/L 6-BA的固体培养基中培养35 d后,直接从毛状根起始根段处产生少量不定芽。虽然后者的不定芽诱导率较低,仅为25%;但因不需继代,操作更简单,且获得再生植株的时间也较短。已有的研究表明,在发根农杆菌介导的遗传转化中,由于T−DNA插入植物基因组的位置、长度和拷贝数千差万别[29],植物感染部位就会产生在形态、生长习性或观赏性状和次生代谢产物含量等方面各异的毛状根克隆[5,9-11],这些单细胞起源的变异克隆为新的优良性状的发现和筛选提供了方便和可能。而本文所建立的发根农杆菌对花卉植物香石竹叶片外植体的遗传转化体系以及其可自主生长的毛状根的植株再生体系,为今后利用从多态性毛状根再生植株中筛选到观赏性状改变或改良的新种质或利用其毛状根多倍体化来获得其多倍体新种质奠定了实验技术基础,并提供了可能性。
REFERENCES
[1]Tepfer M,Casse-Delbart F.Agrobacterium rhizogenes as a vector for transform ing higher plants.M icrobiol Sci,1987,4(1):24–28.
[2]Li JL,Xu XL,Chen JS.Agrobacterium rhizogenes Ri plasm id and its application.Prog Biotechnol, 1993,14(2):8–14(in Chinese).李集临,徐香玲,陈金山.发根农杆菌Ri质粒及其应用.生物工程进展,1993,14(2):8–14.
[3]Xu HW,Zhou XF,Lu JM,et al.Hairy roots induced by Agrobacterium rhizogenes and production of regenerative plants in hairy root cultures in maize.Sci China C:Life Sci,2005, 35(6):497–501(in Chinese).徐洪伟,周晓馥,陆静梅,等.发根农杆菌诱导玉米毛状根发生及再生植株.中国科学C辑, 2005,35(6):497–501.
[4]Giri A,Narasu M L.Transgenic hairy roots:recent trends and applications.Biotechnol Adv,2000,18 (1):1–22.
[5]Pellegrineschi A,Damon JP,Valtorta N,et al. Improvement of ornamental characters and fragrance production in lemon-scented geranium through genetic transformation by Agrobacterium rhizogenes.Biotechnology,1994,12(1):64–68.
[6]Kamada H,Ono A,Saitou T,et al.No requirement of vernalization for flower formation in Ri-transformed Cichorium plants.Plant Tiss Cult Lett,1992,9(3):206–213.
[7]Christensen B,Sriskandarajah S,Serek M,et al. Transformation of Kalanchoe blossfeldiana w ith rol genes is useful in molecular breeding towards compact grow th.Plant Cell Rep,2008,27(9): 1485–1495.
[8]Godo T,Tsujii O,Ishikawa K,et al.Fertile transgenic plants of Nierembergia scoparia sendmer obtained by a m ikimopine type strain of Agrobacterium rhizogenes.Sci Horticult,1997, 68(1):101–111.
[9]Choi PS,Kim YD,Choi KM,et al.Plant regeneration from hairy root cultures transformed by infection w ith Agrobacterium rhizogenes in Catharanthus roseus.Plant Cell Rep,2004,22 (11):828–831.
[10]W inefield C,Lew is D,Arathoon S,et al. A lteration of Petunia plant form though the introduction of the rol C gene from Agrobacterium rhizogenes.Mol Breed,1999,5(6):543–551.
[11]Limari MA,Sun LY,Douat C,et al.Natural genetic transformation by Agrobacterium rhizogenes:annual flowering in biennials,belgian endive and carrot.Plant Physiol,1998,118(2): 543–550.
[12]Xiong L.Carnation.Beijing:China Agricultural Publishing House,1999:133–135(in Chinese).熊丽.香石竹.北京:中国农业出版社,1999: 133–135.
[13]Huang DH,Zhou Q,Tao XH,et al.Tissue culture and rapid propagation of the short carnation.Chin Agri Sci Bull,2007,23(9):103–106(in Chinese).黄冬华,周群,陶秀花,等.矮生香石竹的组织培养和快速繁殖.中国农学通报,2007,23(9): 103–106.
[14]Zhao Y,Li XF.Study of 6-BA on preservation effect of cut carnation.Acta Agric Bor-occid Sin, 2008,17(2):254–257(in Chinese).赵滢,李新凤.6-BA对香石竹切花保鲜效果的研究.西北农业学报,2008,17(2):254–257.
[15]Liu JP,He SG,Lü PT,et al.Effect of sodium dichloroisocyanurate on preservation of cut carnation(Dianthus caryphyllus L.).Acta Horticul Sin,2009,36(1):121–126(in Chinese).刘季平,何生根,吕培涛,等.二氯异氰脲酸钠处理对香石竹切花的保鲜效应.园艺学报,2009, 36(1):121–126.
[16]Tang DT,Xu MX,Feng YH.In vitro floweringfrom explants in Dianthus chinensis L.and factors influenced flower formation.Acta Horticul Sin, 1996,23(3):277–280(in Chinese).唐定台,徐民新,冯永红.石竹试管花的诱导及其影响因子的研究.园艺学报,1996,23(3): 277–280.
[17]Wu Y,Dong J,Guo BL,et al.Estimating coldresistance of transgenic Dianthus chinese w ith CBF1 gene.Chin Agri Sci Bull,2007,23(5): 59–61(in Chinese).吴琰,董静,郭宝林,等.转CBF1基因地被石竹的抗寒性评价.中国农学通报,2007,23(5): 59–61.
[18]Yu YX,Bao MZ.Integration of different T-DNA structures of ACC oxidase gene into carnation genome extended cut flower vase-life differently. Chin J Biotech,2004,20(5):704–707(in Chinese).余义勋,包满珠.不同结构的外源ACC基因导入香石竹对瓶插寿命的影响.生物工程学报, 2004,20(5):704–707.
[19]Murashige T,Skoog F.A revised medium for rapid grow th and bioassays w ith tobacco tissue culture.Physiol Plant,1962,15(3):473–497.
[20]Edwards K,Johnstone C,Thompson C.A simple and rapid method for the preparation of plant genom ic DNA for PCR analysis.Nucleic Acids Res,1991,19(6):1349.
[21]Furner I,Huffman G,Amasino R,et al.An Agrobacterium transformation in the evolution of the genus Nicotiana.Nature,1986,319:422−427. [22]Tanaka N,Hayakawa M,Mano Y,et al.Infection of turnip and radish storage roots w ith Agrobacterium rhizogene s.Plant Cell Rep,1985, 4(2):74−77.
[23]Fan HQ,Yao QH,Peng RH,et al.A prelim inary study on carnation by Ri plasm id of Agrobacterium rhizogenes.Acta Agric Shanghai, 2001,17(1):35–38(in Chinese).范惠琴,姚泉洪,彭日荷,等.发根农杆菌Ri质粒转化康乃馨初步研究.上海农业学报,2001, 17(1):35–38.
[24]Bercetche J,Chriqui D,Adam S,et al. Morphogenetic and cellular reorientation induced by Agrobacterium rhizogenes(strains 1855,2659 and 8196)on carrot,pea and tobacco.Plant Sci, 1987,52(3):195–210.
[25]Ottaviani MP,Schel JHN,Hänisch Ten Cate Ch H. Variation in structure and plant regeneration of Agrobacterium rhizogenes transformed and control roots of the potato cv.Bintje.Plant Cell Tiss Org Cult,1990,20(1):25–34.
[26]Chen SY,Hou SS,Gui YL,et al.In vitro transformation of cotyledons and hypocotyls of Glycyrrhiza uralensis Fisch by Agrobacterium rhizogenes.J Wuhan Bot Res,1991,9(4): 301–304(in Chinese).陈士云,侯嵩生,桂耀林,等.发根土壤杆菌体外转化甘草子叶及下胚轴.武汉植物学研究, 1991,9(4):301–304.
[27]Shi HP,Liang P,Quan H.Induction and culture of hairy roots in Phytolacca esculenta and its saponin production.Chin J Biotech,2003,19(1): 46–49(in Chinese).施和平,梁朋,权宏.商陆毛状根的诱导、培养及其皂甙的产生.生物工程学报,2003,19(1): 46–49.
[28]Zhang JD,Yang XQ,Qiao AM,et al.Plant regeneration from hairy roots of Datura arborea L. J Tropic Subtropic Bot,2008,16(5):480–485(in Chinese).张继栋,杨雪清,乔爱民,等.木本曼陀罗毛状根植株再生体系的建立.热带亚热带植物学报, 2008,16(5):480–485.
[29]David C,Petit A,TempéJ.T-DNA length variability in mannopine hairy root:more than 50 kilo base pairs of pRi T-DNA can integrate in plant cells.Plant Cell Rep,1988,7(2):92–95.
(本文责编 陈宏宇)
Induction and in vitro culture of hairy roots of Dianthus caryophyllus and its p lant regeneration
Heping Shi,Yuanfeng Zhu,Bei Wang,Jiangbing Sun,and Shengqin Huang
Guangdong Provincial Key Laboratory of Biotechnology for Plant Development,College of Life Science,South China Normal University,Guangzhou 510631,Guangdong,China
To use Agrobacterium rhizogenes-induced hairy roots to create new germplasm of Dianthus caryophyllus,wetransformed D.caryophyllus w ith A.rhizogenes by leaf disc for plant regeneration from hairy roots.The white hairy roots could be induced from the basal surface of leaf explants of D.caryophyllus 12 days after inoculation w ith A.rhizogenes ATCC15834.The percentage of the rooting leaf explants was about 90%21 days after inoculation.The hairy roots could grow rapidly and autonomously in liquid or solid phytohormone-free MS medium.The transformation was confirmed by PCR amplification of rol gene of Ri plasm id and silica gel thin-layer chromatography of opines from D.caryophyllus hairy roots.Hairy roots could form light green callus after cultured on MS+6-BA 1.0−3.0 mg/L+NAA 0.1−0.2 mg/L for 15 days. The optimum medium for adventitious shoots formation was MS+6-BA 2.0 mg/L+NAA 0.02 mg/L,where the rate of adventitious shoot induction was 100%after cultured for 6 weeks.The mean number of adventitious shoot per callus was 30−40.The adventitious shoots can form roots when cultured on phytohormone-free 1/2 MS or 1/2 MS+0.5 mg/L NAA for 10 days.When the rooted plantlets transplanted in the substrate m ixed w ith perlite sand and peat(volume ratio of 1:2),the survival rate was above 95%.
Dianthus caryophyllus,Agrobacterium rhizogenes,hairy roots,plant regeneration
January 25,2014;Accep ted:June 9,2014
Heping Shi.Tel:+86-20-85214793;E-mail:shihp@scnu.edu.cn
施和平,朱远锋,王蓓,等.香石竹毛状根诱导、离体培养及其植株再生.生物工程学报,2014,30(11):1742–1750.
Shi HP,Zhu YF,Wang B,et al.Induction and in vitro culture of hairy roots of Dianthus caryophyllus and its plant regeneration.Chin J Biotech,2014,30(11):1742–1750.
Suppo rted by:Comm ittee of Science and Technology in Guangdong Province,China(No.2011B020304006).
广东省科技计划项目(No.2011B020304006)资助。
