小鼠T-bet启动子荧光素酶报告基因载体的构建及活性鉴定
2014-06-24徐惠娟周守标
徐惠娟,周守标
安徽师范大学生命科学学院安徽省重要生物资源保护与利用研究省级重点实验室,安徽芜湖241000
小鼠T-bet启动子荧光素酶报告基因载体的构建及活性鉴定
徐惠娟,周守标
安徽师范大学生命科学学院安徽省重要生物资源保护与利用研究省级重点实验室,安徽芜湖241000
为了研究T-bet在T细胞中的转录调控机制,并研究其在多发性硬化症中的信号通路,本研究构建小鼠TBX21(编码T-bet)基因启动子区和增强子区萤火虫荧光素酶报告基因载体。在对小鼠TBX21基因5ʹ侧翼区进行详尽生物信息学特征分析后,设计相应引物,用PCR的方法从小鼠基因组中扩增出TBX21基因5ʹ侧翼区–1 000 bp−28 bp片段长为1 028 bp的启动子区(以翻译起始点ATG为+1)和–3 308 bp−–2 000 bp片段长为1 308 bp的非编码区保守序列(No-coding conserved sequence,CNS),再用定向克隆的方法将这两个片段定向重组入专门用于启动子活性研究的萤火虫荧光素酶报告基因载体(pGL4.10)中,构建出包含小鼠TBX21基因启动子区和CNS区的萤火虫荧光素酶报告基因载体(pGL4.10-TBX 21pr-CNS),电泳与测序鉴定,最后再将pGL4.10-TBX21pr-CNS与内参pRL-TK用lipofectam ine 2000共转染293T细胞和Jurkat细胞中,通过双荧光素酶报告基因检测系统鉴定pGL4.10-TBX 21pr-CNS的启动子和增强子活性,并用独立样本t检验方法进行统计分析。对照组共转染pGL4.10与内参pRL-TK。结果表明,成功构建出荧光素酶报告基因重组质粒pGL4.10-TBX21pr-CNS。与转染空质粒pRL-TK组相比,293T细胞(P=0.012 2)和Jurkat细胞(P=0.002 2)中转染pGL4.10-TBX 21pr-CNS组荧光素酶活性升高。研究结果表明在293T细胞和Jurkat细胞中pGL4.10-TBX21pr-CNS可以表现出启动子活性,为后续小鼠T-bet转录调控研究提供了基本材料。
T-bet,启动子,荧光素酶,报告基因,转录调控
适应性免疫应答(Adaptive immunity)反应中的T淋巴细胞按其功能主要分为3个群:辅助性T细胞、细胞毒性T细胞和调节性T细胞。辅助性T细胞至少包括Th1、Th2、Th17和滤泡辅助T细胞(Tfh),这4个独立细胞亚群都表达各自的主要转录因子和细胞因子。表达特异性转录因子T-bet的Th1细胞,主要通过分泌IFN-γ,在抗胞内病原体(病毒、细菌)的感染中发挥重要作用[1-2];Th2细胞主要产生IL-4、IL-5、IL-10、IL13,在清除寄生虫等和过敏反应中意义重大,它的转录因子为GATA-3[3-4];Th17细胞的主要调控子为RORγt,产生IL-17A、IL-17F和IL-21,在防御某些肠道病原菌的感染方面发挥积极作用[5]。
Szabo等首先于2000年报道了辅助T细胞亚型Th1细胞中重要的转录因子T-bet(T-box expressed in T cells)[6]。它是T-box基因家族的新型转录因子,因刚发现时被认为只表达于T细胞内而得名。T-bet为T-box基因家族Tbrl亚家族成员[7],含530个氨基酸,其中有一个189个氨基酸组成的能与T盒DNA结合的结构域。人与小鼠的TBX21基因(编码T-bet)具有88%的同源性。T-bet在naive T细胞向Th1方向分化时具有重要的作用。T-bet作为Th1细胞的谱系限定转录因子,对于Th1细胞的分化及稳定起了非常重要的作用。同时T-bet又能通过抑制其他细胞亚型的细胞因子的表达从而抑制其分化。Th1细胞又称为炎症性T细胞,介导与细胞内病毒和局部炎症有关的免疫应答,参与细胞免疫及迟发型超敏性炎症的形成,目前报道与多种自身免疫疾病相关[8],尤其与人类的自身免疫病多发性硬化症有关。
多发性硬化症(Multiple sclerosis,MS)是一种由T细胞介导的自身免疫疾病,它也是一种累及中枢神经系统白质的自身免疫疾病[9]。它的自身反映性T细胞所识别的靶抗原是神经髓鞘碱性蛋白(Myelin basic protein,MBP)等。随着病情的发展,最终可导致全身瘫痪和中枢神经系统功能丧失。其具体的发病机制依然不十分清楚,一般认为异常激活的抗原特异性CD4+T淋巴细胞穿过血脑屏障进入中枢神经系统,并针对特异性髓鞘蛋白,如髓鞘少突胶质细胞糖蛋白(M yelin oligodendrocyte glycoprotein,MOG35-55,)、髓鞘磷脂碱性蛋白(M yelin basic protein,MBP)、髓鞘蛋白脂蛋白(M yelin proteolipid protein,PLP)等产生免疫反应,引起炎性细胞浸润和中枢神经系统白质脱髓鞘,导致了多发性硬化症的发病。实验性脑脊髓炎(Experimental autoimmune encephalomyelitis,EAE)在临床症状和发病机理上和多发性硬化症很相似[10],因此被认为是MS理想的动物模型[11]。在此前发现Th1细胞是介导多发性硬化症发病的主要细胞亚型之一,但是当IFN-γ敲除之后EAE发病并没有很好地缓解反而加重[12]。而T-bet敲除就不能诱导EAE发病了[13],这表明T-bet作为Th1介导EAE的关键的细胞因子[14],然而其作用机制还不清楚。
启动子是真核基因转录起始位点上游一段长度不等的特异性序列,能顺式调控基因的转录。增强子是指能使与它连锁的基因转录频率明显增强的DNA序列。目前发现的保守的非编码区序列(No-coding conserved sequence,CNS)类似于一般远端的增强子。我们用VISTA tools比对软件对小鼠和人TBX 21基因上游5 kb序列进行比对,得到一个保守性且转录因子结合位点较多的CNS。为了研究Th1在介导的多发性硬化症中的信号通路的作用,我们构建了含小鼠T-bet启动子和CNS的荧光素酶报告基因,通过对细胞内荧光素酶活性的检测鉴定了所构建的报告基因载体的有效性。为下一步研究Th1/Th17细胞介导的自身免疫病多发性硬化症的发病机制提供了材料。
1 材料与方法
1.1 材料
1.1.1 菌株、细胞株和质粒
大肠杆菌E.coli DH5α、人肾上皮细胞系293T细、T淋巴细胞系Jurkat、细菌人工染色体RP23-451G13由本课题组保存;pGL4.10、pRL-TK购置于Promega公司。
1.1.2 主要试剂
DMEM培养基、胎牛血清购置于Gibgo公司;PCR反应试剂盒、限制性内切酶、DNA连接酶购置于大连宝生物有限公司;DNA marker购置于天根生化科技(北京)有限公司和Fermentas公司;质粒小量提取试剂盒、琼脂糖凝胶回收试剂盒、PCR产物回收试剂盒购置于博迈德生物有限公司;转染试剂lipofectamine 2000购置于Life technology公司;双荧光素酶报告基因活性检测试剂盒购置于Promega公司。
1.2 方法
1.2.1 T-bet基因启动子生物信息学分析
根据UCSC中小鼠和人全基因组序列,选取小鼠和人T-bet基因TBX21转录起始位点上游5 kb,在线用VISTA tools进行序列分析比对,得到小鼠TBX21基因上游起始位点5 kb内非编码区保守序列(No-coding conserved sequence,CNS)。
1.2.2 引物设计和合成
根据PCR引物设计原则和GenBank中小鼠TBX 21基因序列,应用Prime Primer 5.0软件设计引物:TBX 21启动子上游引物加入KpnⅠ酶切位点(GGTACC),下游引物加入XhoⅠ酶切位点(CTCGAG),并分别在上游和下游引物的5ʹ端加上保护碱基;TBX21 CNS上游引物加入SfiⅠ酶切位点(GGCCTAACTGGCC);下游引物加入KpnⅠ酶切位点(GGTACC)。引物由南京金斯瑞有限公司合成,启动子扩增片段长度为1 028 bp,CNS扩增片段长度为1 308 bp。
1.2.3 小鼠T-bet基因启动子区和CNS区序列扩增
以细菌人工染色体(BAC,RP23-451G 13)为模板,用TBX 21 pr U/D和TBX21 CNS U/D两对引物,分别扩增TBX21启动子和CNS DNA序列。扩增体系为:Taq DNA聚合酶0.125 μL、10×缓冲液2.5 μL、dNTP m ix 2 μL、模板DNA 2 μL、引物一1 μL、引物二1 μL、灭菌双蒸水16.375 μL。反应参数设置如下:94℃预变性5 m in,94℃变性30 s,55℃复性30 s,72℃延伸1 min 30 s,扩增35个循环,72℃最后延伸5 min。取5 μL PCR产物行于琼脂糖凝胶中,在100 V电压下电泳,256 nm紫外灯下观察结果。
1.2.4 小鼠T-bet启动子荧光素酶报告基因载体的构建与鉴定
从琼脂糖凝胶中切出需回收的产物电泳条带,用胶回收试剂盒对PCR反应产物TBX21pr进行纯化,纯化后再次进行琼脂糖凝胶电泳确认。确认后将PCR纯化产物TBX 21pr和pGL4.10载体用KpnⅠ、XhoⅠ双酶切。将酶切纯化产物TBX21pr与pGL4.10载体连接。连接体系为pGL4.10载体1 μL、SolutionⅠ5 μL、酶切纯化产物TBX 21pr 3 μL、灭菌双蒸水1 μL。体系置于金属浴中16℃连接2 h。连接的PCR产物转化感受态细菌DH5α后,接种于含Amp+LB培养皿培养筛选。挑取8个单菌落,接种5 m L Amp+LB培养基过夜培养,然后小提质粒,用KpnⅠ、XhoⅠ双酶切,4 h后进行琼脂糖凝胶电泳,以鉴定目的片段是否转入。将经过鉴定的阳性克隆菌落摇菌,提质粒,送测序。重组载体命名为pGL4.10-TBX21-pr。再将PCR纯化产物TBX 21 CNS3/4/5/6与pGL4.10-TBX 21-pr用SfiⅠ、KpnⅠ双酶切。将酶切纯化产物TBX21 CNS与pGL4.10-TBX 21-pr连接。连接体系为pGL4.10-TBX 21-pr 1 μL、SolutionⅠ5 μL、酶切纯化产物TBX21 CNS 3 μL、灭菌双蒸水1 μL。体系置于金属浴中16℃连接2 h。连接的PCR产物转化感受态细菌DH5α后,接种于含Amp+LB培养皿培养筛选。挑取8个单菌落,接种5 m L Amp+LB培养基过夜培养,然后小提质粒,用KpnⅠ、SfiⅠ双酶切,4 h后进行琼脂糖凝胶电泳,以鉴定目的片段是否转入。将经过鉴定的阳性克隆菌落摇菌,提质粒,送测序。测序由北京华大基因研究中心有限公司完成。重组载体命名为pGL4.10-TBX21-pr-CNS。
1.2.5 细胞培养及转染
人肾上皮细胞系293T细胞在含10%胎牛血清、100 μg/m L青霉素、100 μg/m L链霉素的高糖型DMEM培养基中培养,培养条件为37℃、5%CO2,相对湿度95%。细胞用0.1%胰蛋白酶-EDTA进行消化传代。细胞转染利用转染试剂lipofectam ine 2000按照life technology公司提供的实验方法进行转染。
T细胞Jurkat培养于含10%胎牛血清、100μg/mL青霉素、100 μg/m L链霉素的RPM I1640培养基中培养,培养条件为37℃、5%CO2,相对湿度95%,3−4 d传代一次。细胞转染使用0.4 cm电转杯在电转仪340 V的条件下电转。转染所用的质粒均由本实验室提供。
1.2.6 荧光素酶活性检测
用Promega公司的Dual-Luciferase Reporter Assay System(E1960)进行样品萤光素酶活性检测,方法如下:转染前一天接种2.5×105个细胞于24孔板上。细胞转染48 h后加入PBS清洗细胞,再加入100 μL的PLB(Passive lysis buffer),室温轻微振摇15 m in,收集细胞裂解液。收集细胞裂解液,使用手动的双萤光检测仪(Promega,GloM ax生物发光检测仪)读值:将20 μL每样品加入100 μL LARⅡ工作液,快速混匀,读值2 s。读值完毕后,每样品再加入100 μL Stop&GloRReagent,快速混匀后,放入发光检测仪中,读值2 s;保存数据。
1.2.7 统计学处理
采用GraphPad Prism 5软件处理分析,组间差异用t检验,P<0.05为差异有统计学意义。
2 结果与分析
2.1 小鼠T-bet基因转录起始位点上游5 kb序列生物信息学分析
在UCSC数据库中获得小鼠和人TBX21基因转录起始位点上游5 kb基因序列,在线用VISTA tools(http://genome.lbl.gov/vista/index.shtm l)进行序列分析比对,得到小鼠TBX21基因上游起始位点5 kb内非编码区保守序列(No-coding conserved sequence,CNS)(图1)其中4段非编码区保守序列的保守性很强。
2.2 小鼠T-bet启动子区及CNS扩增结果
以细菌人工染色体(RP23-451G13)DNA为模板,克隆出2段序列,分别为TBX21启动子序列1 028 bp(–1 000/+28)、TBX 21 CNS3/4/ 5/6 1 308 bp(–3 308/–2 000)(图2)。
2.3 pGL4.10-TBX 21p r及pGL4.10-TBX21p r -CNS质粒鉴定结果
T B X 2 1启动子的P C R产物插入pGL 4.10-Basic载体后,构建成重组载体pGL4.10-TBX 21-pr,用KpnⅠ/XhoⅠ双酶切鉴定;TNX 21 CNS3/4/5/6的PCR产物插入重组质粒pGL 4.10-TBX 21-p r后,构建成重组质粒pGL4.10-TBX21-pr-CNS,用SfiⅠ/KpnⅠ双酶切鉴定。图3显示了pGL4.10-TBX 21-pr在相应位置切出来载体条带与目的DNA片段,释放出1 028 bp大小的片段。pGL4.10-TBX 21-pr-CNS因为在KpnⅠ酶切位点前后均有一个SfiⅠ酶切位点,因此酶切之后释放出1 035 bp和1 308 bp两个不同大小的片段(图4)。测序结果证实包含小鼠TBX21启动子和CNS3/4/5/6序列,序列与GenBank里小鼠启动子序列完全匹配,表明包含TBX21启动子报告基因载体构建成功。

图1 小鼠和人TBX 21基因序列在线VISTA软件比对结果图Fig.1 VISTA plot of CNS sites(Pink)in human and mouse TBX21 DNA,presented relative to their positions in the mouse genome(horizontal axis).CNS3-6 is located–3kb,from the transcriptional start site of mouse TBX21.

图2 TBX 21-p r和TBX 21-CNS3/4/5/6的PCR产物Fig.2 PCR results of TBX21-pr and TBX21-CNS3/4/5/6. 1:PCR product of TBX 21-pr;2:PCR product of TBX21-CNS3/4/5/6;M:TIANGEN DNA marker IV (MD104).

图3 重组质粒pGL 4.10-TBX21-p r的KpnⅠ/XhoⅠ酶切鉴定图谱Fig.3 Identification of recombinant plasm id pGL4.10 -TBX21-pr digested by KpnⅠand XhoⅠ.
2.4 pGL4.10-TBX 21-p r和pGL4.10-TBX 21-pr-CNS荧光素酶活性检测结果
pGL4.10-TBX21-pr-CNS和pRL-TK共转染表皮细胞系293T后,测定萤火虫荧光素酶活性和海肾荧光素酶活性,并将两者的比值,作为衡量TBX21启动子活性的依据。结果显示,与pGL4.10相比,重组载体pGL4.10-TBX21 -pr-CNS转染293T(P=0.012 2)和Jurkat (P=0.002 2)细胞后,荧光素酶报告基因的表达显著增强,两者相比,具有显著的统计学意义。说明构建的小鼠TBX21启动子荧光素酶报告基因pGL4.10-TBX21-pr-CNS具有启动子活性(图5)。
目前已知T-bet对于Th1分化及相关细胞因子的表达起着至关重要的作用,是Th1细胞的主要转录因子,也是免疫系统一个重要的转录因子。目前发现T-bet表达存在正负调控的网络,其正调控主要通过以下途径:1)IFN-γ与受体结合后,诱导T-bet的表达,而T-bet又可促进CD4+T细胞产生IL-12Rβ2和IFN-γ[15];2)IL-12与受体结合后,先诱导IFN-γ,然后经IFN-γ再诱导T-bet的转录;3)与IL-12同源的IL-23和IL-27,分别与相应受体结合后,也诱导T-bet的表达,而负调控主要是GATA3对T-bet的直接抑制作用[16]。T-bet与STAT1、STAT4、IFN-γ在Th1细胞中是一种环状反馈表达关系。但这些细胞因子是如何调控T-bet的表达目前尚不清楚。基因的表达调控可在转录、翻译、翻译后等多个水平上,但转录调控水平最为重要。基因启动子的研究是转录调控的一个重要内容,其中启动子的克隆又是基因启动子功能研究的基础。
随着生物信息学技术的不断发展,各种生物信息学软件对启动子预测的准确率逐步提高。在预测出结果之后,再设计相应的引物用PCR方法,就可较为容易地克隆出目的片段。这可以大大减少实验的盲目性,提高实验效率,已被越来越多的研究者所采用。本研究前期已经对小鼠T-bet基因的5ʹ非转录区调控序列进行了较为充分的分析,依据分析结果设计相应的引物,成功扩增出了一段长约1 028 bp和一段长约1 308 bp的片段,经过测序后证实所克隆片段GenBank中小鼠T-bet基因的5ʹ非翻译区序列一致。
报告基因载体的构建是研究启动子功能的一种常用手段,检测报告基因的表达量,可以直接反映所克隆片段的启动子活性[17]。报告基因常用于测定启动子对基因表达的影响及其与反式作用因子的相互作用,即将所研究的目的基因调控序列克隆到含有报告基因的表达质粒中,然后将重组质粒导入适当的细胞系,通过测定报告基因表达的水平,间接评价在调控序列指导下对基因表达的诱导作用。pGL4.10载体多克隆位点下游含有荧光素酶基因,该基因编码萤火虫荧光素酶,在ATP、氧气、和Mg2+存在条件下氧化D-荧光素,产生的荧光产物可以进行定量测定。将调控序列插入多克隆区域,驱动萤火虫荧光素酶基因转录表达,通过测定荧光产物的量即可反映该调控序列的转录活性。pRL-TK包含一个编码海肾荧光素酶的cDNA,海肾荧光素酶的表达为萤火虫荧光素酶报告基因正态化提供内对照值,以降低培养细胞数目和健康状况的差别以及细胞转染和裂解效率的差别。

图4 重组质粒pGL4.10-TBX 21-p r-CNS的SfiⅠ/KpnⅠ酶切鉴定图谱Fig.4 Identification of recombinant plasm id pGL4.10 -TBX21-pr-CNS digested by SfiⅠand KpnⅠ.
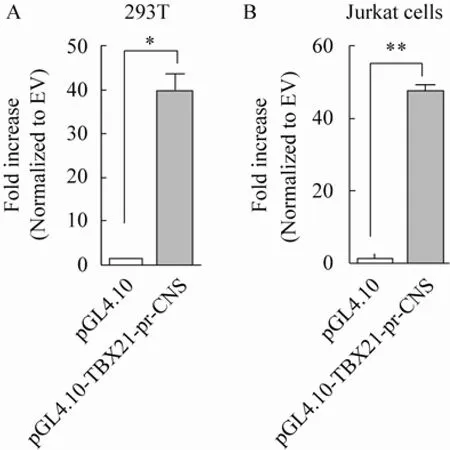
图5 T-bet启动子及非编码保守序列在293T(A)和Jurkat细胞(B)中的转录活性Fig.5 Transcription activity of T-bet gene promoter and CNS in 293T cells(A)and Jurkat cells(B).
本文采用的是双荧光素酶报告基因检测系统(Dual-luciferase reporter assay system)检测TBX21-luc的活性。双荧光报告系统的原理是:利用萤火虫荧光素酶和海肾荧光素酶的酶结构及底物要求不同而选择性地区别这两种发光报告基因的活性。萤火虫荧光素酶是一个61 kDa单亚基蛋白,海肾荧光素酶是一个36 kDa大小的单亚基蛋白。利用两者底物要求的不同,先加入萤火虫荧光素酶的底物检测其活性(实验报告基因),然后加入终止液,同时加入海肾荧光素酶的底物检测海肾荧光素酶活性(对照报告基因),最后计算两者的比值,从而排除转染效率和加样量的差异,真实可靠地反映TBX 21-luc的转录活性。
一个基因的转录需要一定大小片段的启动子序列和一系列的增强子序列。非编码区保守序列(No-coding conserved sequence,CNS)是最新发现的类似于增强子的序列。一些转录因子可以结合到CNS区调控基因的转录。很多文章有报道通过构建含基因启动子和CNS的荧光素酶报告基因[18-19],验证了免疫系统中各辅助T细胞的分化和增殖的机制[20]。
本实验成功构建了小鼠T-bet启动子和保守非编码区荧光素酶报告基因,并在细胞内鉴定了其具有启动和增强荧光素酶基因表达的活性,为进一步研究T-bet表达调控机制及EAE中的信号转导机制等提供基本材料。
REFERENCES
[1]Koch MA,Perdue NR,Killebrew JR,et al.The transcription factor T-bet controls regulatory T cell homeostasis and function during type 1 inflammation.Nat Immunol,2009,10(6):595–602.
[2]Zheng Y,Chaudhry A,Kas A,et al.Regulatory T-cell suppressor program co-opts transcription factor IRF4 to control TH2 responses.Nature, 2009,458(7236):351–356.
[3]Chaudhry A,Rudra D,Treuting P,et al.CD4+ regulatory T cells control TH17 responses in a Stat3-dependent manner.Science,2009, 326(5955):986–991.
[4]Chung Y,Tanaka S,Chu F,et al.Follicular regulatory T cells expressing Foxp3 and Bcl-6 suppress germ inal center reactions.Nat M ed,2011, 17(8):983–988.
[5]Linterman MA,Pierson W,Lee SK et al.Foxp3+ follicular regulatory T cells control the germ inal center response.Nat Med,2011,17(8):975–982.
[6]Szabo SJ,Kim ST,Costa GL et al.A novel transcription factor,T-bet,directs Th1 lineage comm itment.Cell,2000,100(6):655–669.
[7]Zhang WX,Yang SY.Cloning and characterization of a new member of the T-box gene fam ily.Genom ics,2000,70(1):41–48.
[8]Lazarevic V,Glim cher LH.T-bet in disease.Nat Immunol,2011,12(7):597–606.
[9]Hemmer B,Nessler S,Zhou D et al. Immunopathogenesis and immunotherapy of multiple sclerosis.Nat Clin Pract Neurol,2006, 2(4):201–211.
[10]Stromnes IM,Goverman JM.Active induction of experimental allergic encephalomyelitis.Nat Protoc,2006,1(4):1810–1819.
[11]Stromnes IM,Goverman JM.Passive induction of experimental allergic encephalomyelitis.Nat Protoc,2006,1(4):1952–1960.
[12]Lee E,Chanamara S,Pleasure D,et al. IFN-gamma signaling in the central nervous system controls the course of experimental autoimmune encephalomyelitis independently of the localization and composition of inflammatory foci.J Neuroinflammation,2012,9:7.
[13]Bettelli E,Sullivan B,Szabo SJ,et al.Loss of T-bet,but not STAT1,prevents the development of experimental autoimmune encephalomyelitis.J Exp Med,2004,200(1):79–87.
[14]Lovett-Racke AE,Rocchini AE,Choy J,et al. Silencing T-bet defines a critical role in the differentiation of autoreactive T lymphocytes. Immunity,2004,21(5):719–731.
[15]A fkarian M,Sedy JR,Yang J,et al.T-bet is a STAT1-induced regulator of IL-12R expression in naive CD4+T cells.Nat Immunol,2002,3(6): 549–557.
[16]M ullen AC,High FA,Hutchins AS et al.Role of T-bet in comm itment of TH1 cells before IL-12-dependent selection.Science,2001, 292(5523):1907–1910.
[17]A lam J,Cook JL.Reporter genes:application to the study of mammalian gene transcription.Anal Biochem,1990,188(2):245–254.
[18]Djuretic IM,Levanon D,Negreanu V,et al. Transcription factors T-bet and Runx3 cooperate to activate Ifng and silence Il4 in T helper type 1 cells.Nat Immunol,2006,8(2):145–153.
[19]Lew is MD,M iller SA,M iazgow icz MM,et al. T-bet's ability to regulate individual target genes requires the conserved T-box domain to recruit histone methyltransferase activity and a separate fam ily member-specific transactivation domain. M ol Cell Biol,2007,27(24):8510–8521.
[20]Zhang F,Meng G,Strober W.Interactions among the transcription factors Runx1,RORgammat and Foxp3 regulate the differentiation of interleukin 17-producing T cells.Nat Immunol,2008,9(11): 1297–1306.
(本文责编 陈宏宇)
Construction and identification of luciferase reporter gene containing mouse T-bet promoter
Huijuan Xu,and Shoubiao Zhou
Anhui Provincial Key Laboratory of the Conservation and Exploitation of Biological Resources,College of Life Sciences,Anhui Normal University,Wuhu 241000,Anhui,China
The aim of this study is to clone the mouse T-bet promoter and enhancer,construct and identify the firefly luciferase reporter gene plasm id pGL4.10-TBX 21pr-CNS for T-bet transcription regulation study and its function in signaling of multiple sclerosis.The promoter and CNS of T-bet were predicted by bioinformatics assay.The predicted fragment of mouse T-bet promoter plus CNS was amplified by PCR and cloned into pGL4.10.The recombinant plasm id pGL4.10-TBX 21pr-CNS was transferred into Escherichia coli DH5α.The positive clone was identified by double digestion w ith KpnⅠand SfiⅠand DNA sequencing.Finally,pGL4.10-TBX 21pr-CNS was cotransfected w ith pRL-TK into 293T cells and Jurkat cells,pRL-TK and pGL4.10 as a control.The luciferase activity in 293T cells(P=0.012 2)and Jurkat cells (P=0.002 2)was higher than that of the control group.A fragment of 1 028 bp mouse T-bet promoter plus 1 308 bp CNS was successfully cloned and the firefly luciferase reporter gene plasm id pGL4.10-TBX21pr-CNS was constructed.In 293T cells and Jurkat cells,pGL4.10-TBX21pr-CNS has the promoter functions.This work offers a basic material for the research of T-bet transcription.
T-bet,promoter,luciferase,reporter genes,transcription regulation
February 21,2014;Accep ted:March 18,2014
Shoubiao Zhou.Tel:+86-553-5910810;E-mail:zhoushoubiao@vip.163.com
徐惠娟,周守标.小鼠T-bet启动子荧光素酶报告基因载体的构建及活性鉴定.生物工程学报,2014,30(11): 1733–1741.
Xu HJ,Zhou SB.Construction and identification of luciferase reporter gene containing mouse T-bet promoter.Chin J Biotech, 2014,30(11):1733–1741.
Suppo rted by:Natural Science Foundation of Anhui Province(No.11040606M 77),Key Foundation of Education Department of Anhui Province(No.KJ2011A129).
安徽省自然科学基金(No.11040606M 77),安徽省高校自然科学基金重点项目(No.KJ2011A 129)资助。
时间:2014-07-31网络出版地址:http://www.cnki.net/kcms/doi/10.13345/j.cjb.140093.htm l
