传染性法氏囊病病毒VP4蛋白单克隆抗体的制备及鉴定
2014-06-24柳亚楠李夏莹李忠华王永强李晓齐曹红郑世军
柳亚楠,李夏莹,李忠华,王永强,李晓齐,曹红,郑世军
中国农业大学动物医学院农业生物技术国家重点实验室,北京100193
传染性法氏囊病病毒VP4蛋白单克隆抗体的制备及鉴定
柳亚楠,李夏莹,李忠华,王永强,李晓齐,曹红,郑世军
中国农业大学动物医学院农业生物技术国家重点实验室,北京100193
传染性法氏囊病病毒(IBDV)蛋白VP4在抑制宿主免疫应答中起重要作用,为制备IBDV VP4的单克隆抗体,以实验室保存的融合蛋白His-VP4免疫BALB/c小鼠,经过细胞融合、筛选、亚克隆后获得4株能稳定分泌抗VP4的单抗杂交瘤细胞株,分别命名为3B3、3H11、4C8和4G6,经间接ELISA测定4株单抗的亲和力解离常数分别为4.61×10–11、1.71×10–10、4.26×10–11和5.02×10–11,均为高亲和力抗体。4株单抗的重链类型分别为IgG1、IgG1、IgG2b和IgG1。进一步以Western blotting鉴定,该4株单抗均能特异地识别IBDV的VP4蛋白,间接免疫荧光和Western blotting试验表明4株单抗均能识别IBDV感染DF-1细胞后产生的VP4蛋白。该单抗为检测IBDV以及研究IBDV VP4的生物学作用奠定了基础。
传染性法氏囊病病毒,VP4蛋白,原核表达,单克隆抗体
传染性法氏囊病(IBD),最早报道于1962年[1],又称为“甘保罗病”,是一种危害雏鸡的急性高度传染性的病毒病,在全球范围内广泛发生[2]。1979年,我国于北京上海等地发现此病,并于上世纪90年代流行超强毒株[3]。其病原体为传染性法氏囊病病毒(IBDV),能够损伤靶细胞(B淋巴细胞前体),从而引起患病鸡严重的免疫抑制,进而增加对其他病原的易感性[4]。
IBDV属于双RNA病毒科禽双RNA病毒属,具有单层衣壳,为正20面体结构[5],直径为55–65 nm[6],电镜下病毒粒子呈晶格状分布于细胞浆中[7]。病毒基因组由2个片段(A和B)的双股RNA组成,无囊膜[8]。B片段编码VP1,是一种RNA依赖的RNA聚合酶[9-10];A片段由2个部分重叠的开放阅读框组成[11]。第1个开放阅读框编码病毒的非结构蛋白VP5,第2个编码110 kDa的pVP2-VP4-VP3前体,后被VP4蛋白水解为病毒蛋白VP2、VP3和VP4[12-15]。VP2和VP3是病毒的主要结构蛋白,分别占病毒粒子的51%和40%[16]。
VP4是病毒的蛋白酶,能够水解多聚蛋白pVP2-VP4-VP3前体为pVP2、VP4和VP3。VP4还可以促进病毒蛋白的成熟,在病毒组装过程中不断修饰VP2蛋白的C端,使其成为成熟的衣壳蛋白[17]。VP4还可发生自组装,形成直径为25 nm的管状结构[18],大肠杆菌表达的VP4蛋白也可发生自组装发挥同样的生物学功能[19]。同时,VP4蛋白能够激活VP1蛋白合成[20]。最新研究表明VP4蛋白可以抑制Ⅰ型干扰素的表达和NF-κB的活化,在IBDV引起的免疫抑制中发挥着重要作用[21],其652位的丝氨酸和692位的赖氨酸是其发挥蛋白酶活性和引起免疫抑制的关键氨基酸位点[22]。本研究成功表达VP4重组蛋白并制备出针对它的单克隆抗体,为进一步研究VP4蛋白致病的分子机理奠定了基础。
1 材料与方法
1.1 菌株、质粒、病毒、细胞与实验动物
传染性法氏囊病病毒(IBDV)Lx毒株由北京市农林科学院刘爵研究员惠赠。SP2/0细胞、DF-1细胞、DH5α、BL21、质粒pGEX-6P-1;IBDV His-VP4、CAV His-VP2、ALV His-GP85、REV His-GP90蛋白、IBDV阳性血清均由中国农业大学免疫生物学研究室保存。标准鸡SPF血清(IBDV阴性血清)购自于格林思宝公司。6–8周龄雌性BALB/c小鼠购于中国医学科学院实验动物研究所。
1.2 仪器及主要试剂
HAT、HT、弗氏完全佐剂、弗氏不完全佐剂和Mouse Monoclonal Antibody Isotyping Reagents均购自Sigma公司。胎牛血清购自HyClone公司。DMEM高糖培养基购自Gibco公司。PEG 4000购自Merck公司。HRP标记山羊抗小鼠IgG,HRP标记马抗山羊IgG,FITC标记兔抗小鼠IgG购自北京鼎国昌盛生物技术公司。限制性内切酶购自NEB公司。LA Taq酶和DNA快速连接试剂盒购自TaKaRa公司。dNTPs购自CNS公司。胶回收试剂盒购自ZYMO RESEARCH公司。高纯度质粒小量快速提取试剂盒购自北京艾德莱公司。离心机购自Sigma公司。96孔板酶标仪购自TECAN公司。
1.3 vp4基因克隆与重组表达载体pGEX-6P-1-vp4的构建根据IBDV Lx株vp4基因序列和载体pGEX-6P-1多克隆位点设计引物
(P1:5′-GGAATTC ATGGCCGACAAGGGG TACGAGGTAG-3′,P2:5′-CCGCTCGAGCTAA GCCATGGCAAGGTGGTACT-3′),其中下划线部分分别为Eco RⅠ和XhoⅠ的酶切位点。引物由上海生工生物技术公司合成。根据上述特异性引物扩增vp4基因,PCR产物和载体经双酶切回收后进行连接,将连接产物转化入DH5α感受态细胞中,经菌落PCR和酶切鉴定选择阳性单克隆进行测序,选择测序未突变且读码框正确的重组原核表达载体pGEX-6P-1-vp4。
1.4 融合蛋白GST-VP4的表达、可溶性分析及纯化
将重组载体pGEX-6P-1-vp4和空载体pGEX-6P-1分别转入到BL21表达菌中,挑取单菌落加入到5 m L含有氨苄青霉素的液体LB培养液中,37℃振荡培养过夜,取其中1 m L菌液接入50 m L含有氨苄青霉素的液体LB培养液中,37℃振荡培养至OD600为0.6–0.8,加入IPTG至终浓度为1 mmol/L,37℃诱导5 h,离心收集菌体。菌体经超声裂解后12 000 r/m in离心20 m in,收取上清。上清进行亲和层析纯化,得到重组蛋白GST-VP4。
1.5 小鼠免疫
以本实验室保存的His-VP4蛋白作为抗原,免疫8周龄雌性BALB/c小鼠。首次免疫,抗原与等体积的弗氏完全佐剂混合乳化,颈背部皮下多点注射,50µg/只。首免3周后进行二免,抗原与等体积弗氏不完全佐剂混合乳化,免疫剂量与途径同首次免疫。之后,每隔2周按照二免方法免疫,免疫2次。在四免完成后1周,断尾采血以GST-VP4包被酶标板用间接ELISA方法对免疫小鼠血清进行效价测定。效价达到要求后,在融合前3 d进行加强免疫,抗原直接注射小鼠腹腔,50µg/只。
1.6 抗VP4单克隆抗体的制备
按照Current Protocol in Immunology[23]上的方法进行细胞融合,将SP2/0细胞与无菌免疫脾细胞按照1∶10进行混合,在盛有37℃水的烧杯中,以预热的50%(M/V)PEG 4 000为融合剂逐滴加入细胞泥中,缓慢加入DMEM后离心,用含20%胎牛血清的DMEM进行重悬至每毫升1.2×106个细胞,以200µL/孔加入到96孔板中,置于37℃、5%CO2温箱中培养。融合后2、3、4、5、7、9、11 d用含HAT的20%DMEM进行半换液,第14天用含HT的20%DMEM进行半换液,第15天后换成20%DMEM。当杂交瘤细胞长至孔底的10%–25%时,在换液2 d后取100µL上清液以GST-VP4包被酶标板用间接ELISA方法进行筛选,选取2次筛选阳性值高的孔用有限稀释法进行亚克隆,亚克隆3次直至所有单克隆细胞孔阳性率为100%。
1.7 腹水制备及纯化
给经产的BALB/c小鼠腹腔注射灭菌液体石蜡0.5 m L/只,1周后腹腔注射生长状态良好的杂交瘤细胞2×106个/只,待小鼠腹腔膨大后,采集腹水离心后保存于–80℃。
采集的腹水按照硫酸铵沉淀法[24]进行纯化,透析后分装保存于–80℃。
1.8 抗VP4单抗的特性鉴定
1.8.1 单抗亚类鉴定
采用SIGMA公司的Mouse Monoclonal Antibody Isotyping Reagents试剂盒进行测定,按照说明书进行操作。
1.8.2 单抗亲和力测定
应用间接ELISA方法测定单抗亲和力。用1µg/m L GST-VP4包被酶标板,封闭后向其中加入倍比稀释的单抗,初始浓度为1µg/m L,HRP标记的山羊抗小鼠IgG为二抗进行测定。ELISA结果中以连续读数不再增加时定为抗原100%结合,以OD450吸光度值为纵坐标,抗体浓度为横坐标做散点图,生成对数趋势线及公式。以吸光度最大值一半(视为抗原与抗体结合率50%)代入公式,求出抗体浓度,即抗体亲和力解离常数(Kd)。
1.8.3 单抗特异性鉴定
用表达IBDV VP4、ALV GP85、REV GP90、CAV VP2蛋白的大肠杆菌全菌进行SDS-PAGE,以制备的单抗为一抗,进行Western blotting鉴定。
1.8.4 间接免疫荧光试验(IFA)鉴定单抗
将DF-1细胞接种于24孔板,1×105cells/孔,待细胞密度达到50%–70%时,将IBDV接种于细胞中,并设置相应的阴性对照。待细胞出现明显病变时,停止培养,用4%多聚甲醛固定和0.2%Triton X-100透化,用1%BSA封闭后加入制备的单抗作为一抗,以FITC标记的IgG为二抗,于荧光显微镜下判定结果。
1.8.5 W estern b lotting鉴定单抗
按1.8.4方法进行病毒接种,收取相应细胞裂解物,以制备的单抗为一抗进行Western blotting鉴定。
2 结果
2.1 vp4基因克隆与重组表达载体pGEX-6P-1-vp4的构建
如图1A中显示,通过PCR方法,获得大小为732 bp的目的片段,质粒pGEX-6P-1-vp4经Eco RⅠ/XhoⅠ双酶切鉴定,出现大小与PCR结果一致的条带(图1B)。基因测序结果正确。
2.2 融合蛋白GST-VP4的纯化
对含质粒pGEX-6P-1-vp4的重组菌进行诱导表达,在54 kDa处诱导表达出目的蛋白,超声裂解后在上清和沉淀中均含有目的蛋白。取诱导表达上清进行纯化,在54 kDa处纯化出GST-VP4(图2A),测定蛋白浓度为0.4 mg/m L。
2.3 抗VP4单抗的制备及特异性鉴定
小鼠4次免疫后,经ELISA测定血清中抗体的效价均高于1∶10 000。经过融合后得到14个阳性克隆,选取其中6个进行3次亚克隆,得到4株能稳定分泌单抗的杂交瘤细胞株,分别命名为3B3、3H11、4C8和4G6。将杂交瘤细胞注射到经产母鼠体内制备腹水,并进行纯化,测定并稀释蛋白浓度至2 mg/m L。
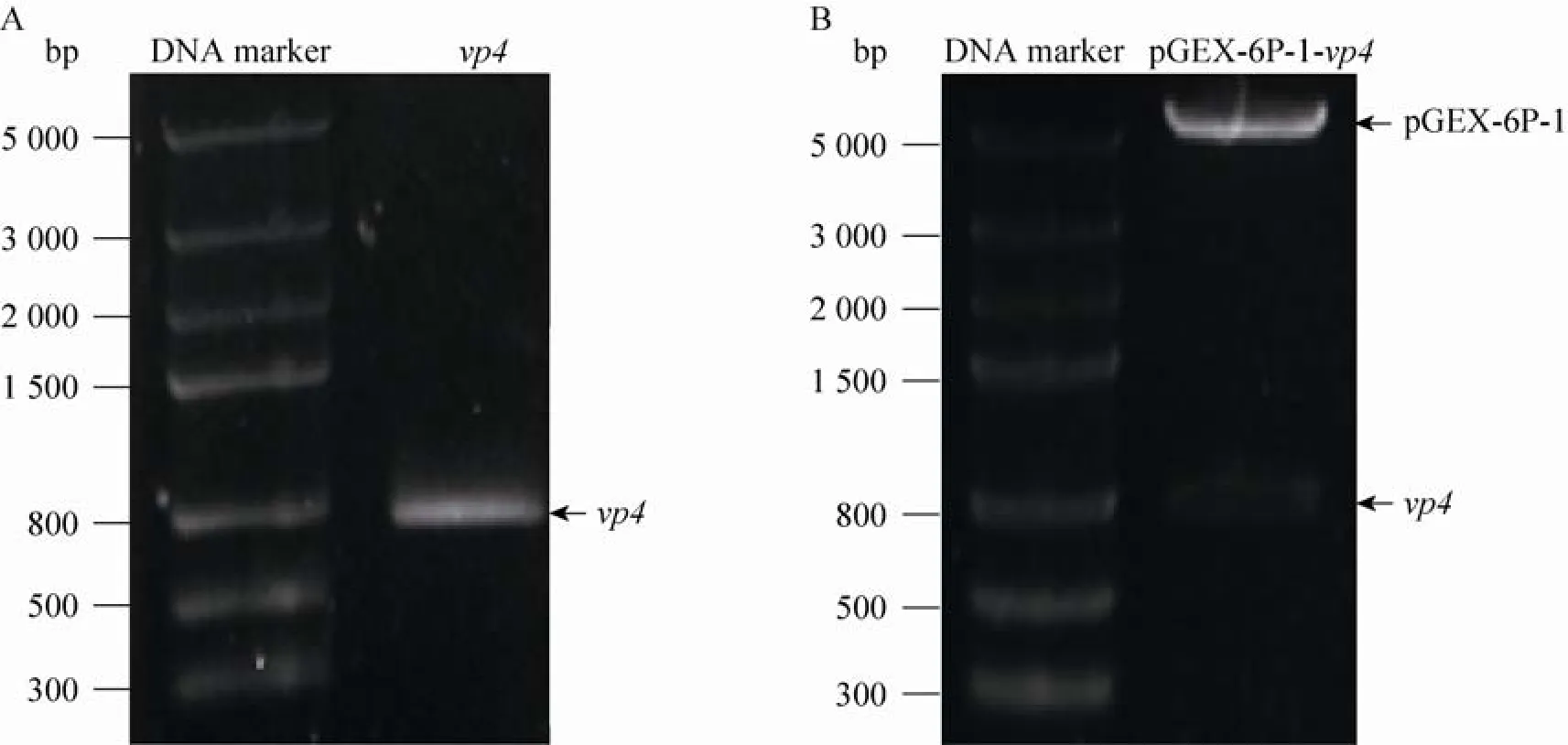
图1 vp4基因克隆与重组表达载体pGEX-6P-1-vp4的构建Fig.1 Cloning of vp4 gene and construction of its recombinant expression vector pGEX-6P-1-vp4.(A)Cloning of vp4 gene.(B)Digestion of pGEX-6P-1-vp4 plasm id w ith restriction enzyme Eco RⅠand XhoⅠ.
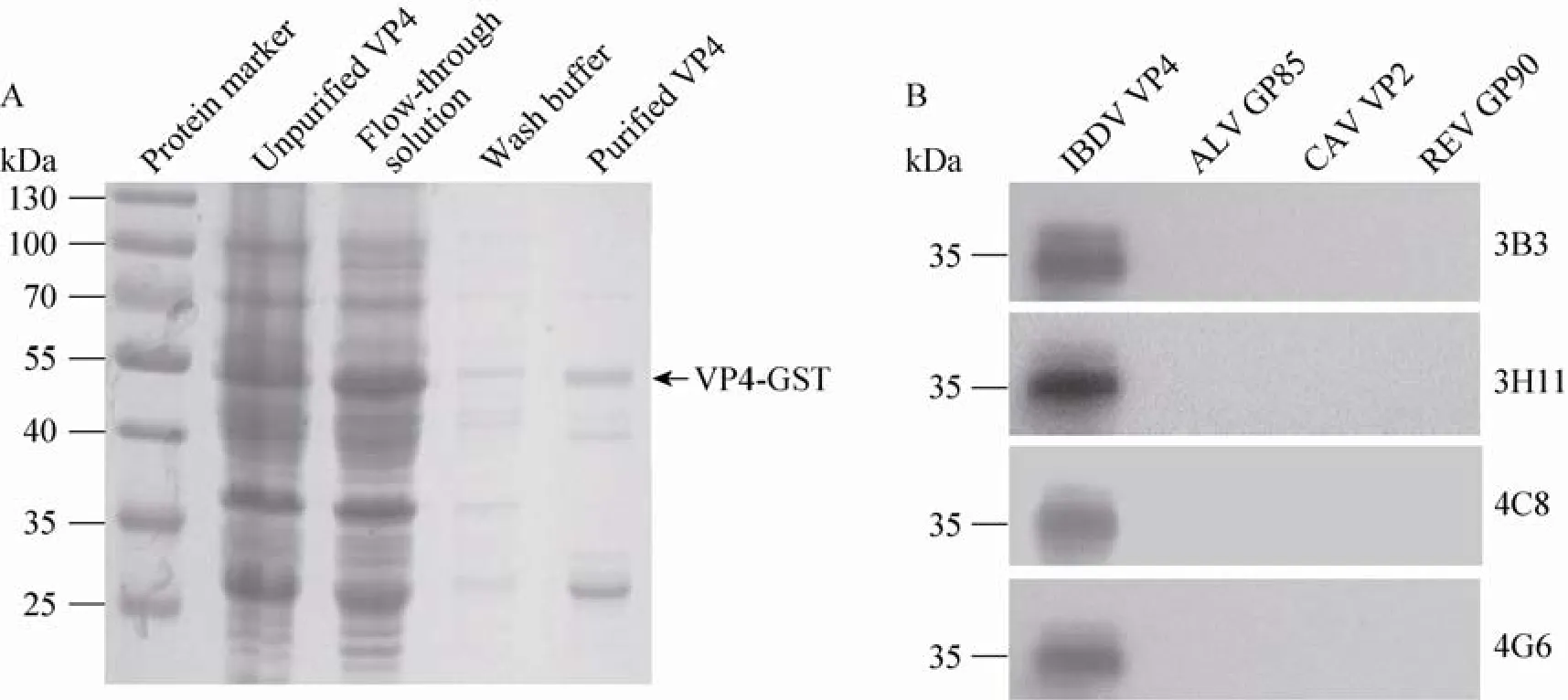
图2 GST-VP4蛋白的纯化与单抗特异性鉴定Fig.2 Purification of recombinant protein VP4 and identification of specificity of anti-VP4 M cAbs.(A) Purification of recombinant protein GST-VP4.(B)Analysis of the specificity of anti-VP4 M cAbs.
用Western blotting方法检测原核表达传染性法氏囊病病毒(IBDV)His-VP4(33 kDa)、鸡传染性贫血病毒(CAV)His-VP2(34 kDa)、禽白血病病毒(ALV)His-GP85(34 kDa)、禽网状内皮组织增生症病毒(REV)His-GP90(36 kDa)。结果表明4株单抗均能识别原核表达的VP4蛋白,而不识别对照组的其他病毒蛋白(图2B),因此制备的单抗识别VP4具有良好的特异性。
2.4 抗VP4单抗亚类鉴定
按小鼠单抗亚类鉴定试剂盒说明书(Sigma)鉴定单抗的重链类型,结果3B3、3H11和4G6株的重链类型为IgG1,4C8株的重链类型为IgG2b。
2.5 抗VP4单抗亲和力测定
应用间接ELISA测定4株单抗的亲和力,结果如图3显示,4株单抗的亲和力解离常数(Kd)分别:3B3株:4.61×10–11,3H11株:5.02×10–11,4C8株:1.71×10–10,4G6株:4.26×10–11,表明4株单抗均为高亲和力抗体。
2.6 单抗识别IBDV感染DF-1细胞产生的VP4蛋白
间接免疫荧光试验结果如图4A所示,表明4株单抗均能识别IBDV感染DF-1细胞后产生的VP4蛋白。同样,用Western blotting方法检测,如图4B所示:4株单抗均能很好地识别VP4,而不识别未感染的阴性对照。该结果表明获得的M cAbs均能识别天然IBDV病毒蛋白VP4的抗原表位。

图3 抗VP4单克隆抗体亲和力测定Fig.3 A ffinity test of anti-VP4 M cAbs.(A–D)A ffinity test of 3B3,3H11,4C8 and 4G6.
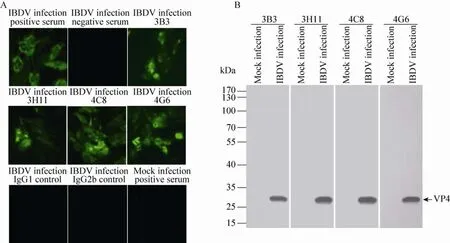
图4 单抗识别病毒感染产生的VP4蛋白Fig.4 Anti-VP4 M cAbs recognize VP4 in IBDV-infected cells.(A)Detection of IBDV VP4 by IFA using indicated M cAbs.(B)Detection of IBDV VP4 by Western blotting using indicated M cAbs.
3 讨论
传染性法氏囊病是由IBDV感染后引起的一种危害雏鸡的急性、烈性和高度接触传染性疾病。发病鸡存活后出现严重的免疫抑制,从而导致混合感染和继发感染,使死淘率增加,给养禽业造成了巨大的经济损失。目前认为IBDV基因组编码5种病毒蛋白。VP4蛋白是由多聚蛋白VP2-4-3自剪切产生的一种病毒蛋白酶[25]。
近来又有研究表明:在致病性IBDV感染鸡体内存在VP4特异性抗体,但是在弱毒IBDV免疫的鸡体内几乎不存在抗VP4蛋白抗体。这个结果提示我们,IBDV VP4蛋白特异性抗体可以作为一种区分致病性与非致病性IBDV的标志物,为IBDV的流行病学研究提供一种新方法。因此,对鸡群VP4抗体水平检测具有流行病学意义,可以用来区分疫苗免疫和野毒感染,还可以分析不同病毒的毒力[26]。
在本研究中,利用实验室保存的His-VP4蛋白免疫BALB/c小鼠,常规方法进行细胞融合,用本研究表达纯化的GST-VP4作为ELISA包被抗原进行筛选,获得4株能分泌抗体的杂交瘤细胞株。这些单抗不仅识别用原核表达的VP4蛋白,也识别IBDV感染细胞中的VP4蛋白,说明4株单抗均具有识别天然病毒蛋白VP4的能力。许多研究者利用可以分泌IL-6的饲养层细胞来增强杂交瘤细胞的生长活性,但可能会有污染细胞的情况发生,本研究中利用无菌过滤的胸腺培养上清液来培养杂交瘤细胞,能达到同样的效果并能避免污染。我们选择生长状态良好的杂交瘤细胞株进行大量扩繁冻存保种。实验结果证明以重组VP4蛋白制备特异性单克隆抗体效果良好,为深入研究IBDV致病机理提供了重要的工具,也为建立本病的新型诊断方法提供了生物材料。
中国是世界上最早发明陶器的国家之一,并且是最早发明瓷器的国家。英文“china”就有中国和瓷器的双重含义,因此西方称中国为“瓷”之国,可见我国陶瓷艺术在世界上所具有的深远影响。
REFERENCES
[1]Cosgrove AS.An apparently new disease of chickens:avian nephrosis.Avian Diseases,1962, 6(3):385–389.
[2]Pitcovski J,Gutter B,Gallili G,et al.Development and large-scale use of recombinant VP2 vaccine for the prevention of infectious bursal disease of chickens.Vaccine,2003,21(32):4736–4743.
[3]Li CW,Li YL,Zhou XR.Research progress on infectious bursal disease virus.Heilongjiang J Anim Sci Vet Med,2002(2):47–49(in Chinese).李成洪,李英伦,周晓容.鸡传染性法氏囊病研究进展.黑龙江畜牧兽医,2002(2):47–49.
[4]Stricker RL,Behrens SE,Mundt E.Nuclear factor NF45 interacts w ith viral proteins of infectious bursal disease virus and inhibits viral replication.J Virol,2010,84(20):10592–10605.
[5]Böttcher B,Kiselev NA,Stel'Mashchuk VY,et al. Three-dimensional structure of infectious bursal disease virus determ ined by electron cryom icroscopy.J Virol,1997,71(1):325–330.
[6]Hirai K,Shimakura S.Structure of infectious bursal disease virus.J Virol,1974,14(4):957–964.
[7]Käufer I,Weiss E.Electron-m icroscope studies on the pathogenesis of infectious bursal disease after intrabursal application of the causal virus.Avian Diseases,1975,20(3):483–495.
[8]Azad AA,Barrett SA,Fahey KJ.The characterization and molecular cloning of the double-stranded RNA genome of an Australian strain of infectious bursal disease virus.Virology, 1985,143(1):35–44.
[9]von Einem UI,Gorbalenya AE,Schirrmeier H,et al.VP1 of infectious bursal disease virus is an RNA-dependent RNA polymerase.J Gen Virol, 2004,85(Pt 8):2221–2229.
[10]Pan J,Lin L,Tao YJ.Self-guanylylation of birnavirus VP1 does not require an intact polymerase activity site.Virology,2009,395(1): 87–96.
[11]Kibenge FS,M cKenna PK,Dybing JK.Genome cloning and analysis of the large RNA segment (segment A)of a naturally avirulent serotype 2 infectious bursal disease virus.Virology,1991, 184(1):437–440.
[12]Hudson PJ,M cKern NM,Power BE,et al. Genom ic structure of the large RNA segment of infectious bursal disease virus.Nucleic Acids Res, 1986,14(12):5001–5012.
[13]Jagadish MN,Staton VJ,Hudson PJ,et al. Birnavirus precursor polyprotein is processed in Escherichia coli by its own virus-encoded polypeptide.J Virol,1988,62(3):1084–1087.
[14]Azad AA,Barrett SA,Fahey KJ.The characterization and molecular cloning of the double-stranded RNA genome of an Australian strain of infectious bursal disease virus.Virology, 1985,143(1):35–44.
[15]Jagadish MN,Staton VJ,Hudson PJ,et al. Birnavirus precursor polyprotein is processed in Escherichia coli by its own virus-encoded polypeptide.J Virol,1988,62(3):1084–1087.
[16]Dobos P,Hill BJ,Hallett R,et al.Biophysical and biochem ical characterization of five animal viruses w ith bisegmented double-stranded RNA genomes.J Virol,1979,32(2):593–605.
[17]Da CB,Chevalier C,Henry C,et al.The capsid of infectious bursal disease virus contains several small peptides arising from the maturation process of pVP2.J Virol,2002,76(5):2393–2402.
[18]Granzow H,Birghan C,Mettenleiter TC,et al.A second form of infectious bursal disease virus-associated tubule contains VP4.J Virol,1997, 71(11):8879–8885.
[19]Chang GR,Wang MY,Liao JH,et al.Endopeptidase activity characterization of E. coli-derived infectious bursal disease virus protein 4 tubules.Protein Eng Des Sel,2012,25(11): 789–795.
[20]Birghan C,Mundt E,Gorbalenya AE.A non-canonical lon proteinase lacking the ATPase domain employs the ser-Lys catalytic dyad to exercise broad control over the life cycle of a double-stranded RNA virus.EMBO J,2000,19(1): 114–123.
[21]Li Z,Wang Y,Li X,et al.Critical roles of glucocorticoid-induced leucine zipper in infectious bursal disease virus(IBDV)-induced suppression of type I Interferon expression and enhancement of IBDV grow th in host cells via interaction w ith VP4.J Virol,2013,87(2):1221–1231.
[22]Lejal N,Da CB,Huet JC,et al.Role of Ser-652 and Lys-692 in the protease activity of infectious bursal disease virus VP4 and identification of its substrate cleavage sites.J Gen Virol,2000,81(Pt 4): 983–992.
[23]Yokoyama WM.Current Protocols in Immunology. Hoboken:John W iley&Sonc,Inc,1995.
[24]Li SJ.Deveplopment and application of monoclonal antibodies against the IBDV VP2 and VP5 protein[D].Beijing:China Agricultural University,2013(in Chinese).李善吉.传染性法氏囊病毒VP2和VP5单克隆抗体的制备鉴定及应用[D].北京:中国农业大学, 2013.
[25]Lombardo E,Maraver A,Caston JR,et al.VP1,the putative RNA-dependent RNA polymerase of infectious bursal disease virus,forms complexes w ith the capsid protein VP3,leading to efficient encapsidation into virus-like particles.J Virol, 1999,73(8):6973–6983.
[26]Wang Y,Wu X,Li H,et al.Antibody to VP4 protein is an indicator discrim inating pathogenic and nonpathogenic IBDV infection.Mol Immunol, 2009,46(10):1964–1969.
(本文责编 郝丽芳)
Preparation and identification of monoclonal antibodies against Infectious Bursal Disease Virus(IBDV)VP4
Ya’nan Liu,Xiaying Li,Zhonghua Li,Yongqiang Wang,Xiaoqi Li,Hong Cao, and Shijun J.Zheng
State Key Laboratory of Agrobiotechnology,College of Veterinary Medicine,China Agricultural University,Beijing 100193,China
Infectious bursal disease virus(IBDV)VP4 plays an important role in immunosuppression of host.In order todevelop monoclonal antibodies(M cAbs)against VP4,we vaccinated BALB/c m ice w ith His-VP4,screened and subcloned positive clones.We established 4 hybridoma cell lines that stably secreted M cAbs against VP4 and named these cell lines 3B3,3H11,4C8 and 4G6,respectively.We tested the dissociation constant(Kd)of these M cAbs,and found that their Kds were 4.61×10–11,1.71×10–10,4.26×10–11,5.02×10–11,respectively.The isotypes of these M cAbs were determ ined to be IgG1,IgG1,IgG2b and IgG1.These McAbs specifically bound to VP4 in IBDV infected DF-1 cells as demonstrated by Western blotting analysis and fluorescence antibody assay.These M cAbs would help to detect IBDV infection and to analyze the biological activities of IBDV VP4.
Infectious Bursal Disease Virus,VP4,prokaryotic expression,monoclonal antibody
February 24,2014;Accep ted:May 12,2014
Shijun J.Zheng.Tel/Fax:+86-10-62734861;E-mail:sjzheng@cau.edu.cn
柳亚楠,李夏莹,李忠华,等.传染性法氏囊病病毒VP4蛋白单克隆抗体的制备及鉴定.生物工程学报,2014,30(11): 1660−1668.
Liu YN,Li XY,Li ZH,et al.Preparation and identification of monoclonal antibodies against Infectious Bursal Disease Virus (IBDV)VP4.Chin J Biotech,2014,30(11):1660−1668.
Suppo rted by:National Natural Science Foundation of China(No.31272543),Earmarked Fund for Modern Agro-industry Technology Research System(No.NYCYTX-41).
国家自然科学基金(No.31272543),现代农业产业技术体系建设专项资金(No.NYCYTX-41)资助。
时间:2014-05-21网络出版地址:http://www.cnki.net/kcms/doi/10.13345/j.cjb.140106.htm l
