两种UDP-葡萄糖脱氢酶对透明质酸生物转化的影响
2014-06-24郭东会韩剑刘伟丰傅震洲朱启忠陶勇
郭东会,韩剑,刘伟丰,傅震洲,朱启忠,陶勇
1山东大学海洋学院,山东威海264209 2中国科学院微生物研究所,北京100101
工业生物技术
两种UDP-葡萄糖脱氢酶对透明质酸生物转化的影响
郭东会1,韩剑2,刘伟丰2,傅震洲2,朱启忠1,陶勇2
1山东大学海洋学院,山东威海264209 2中国科学院微生物研究所,北京100101
分别从大肠杆菌和化脓链球菌中扩增出编码UDP-葡萄糖脱氢酶基因ecohasB和spyhasB,并将其插入T7表达载体pRX2构建重组质粒pRXEB和pRXSB。在大肠杆菌BL21(DE3)中重组表达,并对经镍柱纯化后的UDP-葡萄糖脱氢酶的酶学性质进行分析。酶学性质研究表明:spy HasB的最适反应温度是30℃,最适pH 10,最适条件下的比活力是12.2 U/mg;eco HasB的最适反应温度是30℃,最适pH 9,最适条件下的比活力是5.55 U/mg。从多杀巴氏杆菌扩增出的透明质酸合成酶基因pmuhasA分别与ecohasB和spyhasB构建共表达载体pBPAEB和pBPASB。将其转化到大肠杆菌BW 25113中,经生物转化生产透明质酸(HA),并对转化条件进行了优化。结果表明:重组菌株进行透明质酸转化时,UDP-葡萄糖脱氢酶酶活力越高,稳定性越好,HA产量越高;转化条件优化后,pBPAEB/BW 25113和pBPASB/BW 25113在摇瓶中的产量分别是1.52和1.70 g/L,比之前报道的提高了2−3倍。
UDP-葡萄糖脱氢酶,酶学性质,透明质酸,生物转化
透明质酸(Hyaluronic acid,HA)是一种糖胺聚糖,它是由D-葡糖醛酸(GlcA)和N-乙酰葡萄糖胺(NAG)以β(1→3)和β(1→4)糖苷键交替连接的二糖结构单位组成[1],在医药、食品、化妆品等领域有广泛的应用[2-4]。目前,全球市场对HA产品需求超过十亿美元[5]。
HA最早是从动物组织中提取,但存在来源困难、价格昂贵、提取工艺复杂、HA产量低、有跨种属病毒传染风险等诸多缺点。与动物组织提取相比,微生物发酵生产HA具有原料充足、成本低、易于分离纯化、可以大规模化生产等优点。发酵生产HA起始于20世纪80年代,主要的生产菌株是兽疫链球菌,目前发酵产量可以达到6−7 g[6],近来研究者主要通过诱变、发酵条件优化[7]等方式提高HA产量,但兽疫链球菌是潜在的致病菌,其生产的HA在医学上的应用受到了限制。因此,重组菌生产HA已成为一个趋势。目前,国内外已报道过的重组菌包括土壤农杆菌[8]、乳酸菌[9]、枯草芽胞杆菌[10]、嗜热链球菌[11]和大肠杆菌[12-13]。与上述其他菌株相比,大肠杆菌具有易于培养、发酵条件容易控制、遗传背景清晰、遗传操作成熟、有大量的调控元件、调控模块可供选择等优势[13-14],因此重组的大肠杆菌可以成为HA生物转化的良好宿主。
UDP-葡萄糖脱氢酶(UDP-glucose dehydrogenase,简称UGDH,EC 1.1.1.22)催化2分子的NAD和1分子UDP-葡萄糖(UDP-Glc)生成2分子的NADH和1分子UDP-葡糖醛酸(UDP-GlcA)[15],生成的UDP-GlcA是参与HA合成的前体物质之一。
目前,国内外主要对来源于超嗜热古菌-冰岛热棒菌hyperthermophilic Archaeon Pyrobaculum islandicum[16]、海洋真菌草茎点霉Phoma herbarum YS4108[17]、鞘氨醇单胞菌Sphingomonas elodea[18]、大肠杆菌Escherichia coli[19]和化脓链球菌Streptococcus pyogenes[20]UDP-葡萄糖脱氢酶的性质进行了相关报道。大肠杆菌K5来源的kfiD[13],大肠杆菌K12来源的ugd[12],枯草芽胞杆菌来源的tuaD[10]和链球菌来源的hasB[11]用于在重组菌中发酵生产HA。2009年,Sheng等[21]在重组乳酸菌合成HA的过程中发现,高活性的UDP-葡萄糖脱氢酶更有利于HA的生成。2005年,W indner等[10]发现重组枯草芽胞杆菌中,UDP-GlcA限制了HA的合成。2008年,Yu等[12]分析发现ecohasB基因的过表达能显著提高HA的产量。这些研究结果表明UDP-葡萄糖脱氢酶是透明质酸合成过程中的关键酶,因此有必要在HA生产菌株中筛选和优化UDP-葡萄糖脱氢酶基因。
本研究对大肠杆菌K12来源的eco HasB和化脓链球菌来源的spy HasB酶学性质进行比较分析。首次将多杀性巴氏杆菌的hasA基因分别与ecohasB和spyhasB基因在大肠杆菌BW 25113中共表达,采用生物转化的方法生产透明质酸,并对转化条件进行了优化。通过UGDH酶学性质的比较和重组菌株HA产量的分析,阐明其在HA生产中的作用,这为后期大规模生产HA提供了一定的理论基础。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒
pRX2和pBAD-HisB质粒,大肠杆菌BW 25113和大肠杆菌BL21(DE3)菌株均为本实验室保存;多杀巴氏杆菌购自国家兽医微生物菌种保藏中心,菌株编号CVCC408;化脓链球菌为中国科学院微生物研究所王北难课题组提供。
1.1.2 主要试剂
UDP-葡萄糖和NAD购于Sigma公司;N-乙酰葡萄糖胺购于阿拉丁试剂(上海)有限公司;DNA marker和Protein marker购于Fermentas公司;TransStart Fast Pfu DNA Polymerase购于北京全式金生物技术有限公司;T4 DNA连接酶购于Promega公司;细菌基因组提取试剂盒、质粒提取试剂盒、普通DNA回收试剂盒和琼脂糖凝胶回收试剂盒购于天根生化科技(北京)有限公司。
1.1.3 主要培养基和溶液
自诱导培养基:10 g/L蛋白胨,5 g/L酵母提取物,5 g/L甘油,0.5 g/L葡萄糖,2 g/L阿拉伯糖或者2 g/L乳糖,25 mmol/L磷酸氢二钠,50 mmol/L氯化铵,25 mmol/L磷酸二氢钾,5 mmol/L硫酸钠,2 mmol/L的硫酸镁,50 mmol/L氯化亚铁,0.02 mmol/L氯化钙,0.01 mmol/L氯化镁,0.01 mmol/L硫酸锌,0.002 mmol/L氯化钴、氯化铜、氯化镍、钼酸钠、亚硒酸钠和硼酸,0.06 mmol/L盐酸和0.1 g/L氨苄青霉素钠[22]。
生物转化培养基:75 mmol/L N-乙酰葡萄糖胺(NAG),50 mmol/L磷酸钾缓冲液(pH 7.0), 4 mmol/L MgSO4·7H2O,2 mmol/L氯化锰,25 g/L葡萄糖(Glc),5 g/L硫酸铵[8]。
1.2 方法
1.2.1 基因组的提取
化脓链球菌、大肠杆菌和多杀巴氏杆菌CVCC408的基因组DNA采用细菌基因组提取试剂盒提取。
1.2.2 hasA和hasB基因的克隆
根据多杀巴氏杆菌透明质酸合成酶(Pasteurella multocida hyaluronan synthase)pmuhasA序列(GenBank Accession No.AF036004.2),化脓链球菌Streptococcus pyogenes MGAS5005 spyhasB序列(GenBank Accession No.CP000017.1)和大肠杆菌Escherichia coli str.K-12 substr.MG1655 ecohasB序列(GenBank Accession No.U00096.3),利用Primer Premier 5.0设计引物见表1。
分别以多杀巴氏杆菌、化脓链球菌和大肠杆菌的基因组DNA为模板,以表1对应的上下游引物扩增基因。PCR条件:95℃5 m in;95℃30 s,55℃30 s,72℃3 min共30个循环;72℃5 min。 PCR产物用1.0%的琼脂糖凝胶电泳检测,用普通DNA回收试剂盒回收。
1.2.3 工程菌的构建
质粒的提取、酶切、连接、转化等实验操作均按照《分子克隆实验指南》[23]进行。ecohasB的PCR产物,质粒pRX2NdeⅠ/KpnⅠ双酶切连接转化;spyhasB的PCR产物,质粒pRX2NdeⅠ/SacⅠ双酶切连接转化,挑选阳性克隆测序,鉴定正确的重组载体分别命名为pRXEB和pRXSB(图1)。pmuhasA的PCR产物,质粒pBAD NcoⅠ/SacⅠ双酶切连接转化;pmuhasA的PCR产物NcoⅠ/Bam HⅠ双酶切,ecohasB的PCR产物Bam HⅠ/SacⅠ双酶切,pBAD-HisB质粒NcoⅠ/SacⅠ双酶切,连接转化;pmuhasA的PCR产物NcoⅠ/Bam HⅠ双酶切,spyhasB的PCR产物Bam HⅠ/SacⅠ双酶切,pBAD-HisB质粒NcoⅠ/SacⅠ双酶切,连接转化;挑选阳性克隆测序,鉴定正确的重组载体分别命名为pBPA、pBPAEB和pBPASB(图1)。
1.2.4 UGDH的表达纯化
将重组质粒pRXEB和pRXSB转化到大肠杆菌BL21(DE3)中,挑选单克隆,37℃培养过夜。按1%的接种量接种到自诱导培养基中(诱导物终浓度为2 g/L乳糖),置于16℃,220 r/min下振荡培养24 h。4℃、5 000 r/min,离心10 m in收集菌体。
菌体重悬到50 mmol/L Tris-HCl(pH 8.0)缓冲液中,经超声波破碎,4℃、10 000 r/m in离心30 m in,收集上清。上清用0.22 μm的滤膜过滤后通过FPLC用镍柱纯化。1 m L/m in流速上样,含40 mmol/L咪唑的Tris-HCl(pH 8.0)洗脱杂蛋白,含250 mmol/L咪唑的Tris-HCl(pH 8.0)洗脱目的蛋白。目的蛋白于50 mmol/L Tris-HCl(pH 8.0)缓冲液中,4℃透析过夜。SDS-PAGE电泳检测蛋白的纯度。
1.2.5 UGDH的酶活测定[18]
反应体系:100 mmol/L Tris-HCl,5 mmol/L DTT,10 mmol/L MgCl2,2 mmol/L UDP-glucose和1.5 mmol/L NAD,在340 nm处测OD值的增量。酶活定义:在一定的温度和pH条件下,每分钟反应生成1 μmol NADH所需酶量为1个酶活力单位(μmol/m in)。酶活性计算公式:A(U)=1/ε*V总/V酶*ΔOD/Δt;V总和V酶分别代表酶活测定反应体系的体积及酶液体积;ε为摩尔吸光系数6.22×10–3μmol–1cm–1。用Bradford法测蛋白含量,牛血清蛋白BSA为标准蛋白。
1.2.6 UGDH的酶学性质分析
1)pH对UGDH酶活力的影响及UGDH的pH稳定性
最适pH:在室温下分别于pH 7.0−11.0缓冲体系中测定UGDH样品溶液的酶活力。pH稳定性:UGDH样品溶液分别在pH 3.0−11.0缓冲体系中,室温下放置3 h,然后测定不同缓冲体系中剩余酶活力(其中pH 3.0−6.0为0.1 mol/L柠檬酸-柠檬酸钠缓冲液;pH 6.0−9.0为0.1 mol/LTris-HCl缓冲液;pH 9.0−11.0为0.1 mol/LGly-NaOH缓冲液)。
2)温度对UGDH酶活力的影响及UGDH的热稳定性
最适温度:在UGDH的最适反应pH下,分别于16℃、20℃、30℃、37℃、45℃、55℃下测定UGDH样品溶液的酶活力。热稳定性:UGDH样品溶液分别于16℃、20℃、30℃、37℃、45℃、55℃下温育3 h,在最适条件下测定样品的剩余酶活力。
1.2.7 生物转化法生产HA
1)UGDH和HasA的表达
重组质粒pBPA,pBPAEB和pBPASB转化到大肠杆菌BW 25113中,挑选单克隆,37℃培养过夜。按1%的接种量接种到自诱导培养基中(诱导物终浓度为2 g/L阿拉伯糖),37℃,220 r/m in振荡培养13 h。4℃、5 000 r/min离心10 m in收集菌体。SDS-PAGE电泳检测pmu HasA、eco HasB和spy HasB的蛋白表达情况。
2)HA的转化
上述菌体(OD600为20)重悬于转化培养基中,33℃,230 r/m in振荡培养10 h,每隔3 h用氨水将转化液中pH调至7.0。
3)HA的提取与测定
HA的提取采用Chung等[24]的方法和HA产量的测定采用Wen等的CTAB法[25]。
4)转化条件的优化
pH:6.0,6.5,7.0,7.5,8.0;温度:24,29,33,37,42℃;NAG浓度:0,5,10,15,20,25 mmol/L;Glc浓度:0.5,1.0,1.5,2.0,2.5,3%;表面活性剂0.05%CTAB,SDS,Tween80,Triton X-100。
2 结果
2.1 序列分析
测序结果显示:pmuhasA基因与报道的多杀巴氏杆菌透明质酸合成酶(Pasteurella multocida hyaluronan synthase)pmhasA基因序列相似性99%,蛋白序列存在1个氨基酸差异,725位G→S;spyhasB基因与报道的化脓链球菌Streptococcus pyogenes MGAS5005 spyhasB基因序列相似性99%,蛋白序列存在1个氨基酸差异,400位N→G;ecohasB基因与报道的Escherichia coli str.K-12 substr.MG1655 ecohasB基因序列相似性100%。
2.2 UGDH的表达及纯化
SDS-PAGE(图2)分析表明,16℃诱导的eco HasB和spy HasB大部分以可溶形式存在于破碎后的上清中。eco HasB和spy HasB重组蛋白大小约为45 kDa。通过凝胶扫描系统分析,经Ni柱纯化后的eco HasB和spy HasB的纯度在90%以上。
2.3 UGDH的酶学性质分析
2.3.1 pH对UGDH酶活力的影响及UGDH的pH稳定性
图3表明eco HasB和spy HasB的最适pH分别是9.0和10.0。UGDH的pH的稳定性表明,eco HasB在pH 6.0最稳定,pH 6−7下酶活力维持在70%以上。spy HasB在pH 7.0最稳定,pH 7−9下酶活力能维持在80%以上,pH为9仍能维持70%的酶活力;表明spy HasB在偏碱性条件下比eco HasB更稳定。
2.3.2 温度对UDPG酶活力的影响及UDPG的热稳定性
图4表明:eco HasB和spy HasB的最适反应温度均为30℃,UGDH的热稳定性实验表明,随着温度的升高,UGDH的活性缓慢下降,eco HasB和spy HasB在37℃以下温育3 h后,酶活力均能维持在70%以上,而在45℃以上温育3 h,酶活力几乎全部消失。

图2 重组eco HasB和spy HasB的SDS-PAGE分析Fig.2 SDS-PAGE analysis of pRXEB/BL21(DE3) andpRXSB/BL21(DE3).M:size markers(from top to bottom:200,150,120,100,85,70,60,50,40,30,25, 20,15,and 10 kDa);1:supernatant non-induced pRXEB/BL21(DE3);2:supernatant induced pRXEB /BL21(DE3);3:purified fusion eco HasB about 45 kDa; 4:supernatant non-induced pRXSB/BL21(DE3);5: supernatant induced pRXSB/BL21(DE3);6:purified fusion spy HasB about 45 kDa.
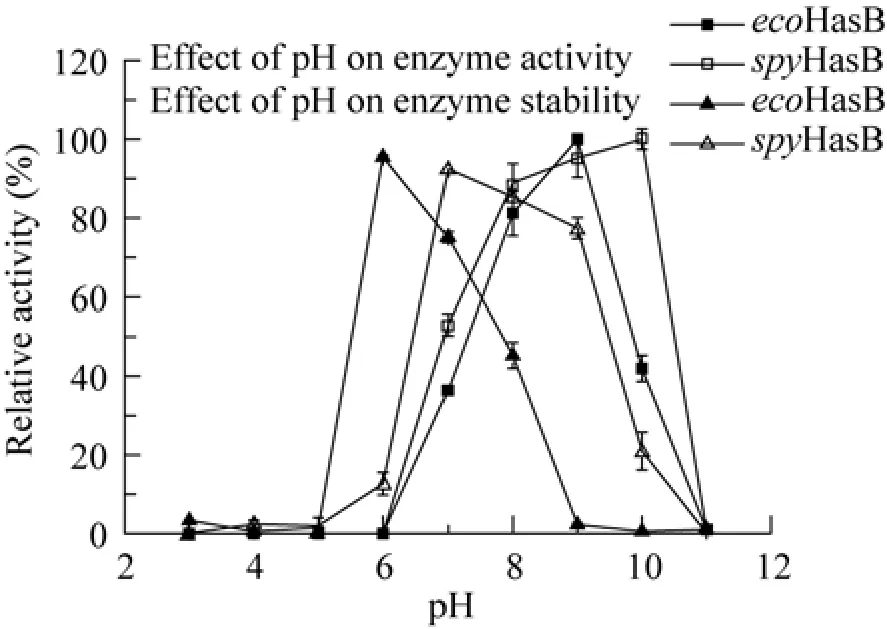
图3 pH对酶活力的影响Fig.3 Effect of pH on enzyme activity.

图4 温度对酶活力的影响Fig.4 Effect of temperature on enzyme activity.
2.4 UGDH和HasA的表达
SDS-PAGE(图5)分析表明,泳道2,3,4中pmu HasA均得到了蛋白表达大小约为106 kDa。泳道3,4中eco HasB和spy HasB均得到蛋白表达大小约为45 kDa,eco HasB比spy HasB蛋白表达量大。
2.5 生物转化条件的优化
在不同条件下,对pBPAEB/BW 25113和pBPASB/BW 25113的HA产量进行分析。如图6A所示:pH 7.5时,HA的产量最高,生物转化液在pH 7.0−8.0之间,HA的产量均能达到1 g/L以上。当pH<7时,HA的产量明显下降;如图6B所示,在33℃,HA的产量最高;如图6C所示,NAG的浓度为20 mmol/L HA产量最高,通过HPLC测定分析发现生物转化10 h后,NAG依然有剩余;如图6D所示,在NAG浓度为0时,Glc的浓度为2%HA产量最高,通过SBA生物传感分析仪测定生物转化10 h后,Glc仍然过剩;表面活性剂对生物转化的影响:0.05%Tween80对HA的生产有促进作用,而0.05%TritonX-100、0.05%SDS、0.05%CTAB对HA的生产有抑制作用;优化后HA转化的条件为20 mmol/L NAG,2%Glc,0.05%Tween 80,pH 7.5,33℃。

图5 HasA和HasB的共表达SDS-PAGE分析Fig.5 SDS-PAGE analysis of co-expression HasA and HasB.M:size markers(from top to bottom:200, 150,120,100,85,70,60,50,40,30,25,20,15 and 10 kDa);1:induced pBAD-HisB/BW 25113;2:induced pBPA/BW 25113;3:induced pBPAEB/BW 25113;4: induced pBPASB/BW 25113.

图6 不同条件对HA产量的影响(A:pH;B:温度;C:NAG;D:G lc)Fig.6 Effect of different conditions on HA production.(A)pH.(B)Temperature.(C)NAG.(D)Glc.
2.6 UDP-葡萄糖脱氢酶的酶学性质对透明质酸产量的影响
eco HasB和spy HasB酶学性质比较发现spy HasB比eco HasB酶比活力更高,更稳定。eco HasB在25℃,pH 9.0条件下,粗酶比活力是0.32 U/mg,在30℃,pH 9.0条件下,纯酶比活力是5.55 U/mg;spy HasB在25℃,pH 10.0条件下粗酶比活力是0.44 U/mg,在30℃,pH 10.0条件下,纯酶比活力是12.2 U/mg。在初始生物转化条件下,重组菌pBAD-HisB/BW 25113和pBPA/BW 25113没有检测到HA;重组菌pBPAEB/BW 2513和pBPASB/BW 25113 HA产量分别为1.15和1.29 g/L。生物转化条件优化后,菌株pBPAEB/BW 2513和pBPASB/BW 25113HA产量提高到了1.52和1.7 g/L,两株重组菌HA的产量均提高了30%以上。研究表明:HasB越稳定,比活力越高,生物转化生成的HA产量越高。
3 讨论
UGDH在生物体许多过程中是必需的。UGDH催化的产物UDP-GlcA是形成结构多糖和细胞生长代谢必不可缺的前体物质[26-27]。2013年,陈奕涵等[19]用严格控制的温敏型转录强启动子PL诱导e co HasB的表达,38℃下诱导6 h后酶活力达到了14 U/mg,但10 h后降低到4 U/mg。表明eco HasB很难长时间在细胞内保持较高的活性,而本研究重组表达的eco HasB 37℃以下,pH为6的缓冲液中比较稳定。1993年,Dougherty等[20],37℃下,在大肠杆菌JM 109(DE3)中表达了spy HasB。在30℃下测定的酶比活分别是1.51和3.71 U/mg(两次平行实验)。而本文重组表达的spy HasB比活力是Dougherty等表达的spy HasB的3倍。eco HasB和spy HasB的比活力高于海洋真菌草茎点霉YS4108[17],鞘氨醇单胞菌[18]和超嗜热古菌-冰岛热棒菌[16]的UDP-葡萄糖脱氢酶的比活力。两者的酶学性质比较分析表明,spy HasB粗酶和纯酶的比活力远远高于eco HasB(图2),但是在大肠杆菌中的表达量不如eco HasB。通过大肠杆菌的稀有密码子分析发现,spyhasB基因中含有大量的稀有密码子,可以通过密码子优化提高spy HasB的表达量,提高spy HasB的胞内比活。
UGDH是HA合成的关键酶,对HA的生产有重要影响。在HA生产的过程中,稳定性好、酶活力高的UGDH能提高HA的产量。HA生物转化过程中,Glc和NAG是HA积累的原料,当NAG浓度为0时,pBPAEB/BW 2513和pBPASB/BW 25113HA的产量分别为0.7和0.9 g/L,添加20 mmol/LNAG之后产量提高到1.2和1.5 g/L (图6C),这是因为在大肠杆菌中,通过Glc合成UDP-NAG需要经过复杂的过程,同时与HA的另一个前体物质UDP-GlcA的合成存在竞争关系[12]。当Glc、NAG过量时,大肠杆菌转化液中会大量产酸,从而导致环境中pH降低,抑制HA的积累(图6D),pH对HA的转化表明:在pH 7−8时,HA产量高,在pH<7时,HA可能降解。温度对HA的转化表明:在33℃,HA的产量最高。这是因为pBPAEB/BW 2513、pBPASB/BW 25113的生长和UDPG的酶活性对HA产量均有影响,并且大肠杆菌的最适生长温度是37℃,UDPG的最适反应温度是30℃,且在37℃以下更稳定(图4)。有关研究表明不同的表面活性剂对HA转化有不同的影响[28]。表面活性剂对HA的转化表明:高浓度离子型的CTAB、SDS对HA的积累起到抑制作用,这和温琦等[29]的结果是一致的。Tween80对HA的积累有促进作用,这可能是因为改变了细胞外基质的状态,细胞表面结合的HA降解[29]。
本文通过生物转化重组菌株pBPAEB/BW 2513和pBPASB/BW 25113 HA产量达到了1.5和1.7g/L。与M ao等[13]在大肠杆菌JM 109中摇瓶发酵生产的HA(0.5 g/L)相比提高了3倍;与Yu等[12]在大肠杆菌中发酵生产的HA(0.19g/L)相比提高了近7倍;与Prasad等[9]在重组乳酸菌中发酵生产的HA(1.8g/L)相差不大;与Widner等[10]在重组枯草芽胞杆菌(1 g/L),Kotra等[7]在兽医链球菌(1.38g/L),Naoki等[11]在嗜热链球菌(1.2 g/L)产生的HA相比,产量有不同程度的提高。在HasA和HasB共表达蛋白过程中采用了阿拉伯糖诱导的弱启动子,避免UGDH表达过快形成包涵体;通过采用生物转化的方法生产HA,将细菌培养、蛋白表达和HA转化分步进行,以降低对菌体生长的抑制。本研究表明利用大肠杆菌作为宿主菌生产HA具有一定的优势,并且为运用生物转化工艺大规模生产HA提供了帮助。
REFERENCES
[1]Prasad SB,Ramachandran KB,Jayaraman G. Transcription analysis of hyaluronan biosynthesis genes in Streptococcus zooepidemicus and metabolically engineered Lactococcus lactis.Appl M icrobiol Biot,2012,94(6):1593–1607.
[2]Volpi N,Schiller J,Stern R,et al.Role,metabolism, chem ical modifications and appli-cations of hyaluronan.Curr Med Chem,2009,16:1718–1745.
[3]Necas J,Bartosikova L,Brauner P,et al. Hyaluronic acid(hyaluronan):a review.Vet Med, 2008,53:397–411.
[4]Chong BF,Blank LM,M cLaughin R,et al. M icrobial hyaluronic acid production.Appl M icrobiol Biot,2005,66:341–351.
[5]W idner B,Behr R,Dollen SV,et al.Hyaluronic acid production in Bacillus subtilis.Appl Environ M icrobiol,2005,77:3747–3752.
[6]Liu LY,Liu YF,Li JH,et al.M icrobial production of hyaluronic acid:current state,challenges,and perspectives.M icrob Cell Fact,2011,10:99.
[7]Kotra SR,Venkateswarulu TC,John BD.Cost effective media optim ization for the enhanced production of hyaluronic acid using a mutant strain Streptococcus zooepidemicus 3523–7:a statistical approach.Int J Adv Sci Technol,2013,60:83–96.
[8]Mao ZC,Chen RRZ.Recombinant synthesis of hyaluronan by Agrobacterium sp..Biotechnol Progr, 2007,23(5):1038–1042.
[9]Prasad SB,Jayaraman G,Ramachandran KB. Hyaluronic acid production is enhanced by the additional co-expression of UDP-glucose pyrophosphorylase in Lactococcus lactis.Appl M icrobiol Biot.2010,86:273–283.
[10]W idner B,Behr R,Von Dollen S.Hyaluronic acid production in Bacillus subtilis.Appl Environ M icrobiol,2005,71:3747–3752.
[11]Naoki I,Masaki S,Toshiro S,et al.Hyaluronic acid production by recombinant Streptococcus thermophilus.J Biosci Bioeng,2011,111(6): 665–670.
[12]Yu HM,Stephanopoulos G.M etabolic engineering of Escherichia coli for biosynthesis of hyaluronic acid.Metab Eng,2008,10:24–32.
[13]Mao ZC,Shin HD,Chen R.A recombinant E.coli bioprocess for hyaluronan synthesis.Appl M icrobiol Biot,2009(84):63–69.
[14]Baneyx F.Recombinant protein expression in Escherichia coli.Curr Opin Biotech,1999,10: 411–421.
[15]Campbell RE,Mosimann SC,De Rijn I van,et al. The first structure of UDP-glucose dehydro-genase reveals the catalytic residues necessary for the two-fold oxidation.Biochem istry,2000,39:7012–7023.
[16]Satomura TK,Kusum i K,Ohshima T,et al. Identification and characterization of UDP-glucose dehydrogenase from the hyperthermophilic archaon, Pyrobaculum islandicum.Biosci Biotechnol Biochem, 2011,75(10):2049–2051.
[17]Zhou T,Song Y,Feng MQ,et al.Cloning, expression and biochem ical characterization of UDP-glucse 6-dehydrogenase,a key enzyme in the biosynthesis of an antitumor polysaccharide from the marine fungus Phoma herbarum YS4108. Process Biochem,2011,46:2263–2268.
[18]Granja AT,Popescu A,M arques AR,et al. Biochem ical characterization and phylogenetic analysis of UDP-glucose dehydrogenase from the gellan gum producer Sphingomonas elodea ATCC 31461.Appl M icrobiol Biot,2007,76(6): 1319–1327.
[19]Chen YH,Qian Y,Hou YG,et al.Cloning,expression and enzyme activity assay of UDP-glucose dehydrogenase in Escherichia coli. Biot Bull,2013(7):136–143(in Chinese).陈奕涵,钱悦,侯永泰,等.大肠杆菌UDP-葡萄糖脱氢酶基因的克隆、表达及酶活性测定.生物技术通报,2013(7):136–143.
[20]Dougherty BA,van de Rijn I.Molecular characterization of hasB from an operon required for hyaluronic acid synthesis in group A Streptococci.demonstration of UDP-glucose dehydrogenase activity.J Biol Chem,1993, 268(10):7118–7124.
[21]Sheng JZ,Ling PX,Zhu XQ,et al.Use of induction promoters to regulate hyaluronan synthase and UDP-glucose-6-dehydrogenase of Streptococcus zooepidem icus expression in Lactococcus lactis:a case study of the regulation mechanism of hyaluronic acid polymer.J Appl M icrobiol,2009,107(1):136–144.
[22]Studier FW.Protein production by auto-induction in high-density shaking cultures.Protein Expres Purif,2005,41:207–234.
[23]Sambrook J,W illiam D,Russell.Molecular Cloning:A Laboratory Manual.3rd ed.New York: Cold Spring Harbor Laboratory Press,2001:99–125.
[24]Chung,JY,Zhang,Y,Adler,B.The capsule biosynthetic locus of Pasteurella multocida A. FEMS M icrobiol Lett,1996,166:289–296.
[25]Wen C,Yu HM,Sun YP,et al.Efficient quantification of hyaluronic acid in fermentation broth by modified CTAB method.Chin Biotechnol, 2010,30(2):89–93(in Chinese).文程,于慧敏,孙云鹏,等.高效测定发酵液中透明质酸含量的改良CTAB浊度法.中国生物工程杂志,2010,30(2):89–93.
[26]Blanch M,Vicente IC,Piñón D.Sugarcane glycoproteins are required to the production of an active UDP-glucose dehydrogenase by Xanthomonas albilineans.Ann M icrobiol,2007, 57(2):217–221.
[27]Clarkin CE,A llen S,Wheeler-Jones CP,et al. Reduced chondrogenic matrix accumulation by 4-methylumbelliferone reveals the potential for selective targeting of UDP-glucose dehydrogenase. Matrix Biol,2011,30(3):163–168.
[28]Chen RX.Chem istry and Applied of Surfactant. Beijing:Textile Industry Press,1990:41(in Chinese).陈荣圻.表面活性剂化学与应用.北京:纺织工业出版社,1990:41.
[29]Wen Q,Liu DR,Chen J,et al.Enhancement of hyaluronic acid production by Streptococcus zooepidemicus H24 through supplement of CTAB. Chem Ind Eng Prog,2006,25(9):1089–1094(in Chinese).温琦,刘登如,陈坚,等.添加表面活性剂促进兽疫链球菌高产透明质酸.化工进展,2006, 25(9):1089–1094.
(本文责编 郝丽芳)
Effects of two UDP-glucose dehydrogenases on hyaluronic acid biotransformation
Donghui Guo1,Jian Han2,Weifeng Liu2,Zhenzhou Fu2,Qizhong Zhu1,and Yong Tao2
1 Marine College,Shandong University,Weihai 264209,Shandong,China 2 Institute of Microbiology,Chinese Academy of Sciences,Beijing 100101,China
We amplified genes encoding UDP-glucose dehydrogenase,ecohasB from Escherichia coli and spyhasB fromStreptococcus pyogenes.Both ecohasB and spyhasB were inserted into T7 expression vector pRX2to construct recombinant plasm ids pRXEB and pRXSB,and to express in E.coli BL21(DE3).A fter nickel column purification of UDP-glucose dehydrogenases,the enzymes were characterized.The optimum reaction condition of spy HasB was at 30℃and pH 10.The specific activity reached 12.2 U/mg under optimum condition.The optimum reaction condition of eco HasB was at 30℃and pH 9.Its specific activity reached 5.55 U/mg under optimum condition.The pmuhasA gene encoding hyaluronic acid synthase was amplified from Pasteurella multocida and ligated w ith ecohasB and spyhasB to construct the coexpression vectors pBPAEB and pBPASB,respectively.The co-expression vectors were transformed into E.coli BW 25113. Hyaluronic acid(HA)was produced by biotransformation and the conditions were optim ized.When recombinant strains were used to produce hyaluronic acid,the higher the activity of UDP-glucose dehydrogenase was,the better its stability was,and the higher the HA production could reach.Under the optimal conditions,the yields of HA produced by pBPAEB/BW 25113 and pBPASB/BW 25113 in shake flasks were 1.52 and 1.70 g/L,respectively,and the production increased more than 2−3 folds as previously reported.
UDP-glucose dehydrogenase,enzyme characterization,hyaluronic acid,biotransformation
March 10,2014;Accep ted:May 5,2014
郭东会,韩剑,刘伟丰,等.两种UDP-葡萄糖脱氢酶对透明质酸生物转化的影响.生物工程学报,2014,30(11):1691−1700.
Guo DH,Han J,Liu WF,et al.Effects of two UDP-glucose dehydrogenases on hyaluronic acid biotransformation.Chin J Biotech,2014,30(11):1691−1700.
Suppo rted by:The Second Innovation Fund of“Industrial M icrobial Genomics Modification and Application”,Institute of M icrobiology,CAS Co rrespond ing au tho r:Qizhong Zhu.Tel:+86-631-5688660;E-mail:hzzqz@sdu.edu.cn Yong Tao.Tel:+86-10-64807419;E-mail:taoyong@im.ac.cn
中国科学院微生物研究所工业微生物组学改造及应用创新培育基金“第二批”资助。
