HLA-B*5801基因型与别嘌呤醇过敏反应
2014-03-21综述胡伟新审校
李 康 综述 胡伟新 审校
别嘌呤醇广泛用于痛风、高尿酸血症,包括慢性肾脏病伴高尿酸血症的治疗,但0.1%~0.4%的患者服药后会出现严重皮肤过敏反应[1,2]。尽管其发生率低,但死亡率高。
近年来,且由于肥胖、肾功能不全及高血压发病率逐年上升,高尿酸血症及痛风的发病率也随之上升,因此大量使用别嘌呤醇,可能导致严重皮肤过敏反应甚至死亡的发生率升高。故明确别嘌呤醇过敏反应的风险因素,寻找预测别嘌呤醇过敏反应的标记物显得尤为重要。近来研究发现HLA-B*5801基因型与别嘌呤醇诱导的严重皮肤过敏反应密切相关[2],最新的美国临床药理学治疗指南[3]也提出有必要在口服别嘌呤醇之前检测患者HLA-B*5801基因型,而该基因型在发生过敏反应的亚洲人群中阳性率更高,因此更有必要检测。同时研究还发现别嘌呤醇剂量、肾功能不全及利尿剂的合用等也是别嘌呤醇诱导的皮肤过敏反应的风险因素。
别嘌呤醇过敏反应的临床表现
约2%服别嘌呤醇的患者临床出现轻重不一的皮肤过敏反应[1],从轻度的斑丘疹(MPE)到严重皮肤过敏反应(SCARs)。其中MPE主要表现为对称性的皮肤红斑或丘疹,通常不累及黏膜。而严重皮肤过敏反应相对罕见,发生率约0.1%~0.4%[1,2],包括药物高敏反应综合征(DRESS),中毒性表皮坏死松解症(TEN)和Stevens-Johnson综合征(SJS)。其中SJS和TEN被认为是同一种疾病发展的不同阶段,表现为皮肤或黏膜上累及不同比例体表面积的快速发展的斑疹和靶样皮损,SJS较为局限,累及<10%的体表面积,而TEN更为严重,累及≥30%的体表面积,SJS/TEN介于二者之间,累及10%~30%的体表面积。DRESS是指除皮疹(包括TEN,SJS,多形性红斑、弥漫性斑丘疹或剥脱性皮炎)外,还常伴发热、淋巴结肿大及血液系统异常(如嗜酸性粒细胞增多、非典型性淋巴细胞增多),并导致及以下至少一种疾病:急性肝细胞损伤、肺炎、心包炎及肾炎。既往研究显示SJS、TEN和DRESS的死亡率分别为1%~5%、30%和10%[4]。别嘌呤醇的广泛应用及SCARs的高死亡率提示,寻找预测过敏反应发生的标记物非常必要。
HLA-B*5801基因型与别嘌呤醇过敏反应发病机制
既往有多项研究对别嘌呤醇过敏反应机制进行了探讨。Naisbitt等[5]的研究认为别嘌呤醇-SJS/TEN是一种T细胞介导的免疫反应:HLA-I类分子识别别嘌呤醇,并诱导了CD8+T淋巴细胞的扩增。Yun等[6]的研究也发现别嘌呤醇过敏反应是一种次黄嘌呤(别嘌呤醇代谢产物)特异性的T细胞免疫反应。其通过对别嘌呤醇过敏反应患者的外周血标本进行淋巴细胞转化实验,发现HLA-B*5801基因和高血次黄嘌呤浓度均为别嘌呤醇特异性T淋巴细胞反应的影响因素。别嘌呤醇与HLA-B*5801密切关系的发现高度提示,别嘌呤醇过敏反应可能是一种HLA限制性的T细胞免疫反应,由于HLA-B基因是人类基因组中最具多形性的基因,不同的等位基因编码的HLA-B分子可能对别嘌呤醇的亲和力不同,而高亲和力的HLA-B分子更易与别嘌呤醇结合从而引起过敏反应。Chung等[7]已经证实与卡马西平强烈相关的HLA-B*1502与卡马西平中的5种多肽存在高亲和力,是否HLA-B*5801也对别嘌呤醇中的一些多肽有高亲和力仍有待探索。
关于别嘌呤醇、HLA分子及T细胞受体之间的相互关系存在三种假说。(1)半抗原假说:最常用于解释迟发性皮肤过敏反应,指药物与T细胞受体及HLA分子非共价性结合,进而诱发T细胞免疫反应。(2)半抗原假说:药物/药物代谢产物为小分子物质,不能直接诱导T细胞免疫反应,而是作为半抗原,与蛋白质或多肽共价结合后被提呈给T细胞,激活T细胞。(3)最近研究发现:与HLA-B*5701密切相关的阿巴卡韦与HLA-B*5701肽结合凹槽底部非共价键结合,导致B*5701 多肽亲和特性发生明显的变化,尤其是对P9位氨基酸残基的选择性产生了显著影响,改变了B*5701 的抗原提呈特性,并诱导出一类全新抗原肽,从而激发特异T细胞的自身免疫应答,进而导致药物过敏反应的发生[8],是否别嘌呤醇也改变了HLA-B*5801多肽亲和特性导致过敏反应仍有待证实。别嘌呤醇-SCARs发生的大面积皮肤坏死目前认为主要是由细胞毒蛋白:Fas-FasL、穿孔素/颗粒酶B、颗粒溶素介导。
迄今为止,HLA-B*5801基因如何在别嘌呤醇过敏反应中发挥作用仍有待证实及阐明。
基因与别嘌呤醇过敏反应相关性
HLA-B*5801基因型与别嘌呤醇过敏反应相关性1989年,Chan和Tan[9]首次对中国南方人群中别嘌呤醇过敏反应与HLA基因型之间的关系进行了探索,结果显示HLA-B17/BW58与别嘌呤醇过敏反应密切相关。此后Hung等[10]对台湾汉族人群中51例别嘌呤醇-SCARs患者进行了基因关联分析,对照组为135例别嘌呤醇耐受的患者和93例健康受试者,首次发现了HLA-B*5801基因与别嘌呤醇-SCARs之间的密切关系:别嘌呤醇-SCARs组患者均携带HLA-B*5801基因,仅20例(15%)的耐受患者(OR 580,95%CI 34.4~9 780.9,Pc 4.7×10-24)及19例(20%)的健康受试者(OR 393.5,95%CI 23.2~6 665.26,Pc 8.1× 10-18)携带HLA-B*5801基因(表1)[10-19]。之后相继开展多项研究,其中亚洲及欧洲多个国家均报道了HLA-B*5801与别嘌呤醇-SCARs密切相关(表1)[10-19]。然而,这些观察性研究均存在样本量小,缺乏足够说服力的局限性。最近的一篇Meta分析[11],回顾分析了2011年6月之前收录于MEDLINE,Pre-MEDLINE,Cochrane Library,EMBASE等数据库的相关研究,结果显示,与别嘌呤醇耐受患者(OR 96.60,95%CI 24.49~381.00,P<0.001)或普通人群(OR 79.28,95%CI 41.51~151.35,P<0.001)相比,SJS/TEN患者与HLA-B*5801基因的关系均存在显著性差异。HLA-B*5801与别嘌呤醇-SCARs的相关程度似乎与HLA-B*5801基因在不同人群中的频率相关,频率越高,关系越密切。在高HLA-B*5801基因频率的人群中,如中国台湾汉族人群(10.4%)[10],韩国(12.2%)[13],泰国(8.6%)[14],这种关系更强烈,而低HLA-B*5801基因频率的日本(0.6%)[16]和欧洲(0.8%)[17]人群中,这种关系则相对较弱。然而,也有少数研究不支持这种猜想,意大利Atzori等[18]及葡萄牙Gonçalo等[19]的研究也显示了HLA-B*5801与别嘌呤醇诱导的皮肤过敏反应之间存在的强烈关系。
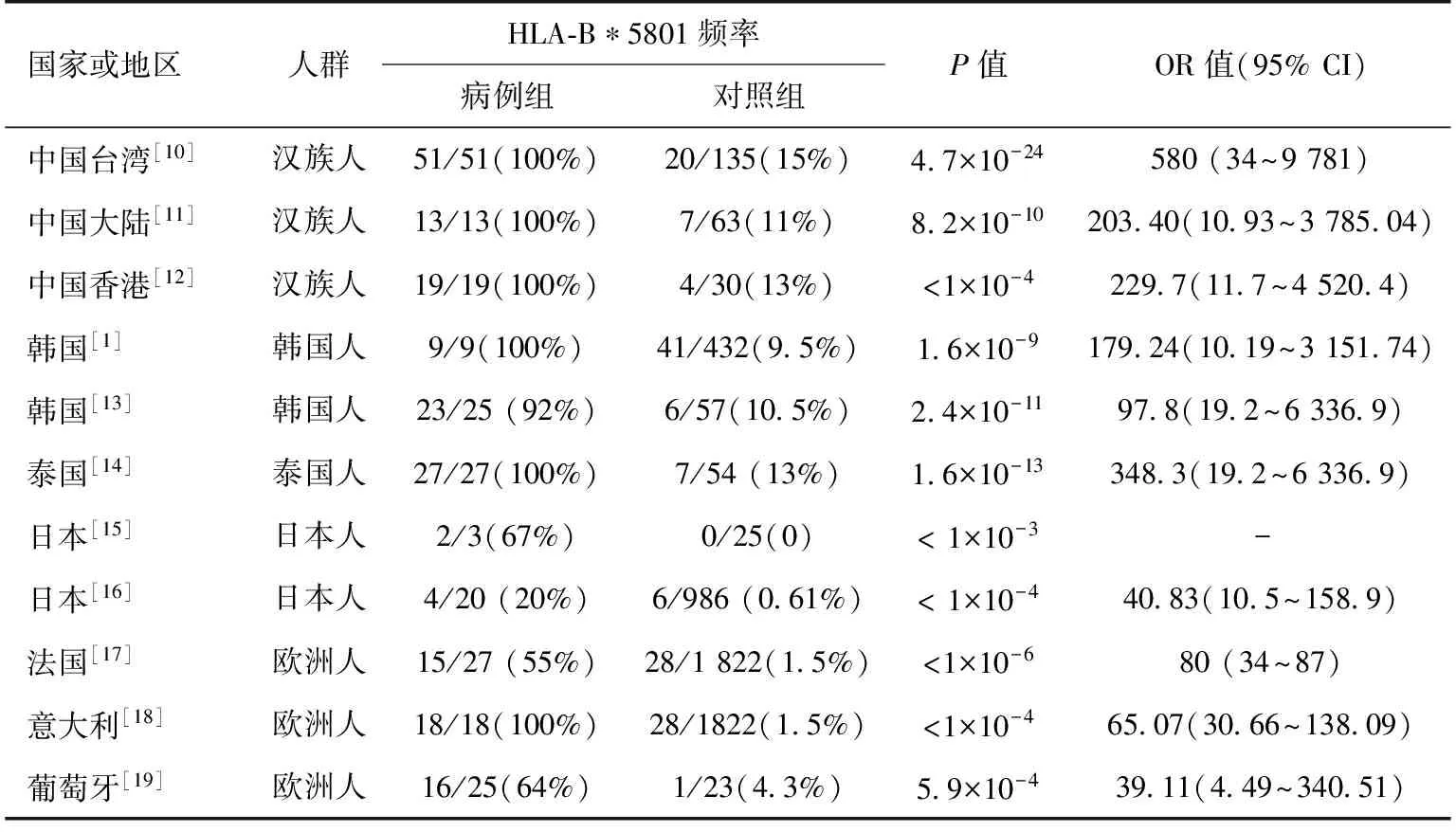
表1 不同人群中HLA-B*5801与严重别嘌呤醇过敏反应之间关系
近来一些研究也显示了HLA-B*5801与轻度别嘌呤醇过敏反应之间的密切关系。Cao等[11]对中国南部汉族人群中22例轻度别嘌呤醇过敏反应(MPE)患者进行了基因关联分析,对照组为63例别嘌呤醇耐受患者和572例中国汉族人(来自dbMHC database),结果显示,别嘌呤醇-MPE组患者均携带HLA-B*5801基因,仅11%(7/63)的别嘌呤醇耐受患者(OR 339.00,95%CI 18.58~6 186.39,Pc 9.21×10-14)及13.99%(80/572)的中国汉族人(OR 275.31,95%CI 16.54~4 583.53,Pc 3.74×10-24)携带有HLA-B*5801基因。Niihara等[15]对日本人群中4例轻度别嘌呤醇过敏反应患者基因关联分析的研究也显示,2例轻度别嘌呤醇过敏反应患者携带HLA-B*5801基因,无一例别嘌呤醇耐受患者携带有HLA-B*5801基因。中国香港[12]、韩国[1]及澳大利亚[21]别嘌呤醇轻度过敏反应患者中无一例HLA-B*5801基因阳性者,葡萄牙患者[19]中其阳性率仅为17%较别嘌呤醇耐受组无显著性差异(表2)。仍有待进一步大样本多中心的研究来明确HLA-B*5801 与轻度别嘌呤醇轻度过敏反应之间的关系。
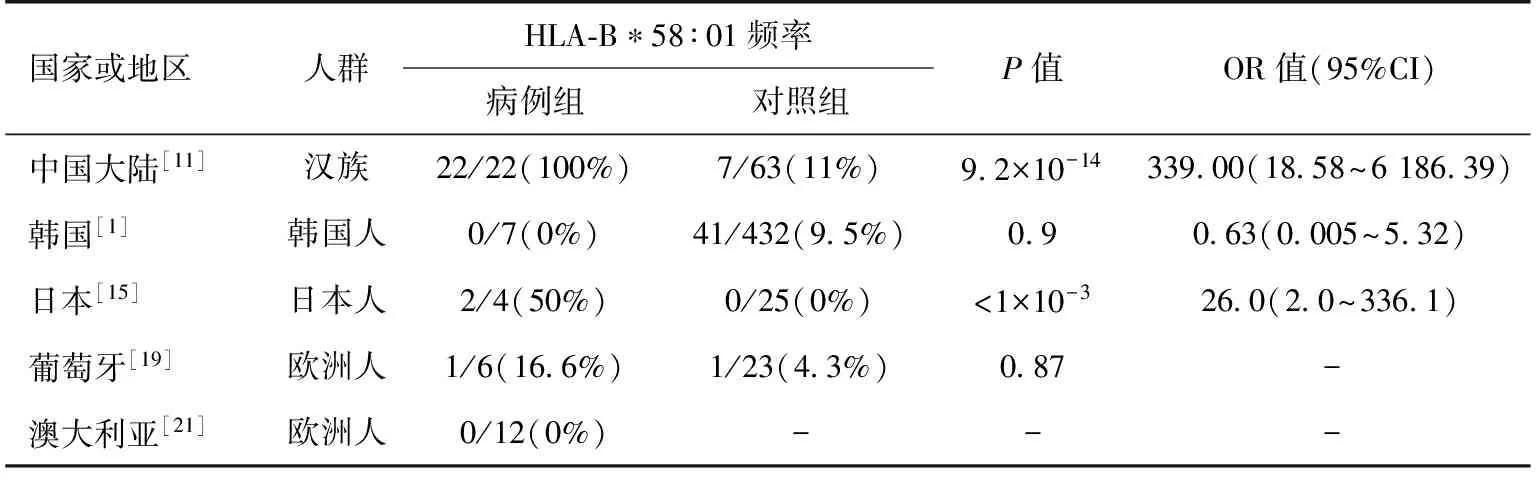
表2 不同人群中HLA-B*5801与轻度别嘌呤醇过敏反应之间的关系
其他基因与别嘌呤醇过敏反应的相关性Hung等[10]的研究发现,所有发生别嘌呤醇-SCARs的患者均携带HLA-B*5801基因,然而少数别嘌呤醇耐受组患者也携带该基因,从而得出HLA-B*5801可能是别嘌呤醇-SCARs的必要条件,却不是充分条件。然而这个猜想遭到了Lonjou等[17]的质疑,他们对欧洲人群中27例别嘌呤醇-SCARs患者进行了基因关联分析发现,仅55%的别嘌呤醇-SJS/TEN患者携带HLA-B*5801基因,得出该基因既不是别嘌呤醇-SCARs的充分条件也不是必要条件。因此有理由猜测:别嘌呤醇过敏反应的发生可能是多因素相关的,除HLA-B*5801基因外,可能还有其他因素影响过敏反应的发生。Hung等[10]对台湾人群的研究发现,在51例别嘌呤醇-SCARs的患者中有21例患者携带HLA-B*5801扩展的单倍体(HLA-A*3303-Cw*0302-B*5801-DRB1*0301),而135例别嘌呤醇耐受患者中仅9例携带有该单倍体(OR 9.8, Pc 0.039),据此该作者猜想,或许中国汉族人群HLA-B*5801和别嘌呤醇-SCARs的强烈关系与HLA-B*5801基因同MCH区域其他基因的连锁不平衡相关。Tohkin等[22]对日本别嘌呤醇-SJS/TEN患者进行的一项全基因组关联分析得出,在日本人群中6号染色体上的21项遗传变异与别嘌呤醇-SJS/TEN密切相关,这其中位于BAT1的rs2734583、 位于HCP5的rs3094011、位于MICC的GA005234及位于PSORS1C1的rs9263726与别嘌呤醇-SJS/TEN关系最强烈,同时也发现rs9263726与HLA-B*5801基因呈绝对连锁不平衡关系。Génin等[23]对欧洲别嘌呤醇-SJS/TEN患者进行的一项全基因组关联分析也发现6个SNP (rs2844665、 rs3815087、 rs3130931、 rs3130501、rs3094188和rs9469003)与别嘌呤醇-SJS/TEN 密切相关,而其中rs9469003关系最为密切,该项研究也显示6个SNP之间存在一定程度的连锁不平衡关系,这6个SNP形成的单倍体与别嘌呤醇-SJS/TEN的相关性最强,且与HLA-B*5801基因呈连锁不平衡关系。
影响别嘌呤醇过敏反应的其他因素
别嘌呤醇剂量除基因因素外,一些研究者也发现别嘌呤醇的剂量可能与别嘌呤醇过敏反应密切相关。Hande等[24]发现,肾功能不全患者,300~400 mg/d的剂量将会增加别嘌呤醇过敏反应的风险。有研究显示别嘌呤醇的服用剂量越高,别嘌呤醇过敏反应的发生率越高[25]。Halevy等[26]的研究发现,与低剂量组相比,≥200 mg/d的别嘌呤醇剂量显著增加了SJS和TEN的发病率(OR 36,95%CI 17~76)。 故别嘌呤醇的起始剂量可能是别嘌呤醇过敏反应的一个重要风险因素,最近由Yun等[27]对别嘌呤醇过敏反应患者的外周血标本行淋巴细胞转化实验发现,血液中别嘌呤醇代谢产物次黄嘌呤浓度越高,T细胞反应越强烈,进一步证实了别嘌呤醇剂量可能是其过敏反应的风险因素的猜想。然而,先予低的别嘌呤醇起始剂量,并逐渐增加其剂量,能否降低别嘌呤醇过敏反应的发生仍有待进一步探索。
也有许多研究显示别嘌呤醇的剂量可能与别嘌呤醇过敏反应之间无必然联系。Perez-Ruiz等[28]、Reinders等[29]的研究均显示300 mg/d的别嘌呤醇剂量仍然是安全和可耐受的。一些研究也发现[11,12],别嘌呤醇过敏组与耐受组相比,患者服用的别嘌呤醇剂量无显著性差异;低的别嘌呤醇剂量并未降低别嘌呤醇过敏反应的发生率。Emmerson[30]认为别嘌呤醇剂量的降低不仅没有降低皮肤过敏反应的发生率,而且影响了其降血尿酸的效果,进而影响了痛风等疾病的有效控制。为了得到一致的结论,Ramasamy等[2]进行的一项Meta分析回顾了从1950年1月至2012年12月MEDLINE和EMBASE等数据库收纳的所有相关研究,得出别嘌呤醇>200 mg/d的与别嘌呤醇过敏反应的发生无关。
Hande等[24]的研究显示别嘌呤醇的代谢产物次黄嘌呤的清除率与肌酐清除率成正比,肾功能不全患者长期大剂量(300 mg/d)别嘌呤醇的服用将导致血清次黄嘌呤浓度的稳定升高,建议根据血肌酐清除率调整别嘌呤醇服用剂量。目前尚无研究证实高于推荐维持剂量(根据肌酐清除率计算)的别嘌呤醇的应用是否会增加皮肤过敏反应的风险。进一步的大样本多中心高质量的研究仍有待进行。
肾功能不全高尿酸血症、痛风患者常合并肾功能不全、高血压、糖尿病和心衰等疾病。多项研究显示肾功能不全是别嘌呤醇诱导的严重皮肤过敏反应的一个风险因素。Hung等[10]对中国台湾汉族人群中别嘌呤醇过敏组的肾功能不全发生率进行了分析,发现与对照组相比,慢性肾功能不全在别嘌呤醇过敏组发生率更高(55%vs21%,P<0.01),之后Cao等[11]、Chiu等[12]针对中国汉族人群的研究也得到了一致的结论。 Jung等[1]对韩国人群中肾功能不全患者别嘌呤醇过敏反应的发生率进行了分析,结果显示,与普通人群相比,肾功能不全患者别嘌呤醇过敏反应的发生率明显升高(2%vs21%,P<0.01),Hande等[24]也得出一致结论。上述研究结果均提示肾功能不全可能是别嘌呤醇过敏反应的风险因素,但其原因是否与肾功能不全延长了次黄嘌呤的半衰期有关,仍有待进一步研究证实。然而,也有研究显示别嘌呤醇过敏组慢性肾功能不全的发生率与对照组无显著性差异[14]。因此,仍需要进一步更大样本的研究来明确肾功能不全与别嘌呤醇过敏反应之间的关系。
药物由于高尿酸血症或痛风患者常合并其他疾病,需同时口服其他药物。研究发现合用噻嗪类利尿剂可能增加别嘌呤醇过敏反应的风险。
de Vries等[31]研究发现,在10%的健康受试者中,长期使用高剂量噻嗪类利尿剂(如氢氯噻嗪 50 mg/d)可降低次黄嘌呤清除率。进而提出假设,别嘌呤醇与噻嗪类利尿剂的合用将会增加别嘌呤醇过敏反应的风险。但也有研究显示噻嗪类利尿剂的使用频率在别嘌呤醇过敏组及对照组之间无显著性差异,噻嗪类利尿剂的合用似乎不会增加别嘌呤醇过敏反应的风险[1,10,12]。然而这些均为小样本研究,仍有待更大的样本研究出现,得出更有力的证据。
检测HLA-B*5801对别嘌呤醇过敏反应的预测价值
HLA-B*5801与别嘌呤醇-SCARs之间的密切关系提示其或许可作为一项基因标记物,用于预测别嘌呤醇-SCARs的发生。然而,既往针对中国汉族人群[11]及泰国人群的研究显示[14],HLA-B*5801对别嘌呤醇-SCARs的阳性预测值<1.5%,阴性预测值为100%。Jung等[1]针对韩国肾功能不全患者的研究显示 HLA-B*5801对别嘌呤醇-SCARs的阳性预测值为18%,阴性预测值为98.24%。低的阳性预测值意味着即使HLA-B*5801检测阳性,仍有大部分患者并不会发生SCARs。Lee等[21]认为,在东南亚人群中,HLA-B*5801的低阳性预测值可能与别嘌呤醇-SCARs的发病率低,但HLA-B*5801的基因频率相对较高有关。尽管HLA-B*5801对别嘌呤醇-SCARs的阳性预测值偏低,Hershfield等2012年发表的美国临床药理学指南[3]仍然建议对HLA-B*5801检测阳性的患者考虑换用其他药物治疗,以避免别嘌呤醇-SCARs。
尽管阳性预测率偏低,但HLA-B*5801的阴性预测值却非常高。因此,在中国汉族、泰国及韩国人群中,HLA-B*5801检测阴性可用于排除患者发生别嘌呤醇-SCARs的可能性。但对于欧洲人群,只有约55%的别嘌呤醇-SCARs患者其HLA-B*5801检测阳性,故HLA-B*5801检测阴性不能排除发生别嘌呤醇-SCARs的可能性。目前,HLA-B*5801基因型的检测可能仅适用于亚洲人群,准备进行别嘌呤醇治疗并希望通过此项检测排除其发生SCARs可能性的患者。新的别嘌呤醇-SCARs的风险因素(如基因等)仍有待探索,将来可在HLA-B*5801携带者中进一步筛选出更有可能发生SCARs的患者。此外,由于常规的HLA-B*5801基因检测方法存在成本高、耗时长、对仪器及实验技术要求高的缺点,限制了HLA-B*5801检测的广泛应用,仍有必要探索新的低成本、简单、快速的检测方法。
结 论
别嘌呤醇过敏反应,尤其是严重过敏反应罕见却非常严重,甚至危及生命,HLA-B*5801与别嘌呤醇严重过敏反应之间密切相关,同时还受其他多种因素影响,包括别嘌呤醇剂量、肾功能状态、是否使用噻嗪类利尿剂等。HLA-B*5801对别嘌呤醇过敏反应具有较高的阴性预测值,但阳性预测值有待临床进一步研究。我国痛风、高尿酸血症、慢性肾脏病合并高尿酸血症的患者,在接受别嘌呤醇治疗前应常规检测HLA-B*5801,阴性患者可排除发生严重过敏反应的可能。由于别嘌呤醇过敏反应的高致死率,新的预测方法仍有待探索。
1Jung JW,Song WJ,Kim YS,et al.HLA-B58 can help the clinical decision on starting allopurinol in patients with chronic renalinsufficiency.Nephrol Dial Transplant,2011,26(11):3567-3572.
2Ramasamy SN,Korb-Wells CS,Kannangara DR,et al.Allopurinol hypersensitivity:a systematic review of all published cases,1950-2012.Drug Saf,2013,36(10):953-980.
3Hershfield MS,Callaghan JT,Tassaneeyakul W,et al. Clinical Pharmacogenetics Implementation Consortium guidelines for human leukocyte antigenB genotype and allopurinol dosing.Clin Pharmacol Ther,2013,93(2):153-158.
4Roujeau JC,Stern RS.Severe adverse cutaneous reactions to drugs.N Engl J Med,1994,331(19):1272-1285.
5Naisbitt DJ,Britschgi M,Wong G,et al.Hypersensitivity reactions to carbamazepine:characterization of the specificity,phenotype,and cytokine profile of drug-specific T cell clones.Mol Pharmacol,2003,63(3):732-741.
6Yun J,Mattsson J,Schnyder K,et al.Allopurinol hypersensitivity is primarily mediated by dose- dependent oxypurinol-specific T cell response.Clin Exp Allergy,2013,43(11):1246-1255.
7Chung WH,Hung SI,Hong HS,et al.Medical genetics:a marker for Stevens-Johnson syndrome.Nature,2004,428(6982):486.
8Illing PT,Vivian JP,Dudek NL,et al. Immune self-reactivity triggered by drug-modified HLA peptide repertoire.Nature,2012,486(7404):554-558.
9Chan SH,Tan T.HLA and allopurinol drug eruption.Dermatologica,1989,179(1):32-33.
10 Hung SI,Chung WH,Liou LB,et al.HLA-B*5801 allele as a genetic marker for severe cutaneous adverse reactions caused by allopurinol.Proc Natl Acad Sci U S A,2005,102(11):4134-4139.
11 Cao ZH,Wei ZY,Zhu QY,et al.HLA-B*58∶ 01 allele is associated with augmented risk for both mild and severe cutaneous adversereactions induced by allopurinol in Han Chinese.Pharmacogenomics,2012,13(10):1193-1201.
12 Chiu ML,Hu M,Ng MH,et al.Association between HLA-B*58∶ 01 allele and severe cutaneous adverse reactions with allopurinol in Han Chinesein Hong Kong.Br J Dermatol,2012,167(1):44-49.
13 Kang HR,Jee YK,Kim YS,et al.Positive and negative associations of HLA class I alleles with allopurinol-induced SCARs in Koreans.Pharmacogenet Genomics,2011,21(5):303-307.
14 Tassaneeyakul W,Jantararoungtong T,Chen P,et al.Strong association between HLA-B*5801 and allopurinol-induced Stevens-Johnson syndrome and toxic epidermal necrolysis in a Thai population.Pharmacogenet Genomics,2009,19(9):704-709.
15 Niihara H,Kaneko S,Ito T,et al.HLA-B*58∶ 01 strongly associates with allopurinol-induced adverse drug reactions in a Japanese sample population.J Dermatol Sci,2013,71(2):150-152.
16 Kaniwa N,Saito Y,Aihara M,et al. HLA-B locus in Japanese patients with anti-epileptics and allopurinol-related Stevens-Johnson syndrome and toxic epidermal necrolysis.Pharmacogenomics,2008,9(11):1617-1622.
17 Lonjou C,Borot N,Sekula P,et al.A European study of HLA-B in Stevens-Johnson syndrome and toxic epidermal necrolysis related to five high-risk drugs.Pharmacogenet Genomics,2008,18(2):99-107.
18 Atzori L,Pinna AL,Mantovani L,et al.Cutaneous adverse drug reactions to allopurinol:10 year observational survey of the dermatologydepartment-Cagliari University.J Eur Acad Dermatol Venereol,2012,26(11):1424-1430.
19 Gonçalo M,Coutinho I,Teixeira V,et al.HLA-B*58∶ 01 is a risk factor for allopurinol-induced DRESS and Stevens-Johnson syndrome/toxic epidermal necrolysis in a Portuguese population.Br J Dermatol,2013,169(3):660-665.
20 Zineh I,Mummaneni P,Lyndly J,et al. Allopurinol pharmacogenetics:assessment of potential clinical usefulness.Pharmacogenomics,2011,12(12):1741-1749.
21 Lee MH,Stocker SL,Anderson J,et al.Initiating allopurinol therapy:do we need to know the patient’s human leucocyte antigen status? Intern Med J,2012,42(4):411-416.
22 Tohkin M,Kaniwa N,Saito Y,et al.A whole-genome association study of major determinants for allopurinol-related Stevens-Johnson syndrome andtoxic epidermal necrolysis in Japanese patients.Pharmacogenomics J,2013,13(1):60-69.
23 Génin E,Schumacher M,Roujeau JC,et al.Genome-wide association study of Stevens-Johnson Syndrome and Toxic Epidermal Necrolysis in Europe.Orphanet J Rare Dis,2011,6:52.
24 Hande KR,Noone RM,Stone WJ.Severe allopurinol toxicity:description and guidelines for prevention in patients with renal insufficiency.Am J Med,1984,76(1):47-56.
25 Peterson GM,Boyle RR,Francis HW,et al.Dosage prescribing and plasma oxipurinol levels in patients receiving allopurinol therapy.Eur J Clin Pharmacol,1990,39(4):419-421.
26 Halevy S,Ghislain PD,Mockenhaupt M,et al.Allopurinol is the most common cuse of Stevens-Johnson syndrome and toxic epidermal necrolysis in Europe and Israel.J Am Acad Dermatol,2008,58(1):25-32.
27 Yun J,Mattsson J,Schnyder K,et al.Allopurinol hypersensitivity is primarily mediated by dose-dependent oxypurinol-specific T cell response.Clin Exp Allergy,2013,43(11):1246-1255.
28 Perez-Ruiz F,Alonso-Ruiz A,Calabozo M,et al.Efficacy of allopurinol and benzbromarone for the control of hyperuricaemia:a pathogenic approach to the treatment of primary chronic gout.Ann Rheum Dis,1998,57(9):545-549.
29 Reinders MK,Haagsma C,Jansen TL,et al.A randomized controlled trial on the efficacy and tolerability with dose escalation of allopurinol 300~600 mg/day versus benzbromarone 100~200 mg/day in patients with gout.Ann Rheum Dis,2009,68(6):892-897.
30 Emmerson BT.The management of gout.N Engl J Med,1996,334(7):445-451.
31 de Vries JX,Voss A,Ittensohn A,et al.Interaction of allopurinol and hydrochlorothiazide during prolonged oral administration of both drugs in normal subjects II.Kinetics of allopurinol,oxipurinol,and hydrochlorothiazide.Clin Investig,1994,72(12):1076-1081.
