重组白地霉脂肪酶催化菜籽油水解制备α-亚麻酸工艺的研究
2014-03-13付建红汪世娟吕豪豪王志勇
付建红 汪世娟 吕豪豪 白 希 王志勇
(新疆师范大学生命科学学院1,乌鲁木齐 830054)
(新疆师范大学化学化工学院2,乌鲁木齐 830054)
α-亚麻酸是人体必需的脂肪酸,不能在体内合成,必须从外界摄取。α-亚麻酸具有重要的生理作用和药用价值。它可通过链延长酶和脱氢酶的双重作用,转化为具有降血压、降血脂、抑制血小板凝聚和减少血栓形成等功效的EPA和DHA[1]。另外,α-亚麻酸还具有增强免疫力和抗炎作用、抑制癌症的发生和转移、保护视力和提高记忆力、抗氧化及延缓衰老等生理功能[2]。由于α-亚麻酸迄今不能人工合成,只能依赖于有限的自然资源,因此,进一步开发和探寻富含α-亚麻酸的自然资源,并深入研究α-亚麻酸的制取与纯化技术及其α-亚麻酸延伸产品,对促进农业产业化、农业资源高效利用具有重要意义。
菜籽油是以油菜的种子榨制所得的透明或半透明状的液体,是我国主要食用油之一,也是世界上第三大植物油。菜籽油中含有较多不饱和脂肪酸,其中α-亚麻酸质量分数达8%~10%,高于其他常见的食用油。新疆油菜种植面积达134.3万亩,菜籽油的产量相当可观,如因地制宜地利用菜籽油生产α-亚麻酸,对扩大菜籽油的利用价值以及油料资源的深加工利用具有广泛而深远的意义。
在α-亚麻酸的制备过程中油脂的水解尤为关键,油脂水解率的提高,将会为后续提高目标产物的得率奠定基础。传统的油脂水解工艺是采用高温高压或强酸强碱法,需要耐高压抗腐蚀设备,投资大,耗能多,环境污染严重,劳动条件差,而且不适用于热敏性油脂,如含多不饱和脂肪酸的油脂。酶法水解油脂则正好克服了上述缺点,而且具有选择性,可减少副反应,提高产品的质量和得率[3-4]。本试验所用的重组脂肪酶来源于白地霉,而白地霉脂肪酶水解菜籽油,可将甘油3个酯键上的不饱和脂肪酸优先释放出来[5],这对于菜籽油中α-亚麻酸释放是很有利的。目前,对紫苏籽油、亚麻籽油、花椒籽油、猕猴桃籽油及橡胶籽油中α-亚麻酸的富集研究已有文献报道[6-14],但利用重组脂肪酶对菜籽油中α-亚麻酸进行富集的研究鲜见报道。本研究利用微生物发酵技术大量制备的重组脂肪酶水解菜籽油制备α-亚麻酸,可最大化的降低生产成本,为获得较高含量的α-亚麻酸及菜籽油的进一步开发利用提供依据。
1 材料与方法
1.1 材料
1.1.1 原料与试剂
福临门一级菜籽油:中粮集团(市售);重组脂肪酶(8 000~10 000 U/g):实验室自制;酚酞、吐温 -80、聚乙烯醇、橄榄油:均为化学纯;正庚烷:色谱纯;硬脂酸甲酯、棕榈酸甲酯、油酸甲酯、亚油酸甲酯、α-亚麻酸甲酯:美国Sigma公司。
1.1.2 仪器
岛津GC-9A型气相色谱仪:岛津企业管理(中国)有限公司;TS-211C天呈卧式恒温振荡器:上海天呈实验仪器制造有限公司;RE52B旋转蒸发仪:上海亚荣生化仪器厂;DF-101S集热式恒温加热磁力搅拌器:金坛市佳美仪器有限公司;2-16实验室通用型离心机:德国希格玛(Sigma)离心机有限公司。
1.2 试验方法
1.2.1 菜籽油混合脂肪酸的制备
称取一定量菜籽油于250 m L三角瓶中,按比例加入0.025 mol/L磷酸缓冲溶液,再加入5%(油)吐温-80和一定量的脂肪酶,置于200 r/min恒温振荡器内进行水解反应。反应一定时间后取出25 m L水解产物,离心,上清液中加入正己烷萃取,有机相水洗至中性,用无水硫酸钠脱水,减压蒸馏回收溶剂,获得菜籽油混合脂肪酸,测定酸值、计算水解率,并用气相色谱仪测定其中脂肪酸组分的含量。
1.2.2 重组脂肪酶水解菜籽油的正交试验
在单因素试验的基础上,选取pH值、加酶量、水解时间和水油比4个因素,以水解率为评价指标,采用四因素三水平的正交试验L9(34),优化脂肪酶催化菜籽油水解的工艺条件。正交试验因素水平见表1。
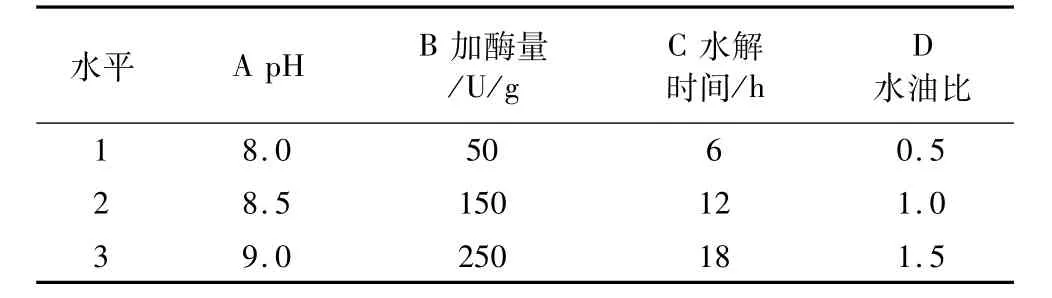
表1 重组脂肪酶水解正交试验因素水平表
1.2.3 尿素包合法富集α-亚麻酸工艺
按一定的配比将乙醇和尿素加入烧瓶中,开启机械搅拌,在65℃的水浴锅中回流至尿素完全溶解,再加入一定比例的混合脂肪酸继续搅拌至溶液澄清透明。在一定的温度下冷却结晶一定的时间,迅速抽滤。滤液经减压旋蒸除去多余的溶剂乙醇,分别用稀酸和正己烷洗涤至中性,再用无水硫酸钠干燥,得到富集的α-亚麻酸。
根据前期单因素试验,确定包合时间、尿素∶脂肪酸比、乙醇比∶尿素对α-亚麻酸的含量影响很大。采用L9(34)正交试验对富集α-亚麻酸的工艺条件进行优化。正交试验因素选取包合时间14、20、26 h,尿素∶脂肪酸(m∶m)(2、4、6)∶1,乙醇 ∶尿素(V∶m)(5、7、9)∶1。
1 .2.4 脂肪酸组成分析测定
菜籽油及富集后的不饱和脂肪酸先进行甲酯化,再进行气相色谱分析其脂肪酸组成。甲酯化方法参照文献[14]。GC分析条件为:DB-WAX型色谱柱(30 m×0.32 mm×0.25μm);进样口温度240℃;检测器温度 260℃;载气流速为 1.2 mL/min;程序升温为初始温度80℃,保留2 min,以5℃/min升温至 140℃,保持 5 min,然后以 2.5℃/min升至230℃,保持10 min;进样量为1μL;分流比 35∶1。
2 结果与分析
2.1 菜籽油脂肪酸组成
菜籽油的脂肪酸甲酯气相色谱图见图1。与脂肪酸甲酯标准品的气相色谱图对比可知,菜籽油中初步定性了5种脂肪酸,它们的组成含量见表2。

图1 菜籽油中脂肪酸的气相色谱图
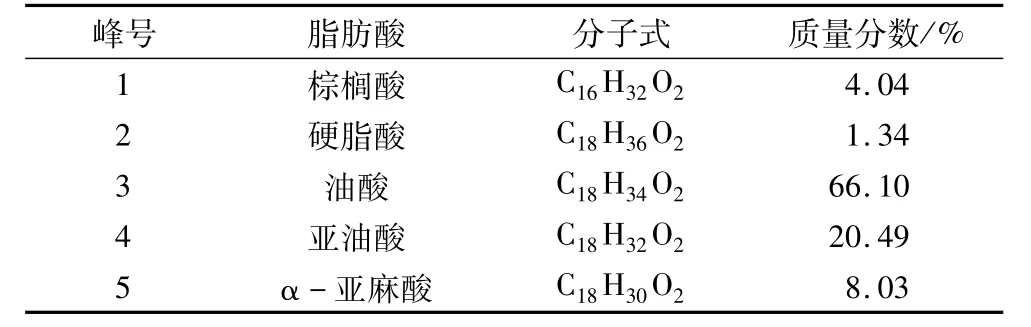
表2 菜籽油脂肪酸组成的分析结果
从表2可知,原料菜籽油中不饱和脂肪酸的质量分数达94.62%,其中以油酸的含量最高,其次是亚油酸,α-亚麻酸质量分数为8.03%。利用脂肪酶水解法和尿素包合法可将饱和脂肪酸、单不饱和脂肪酸及多不饱和脂肪酸进行一定的分离,进而得到较高含量的α-亚麻酸。
2.2 正交试验优化重组脂肪酶水解的工艺条件
在单因素试验的基础上,选取pH(A)、加酶量(B)、水解时间(C)和水油比(D)4个因素作为影响因素,在酶促反应温度42℃的条件下,探讨各因素对油脂水解率的影响,并找出最大的影响因素。正交试验结果见表3。
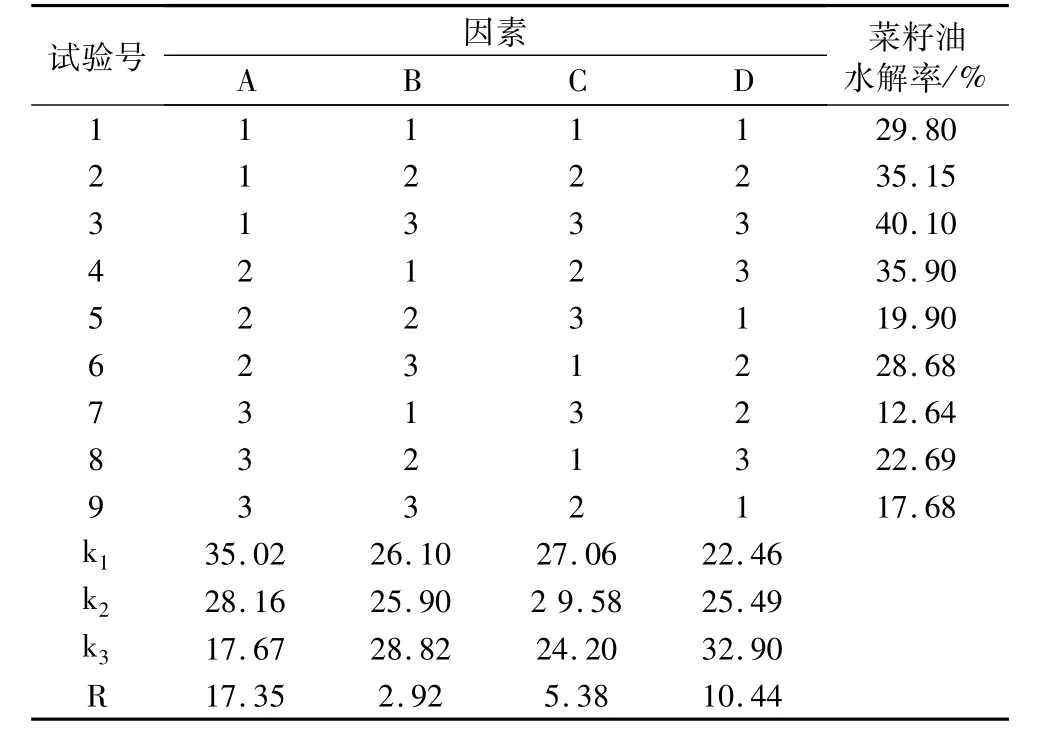
表3 重组白地霉脂肪酶水解正交试验结果与分析
从表3中的极差分析可以看出,4个因素对菜籽油水解率影响的主次顺序为A>D>C>B,即pH值影响最大,加酶量影响最小。以水解率为评价指标时重组白地霉脂肪酶水解菜籽油最佳的工艺条件为A1B3C3D3,即当水/油为 1.5∶1,pH为 8.0,加酶量为250 U/g油,反应18 h的菜籽油水解率为40.1%。
2.3 尿素包合法富集菜籽油α-亚麻酸的条件优化
在各单因素试验基础上,本试验选定包合时间、尿素∶脂肪酸(m∶m)、乙醇∶尿素(V∶m)3个因素,每因素取3水平,选用L9(34)正交设计试验,以α-亚麻酸相对含量和得率为指标进一步研究各因素对α-亚麻酸富集程度的影响。正交试验结果见表4。
由表4中极差分析可知,各因素对尿素包合菜籽油中α-亚麻酸含量的影响次序为A>B>C,即尿素∶脂肪酸>乙醇∶尿素>包合时间。对得率的影响顺序也是A>B>C,即尿素∶脂肪酸>乙醇∶尿素>包合时间。正交试验结果表明,使α-亚麻酸相对含量达到最高的组合为A2B1C3,得率达到最高的组合为A3B3C1,在确定最佳工艺条件时,应综合考虑α-亚麻酸的含量与得率。如果加大尿素用量,部分α-亚麻酸也与尿素包合,使α-亚麻酸的含量降低,所以A选水平2。溶剂乙醇用量太多,α-亚麻酸难以与之分离,影响产品α-亚麻酸含量,也造成溶剂浪费,所以B选水平1。包合时间对尿包后α-亚麻酸的含量和得率影响都比较小,为节约能源C选取水平1。确定适宜的包合条件为A2B1C1,即m(脂肪酸)∶m(尿素)∶V(乙醇)为 1∶4∶20、包合时间14 h,在-20℃条件下包合所得α-亚麻酸的质量分数为19.24%,得率为5.13%。
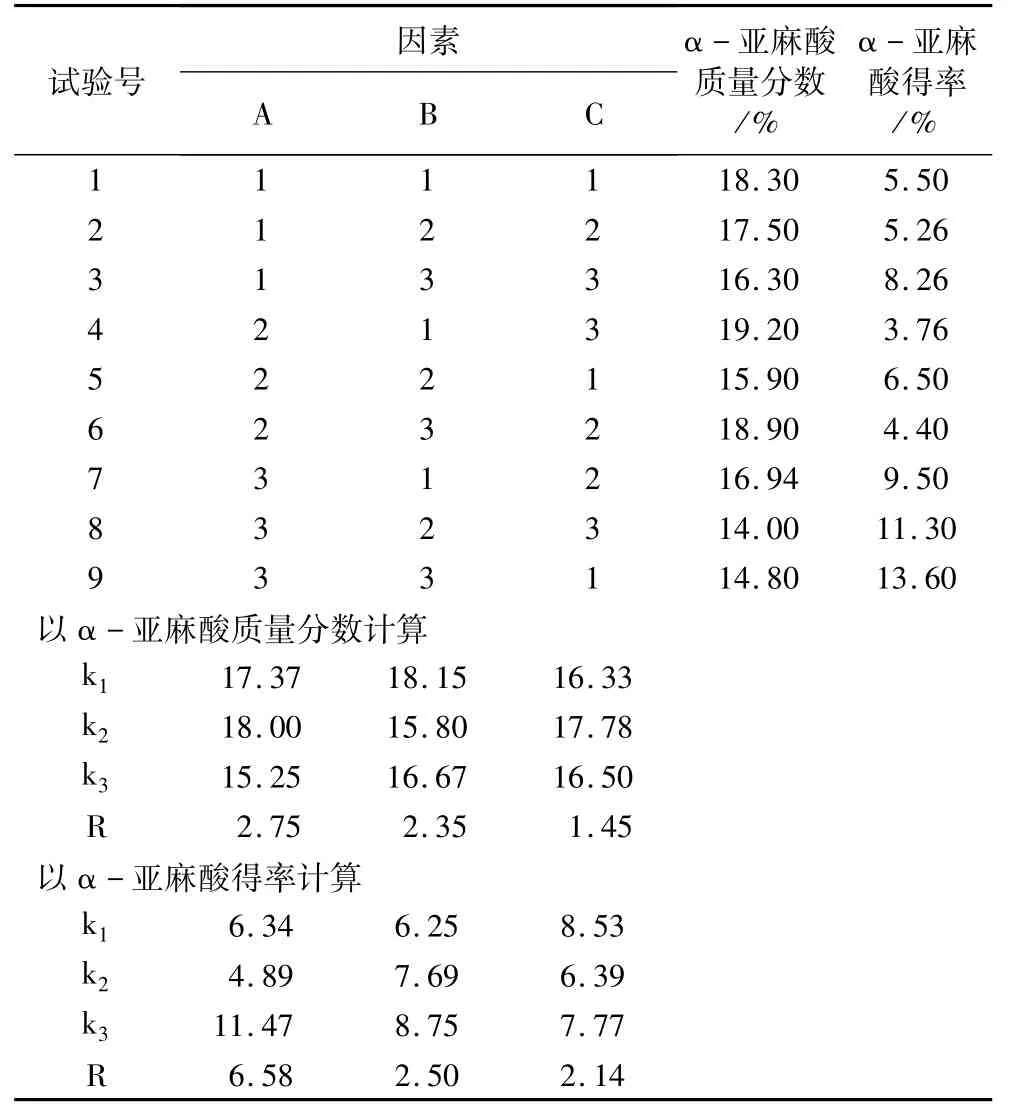
表4 尿素包合正交试验结果与分析
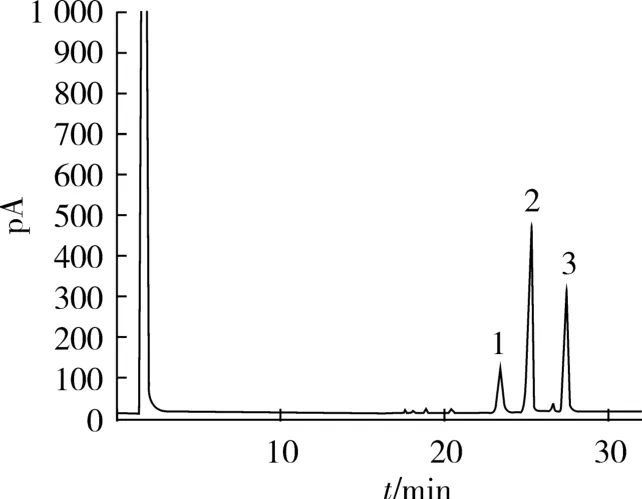
图2 尿素包合富集后的不饱和脂肪酸气相色谱图
2.4 尿素包合富集前、后菜籽油不饱和脂肪酸组成的比较
尿素包合富集后的脂肪酸甲酯气相色谱图见图2,经与尿素包合前菜籽油的脂肪酸气相色谱图(图1)比较,富集后的脂肪酸中初步定性了3种不饱和脂肪酸即油酸、亚油酸和α-亚麻酸,而棕榈酸和硬脂酸已检测不出来。由图2可见,富集后的亚油酸和α-亚麻酸的相对含量明显高于富集前原料菜籽油中亚油酸和α-亚麻酸的含量,而油酸的相对含量与之相比显著降低。结果表明,尿素包合能将饱和脂肪酸(棕榈酸和硬脂酸)以及部分油酸除去,而亚油酸和α-亚麻酸被富集,含量明显提高。亚油酸和α-亚麻酸碳链长度相同,且只相差一个不饱和键,因此很难将其分离。
3 结论
在反应时间18 h、反应温度42℃条件下,通过正交试验优化得到重组白地霉脂肪酶水解菜籽油的最优工艺条件为∶水油比1.5∶1,pH 8.0,酶用量250 U/g。在此条件下菜籽油的水解率最大达40.1%。酶法制备脂肪酸是一项较先进的提取技术,而重组白地霉脂肪酶水解菜籽油效果明显,本研究为利用该酶水解其他动植物油脂制备脂肪酸提供了基础数据。
通过正交试验优化的尿素包合法富集菜籽油中α-亚麻酸的最佳条件为m(脂肪酸)∶m(尿素)∶V(乙醇)为 1∶4∶20,包合时间为 14 h,包合温度为-20℃,产品中α-亚麻酸质量分数由8.03%提高到19.24%。表明采用尿素包合法纯化富集菜籽油中α-亚麻酸是可行的,尿素包合法是大幅度提高不饱和脂肪酸含量的有效途径之一。尿素包合法工艺简单,易于操作,生产成本低廉,溶剂可回收再利用,且此过程在低温下进行,对不饱和脂肪酸的分子结构和理化性质不会产生影响,可作为实现工业化生产的工艺技术参考。
[1]李加兴,李忠海,刘飞,等.α亚麻酸的生理功能及其富集纯化[J].食品与机械,2009,25(5):172-177
[2]梁少华,彭乐,陈伟伟.α-亚麻酸制取及纯化技术研究现状[J].河南工业大学学报:自然科学版,2013,34(4):91-97
[3]陈清馥,王风云,谷军.酶法水解油脂生产脂肪酸的研究[J].生物技术,1992,2(1):42-44
[4]刘海洲,吴小飞,牛佰慧.脂肪酶在食品工业中的应用与研究进展[J].粮食加工,2008,33(5):55-57
[5]谢舜珍,吴琼发.双酶法水解菜籽油的研究[J].生物工程学报,1987,3(1):53-55
[6]魏决,罗雯,陈玲.酶法从紫苏子油中制取α-亚麻酸工艺研究—脂肪酶水解工艺的探讨[J].食品科学,2005,26(1):131-133
[7]魏决,罗雯,肖青.酶法从紫苏子油中制取α-亚麻酸工艺研究—尿素包络纯化工艺的探讨[J].食品科学,2005,26(2):117-119
[8]王惠芳.酶法水解亚麻油的探讨[J].甘肃科技,2002(8):78
[9]张海满,刘福祯,戴玲妹.尿素包合法纯化α-亚麻酸工艺研究(Ⅰ)—α-亚麻酸纯化过程单因素实验研究[J].中国油脂,2001,26(2):41-44
[10]唐菊.花椒籽油不饱和脂肪酸的制备、富集及包合研究[D].杨凌:西北农林科技大学,2009
[11]李婷婷,吴彩娥,许克勇,等.猕猴桃籽油中α-亚麻酸富集纯化的研究[J].中国食品学报,2008,8(2):5-11
[12]吴彩娥,许克勇,李元瑞,等.尿素包合法富集猕猴桃籽油中 α-亚麻酸[J].农业机械学报,2005,36(5):57-60
[13]张桂梅,何美莹,邹建云.尿素包合法富集橡胶籽油亚麻酸的工艺试[J].热带农业科技,2008,31(1):1-3
[14]蒋艳忠,赵凤春.蚕蛹油中多不饱和脂肪酸的分离研究[J].食品研究与开发,2009,30(10):19-22.
