响应面法优化玉米芯中低聚木糖的酶法提取工艺
2014-03-13叶曼曼
姚 笛 叶曼曼 李 琳 樊 蕾 孟 超 杨 健
(黑龙江八一农垦大学食品学院1,大庆 163319)
(浙江诺倍威生物技术有限公司2,杭州 310035)
低聚木糖系由2~7个木糖分子以α-1,4糖苷键结合而成[1],具有很强的增殖肠道益生菌[2]、改善肠道微生态环境等功能[3-4],它的甜度比蔗糖和葡萄糖均低,具有抗龋齿作用[5]。低聚木糖作为一种非消化性糖,理化性质稳定,耐酸、耐热,是一种功能性食品配料[6-7],被认为是目前最有前途、国内外研究最为广泛的功能性低聚糖之一。
低聚木糖的生产主要是以富含木聚糖的植物(如玉米芯、棉籽壳、麸皮等)为原料,通过木聚糖水解酶酶解而得的一种低聚糖[8-9],制备低聚木糖的原料多为木聚糖提取率较高的木质纤维素,玉米芯中含有大约35%的半纤维素、35%的纤维素和15%的木质素,其中半纤维素的主要组成为木聚糖,它通过降解可生产低聚木糖[10-11]。目前,我国对玉米芯的利用相对来说还很少,除少量进行初加工外,绝大部分作为农家燃料被烧掉,既浪费了资源又污染环境,我国对低聚木糖的研究起步较晚,与一些发达国家相比,在技术和工艺上都有一定程度的差距。近年来,由于低聚木糖市场需求的持续增长,对其生产工艺的技术要求也不断提高。因此,以价廉易得的玉米芯为原料,研究开发低聚木糖产品具有极大的竞争力和市场开发前景[12-14]。本研究旨在开发高附加值的低聚木糖,以玉米芯为原料,通过响应面法对酶法提取低聚木糖的工艺进行优化,为玉米芯资源的有效利用提供了基础数据,具有重要的生态效益和经济效益。
1 材料与方法
1.1 材料
玉米芯:大庆市郊区;木聚糖酶:本实验室利用球毛壳霉发酵后分离纯化获得;木聚糖:sigma公司;D-木糖、3,5-二硝基水杨酸、乙醇等为国产分析纯。
1.2 玉米芯木聚糖粗品的制备
采用碱法提取木聚糖粗品,具体流程为:干燥的玉米芯粉→碱法浸提→上清液→过滤→粗提液→中和→沉淀→离心→水解→醇沉→离心→烘干沉淀→得木聚糖粗品。
1.3 酶解木聚糖制备低聚木糖
取木聚糖粗品,用蒸馏水浸泡12 h制成木聚糖浓缩液,调pH为5.7,添加木聚糖酶,摇床水浴振荡酶解,过滤,重复3次,取其上清液进行还原糖含量的测定。
1.4 单因素试验
以木聚糖底物浓度、木聚糖酶添加量、酶解温度、酶解时间4个影响玉米芯中低聚木糖含量的因素做单因素试验,确定各因素适宜的范围。
1.5 响应面分析法试验设计
响应面分析法试验设计在单因素试验基础上,确定中心组合试验设计的自变量及其水平。根据Box-Behnken中心组合试验设计原理,以还原糖含量为指标,选取木聚糖底物浓度、木聚糖酶添加量、酶解温度、酶解时间4个因素,设计四因素三水平响应面分析试验,用响应面分析(Response surface analysis,RSA)方法对数据进行回归分析及显著性检验,以确定酶处理的最优工艺条件。每个试验点重复3次,取试验结果的平均值。其中各自变量的因素水平编码见表1。

表1 因素水平编码表
1.6 还原糖含量测定
还原糖含量采用 DNS法测定(以木糖计,g/L)[15]。
1.7 酶解液组分分析
采用高效液相色谱法分析最优条件下玉米芯酶解液中低聚木糖的主要成分[16],色谱条件:色谱柱为Suga KS-802柱;检测器为515示差折光检测器;流动相为超纯水;流速0.8 mL/min;进样量5μL。
2 结果与分析
2.1 单因素试验分析
2.1.1 底物浓度对还原糖含量的影响
由图1可知,随着木聚糖底物浓度的增加,酶解液中还原糖含量逐渐增加,酶解后酶解液中还原糖含量在木聚糖底物浓度为1%~5%时逐渐增加,而在3%~5%时还原糖含量增加不明显。因此,为节省原材料,宜选用木聚糖底物浓度3%。
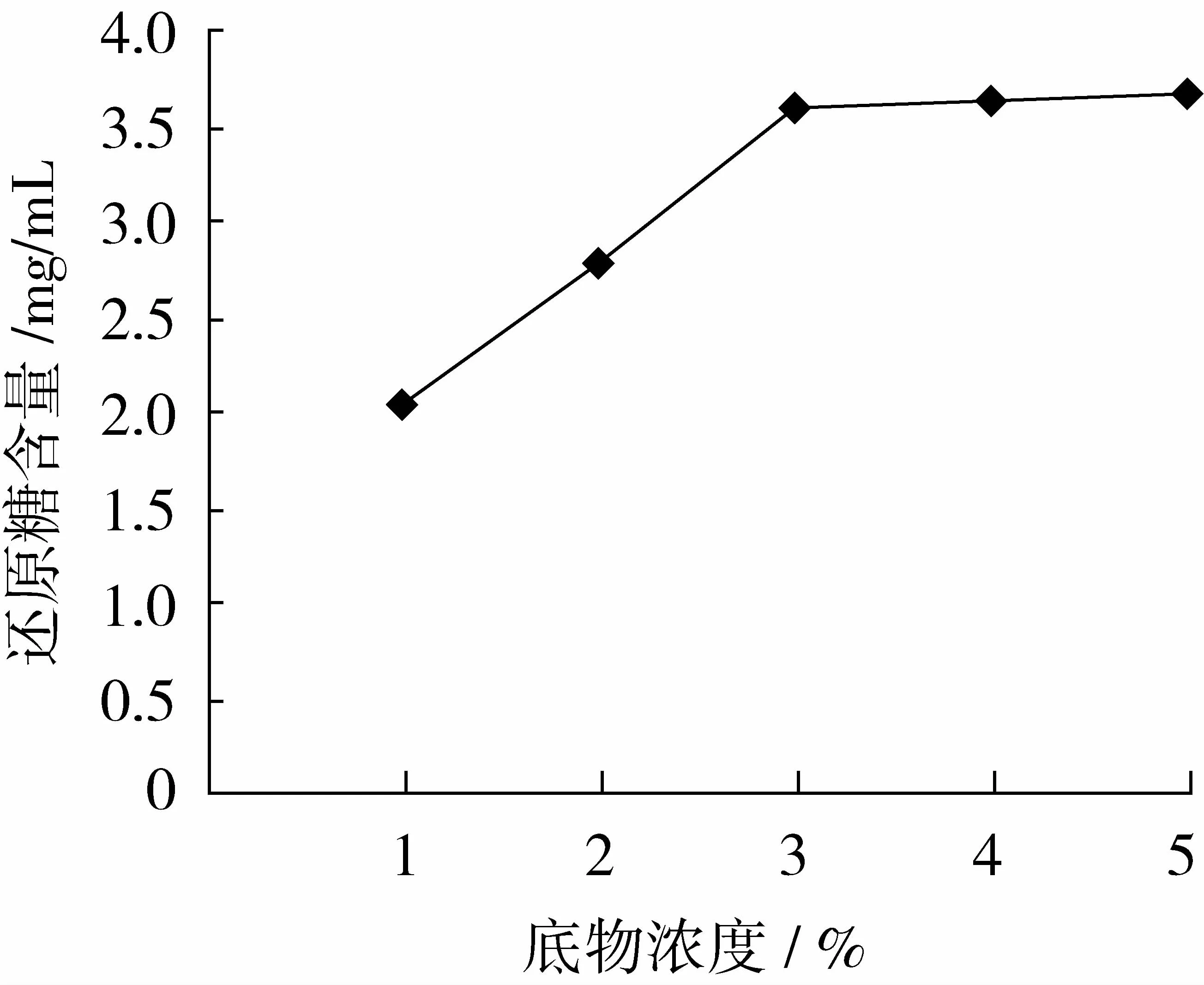
图1 底物浓度对还原糖含量的影响
2.1.2 木聚糖酶添加量对还原糖含量的影响
由图2可知,随着木聚糖酶添加量的增大,酶解液还原糖含量逐渐增加,加酶量为40 mL/g时还原糖含量最高,所加酶量以40 mL/g较好。
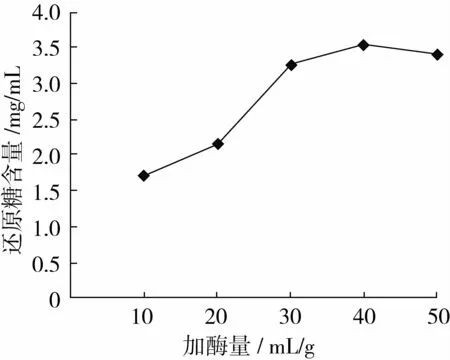
图2 加酶量对还原糖含量的影响
2.1.3 酶解温度对还原糖含量的影响
由图3可知,随着酶解温度的升高,酶解液的还原糖含量先逐渐增加后有所降低,温度过高对木聚糖酶活力有一定的影响,因此,酶解温度为60℃时还原糖含量最高。

图3 酶解温度对还原糖含量的影响
2.1.4 酶解时间对酶解液还原糖含量的影响
由图4可知,随着酶解时间延长,酶解液的还原糖含量先增加后减少,3~5 h增加明显,5~7 h有所降低,处理5 h时酶解液的还原糖含量最高,所以酶解时间以5 h较好。

图4 酶解时间对还原糖含量的影响
2.2 响应面法优化低聚木糖提取工艺参数分析
2.2.1 回归方程的建立与方差分析
响应面法优化低聚木糖提取工艺试验结果如表2,通过Design Expert数据分析软件进行回归分析,得到的方差分析结果如表3所示。由表3可知,底物浓度的一次项达到极显著水平(P<0.01),加酶量的一次项达到显著水平(P<0.05),表明这2个因素对还原糖含量的线性效应显著,所有二次项对还原糖含量的曲面效应极显著,交互项AB、AD交互效应显著(P<0.05),表明各影响因素对还原糖含量的影响不是简单的线性关系。表3分析结果可见,整体模型的P值小于0.000 1,该二次方程模型达到极显著水平,并且失拟项不显著(P>0.05),说明该回归方程对数据进行了较好拟合,二次回归方程为:R=3.82+0.17A+0.12B+0.08C-0.07D-0.18AB+0.02AC-0.26AD-0.06BC-0.04BD-(5.00E+003)CD-0.95A2-0.43B2-0.25C2-0.41D2
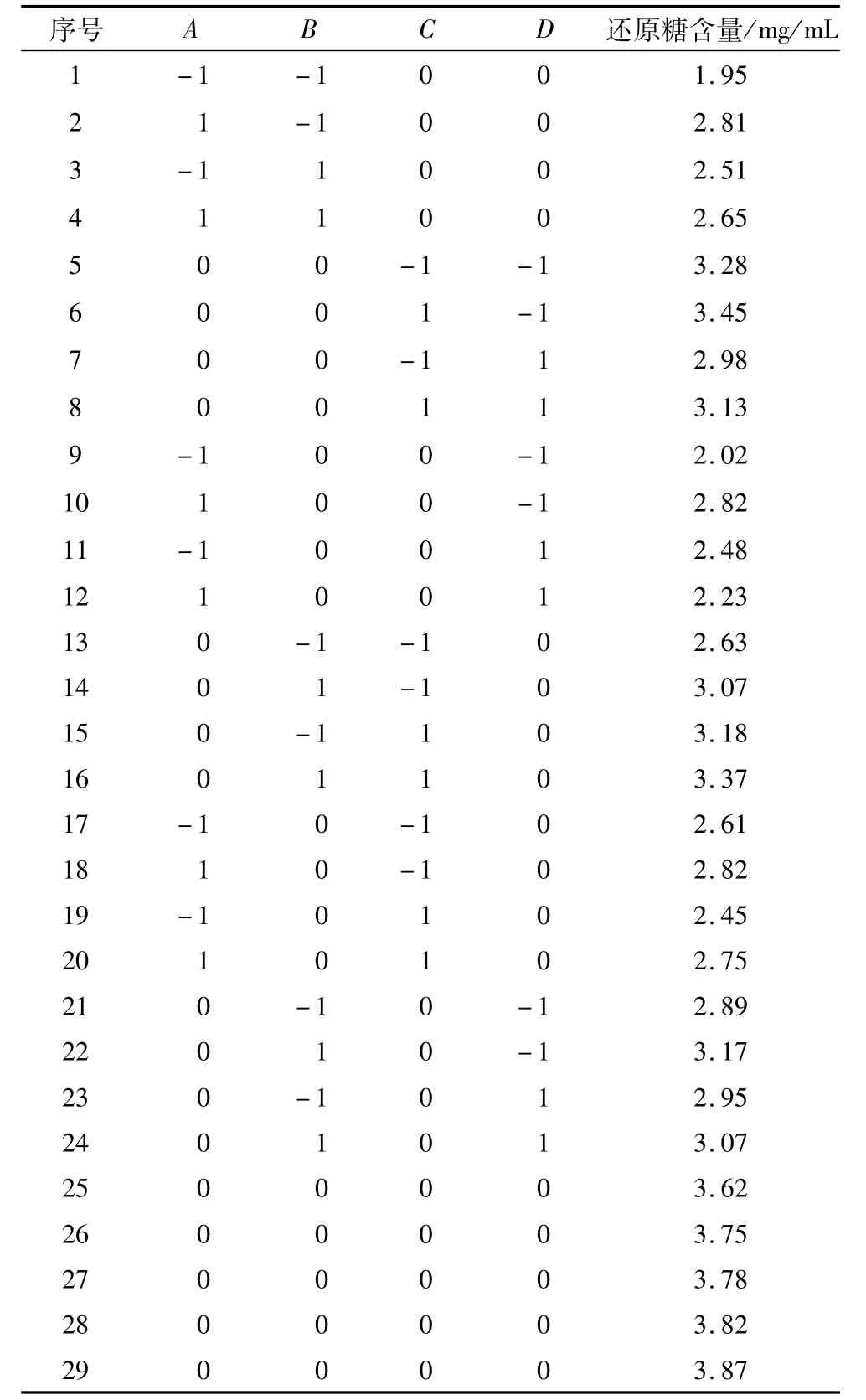
表2 响应面分析方案及试验结果
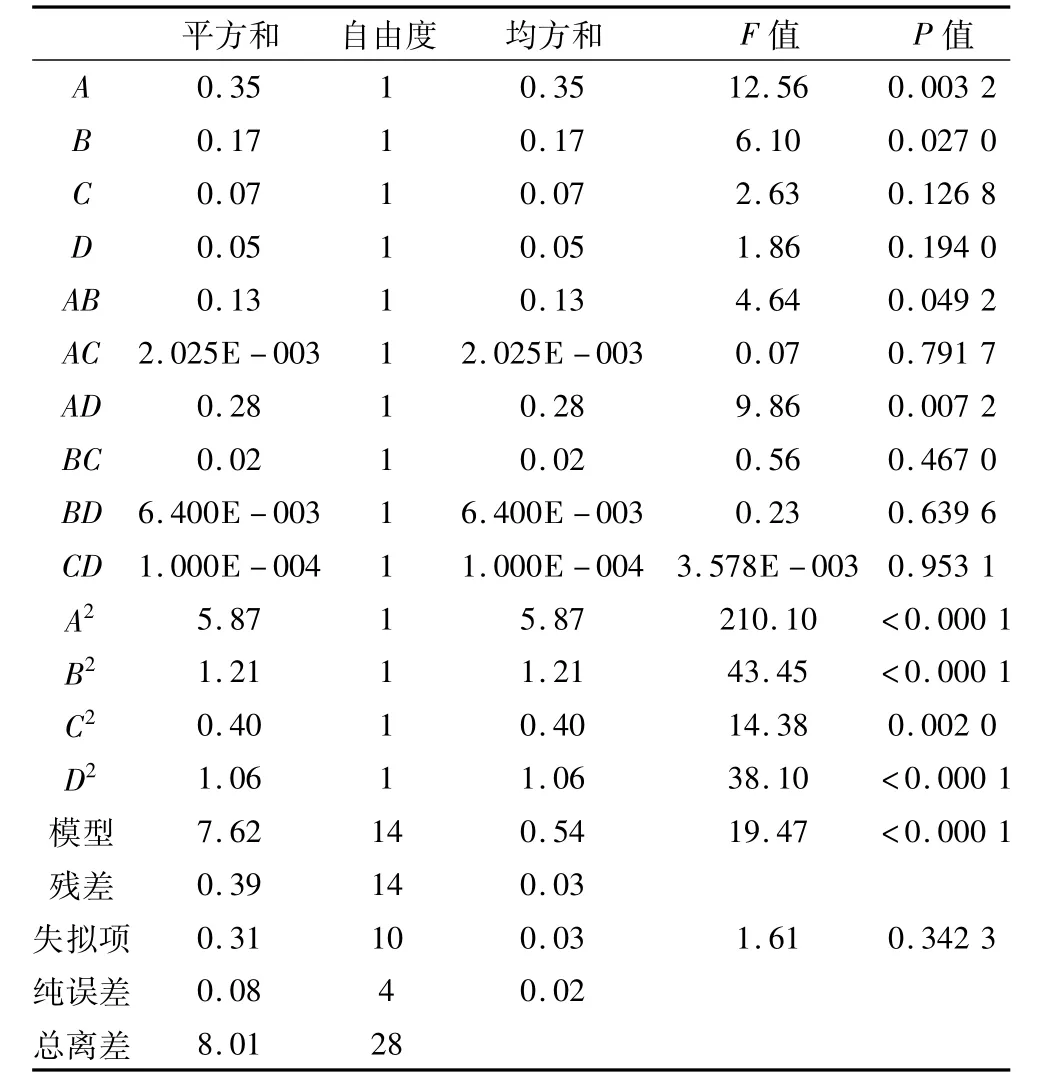
表3 回归模型方差分析
2.2.2 响应面以及等高线分析结果
响应面图是响应值在各试验因子交互作用下得到的结果构成的一个三维空间曲面。根据回归方程绘制响应曲面图,考察所拟合的响应曲面的形状。图5、图6是对响应值还原糖含量影响较大的两因素交互作用的响应面,其他因素交互作用不显著。
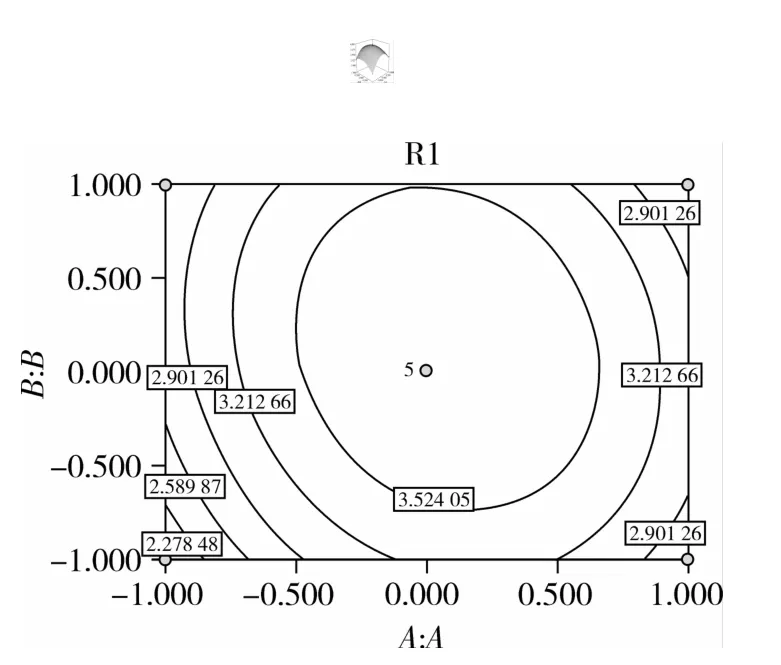
图5 底物浓度和加酶量对还原糖含量交互影响的三维曲面图和等高线图
由图5可知,底物浓度在(3%~4%)范围内,木聚糖酶添加量在(40~50 mL/g)范围内时,两者存在着显著的增效作用,还原糖含量随着底物浓度和木聚糖酶添加量的增加而增加;而当底物浓度量在(2%~3%)范围内,木聚糖酶添加量在(30~40 h)范围内时,还原糖含量随着两个因素的增加而减少。由图6可知,底物浓度在(3%~4%)范围内,酶解时间在(5~6 h)范围内时,两者存在着显著的增效作用,还原糖含量随着底物浓度和酶解时间的增加而升高;而当底物浓度在(2%~3%)区间,酶解时间在(4~5 h)还原糖含量随着两个因素的增加开始降低。
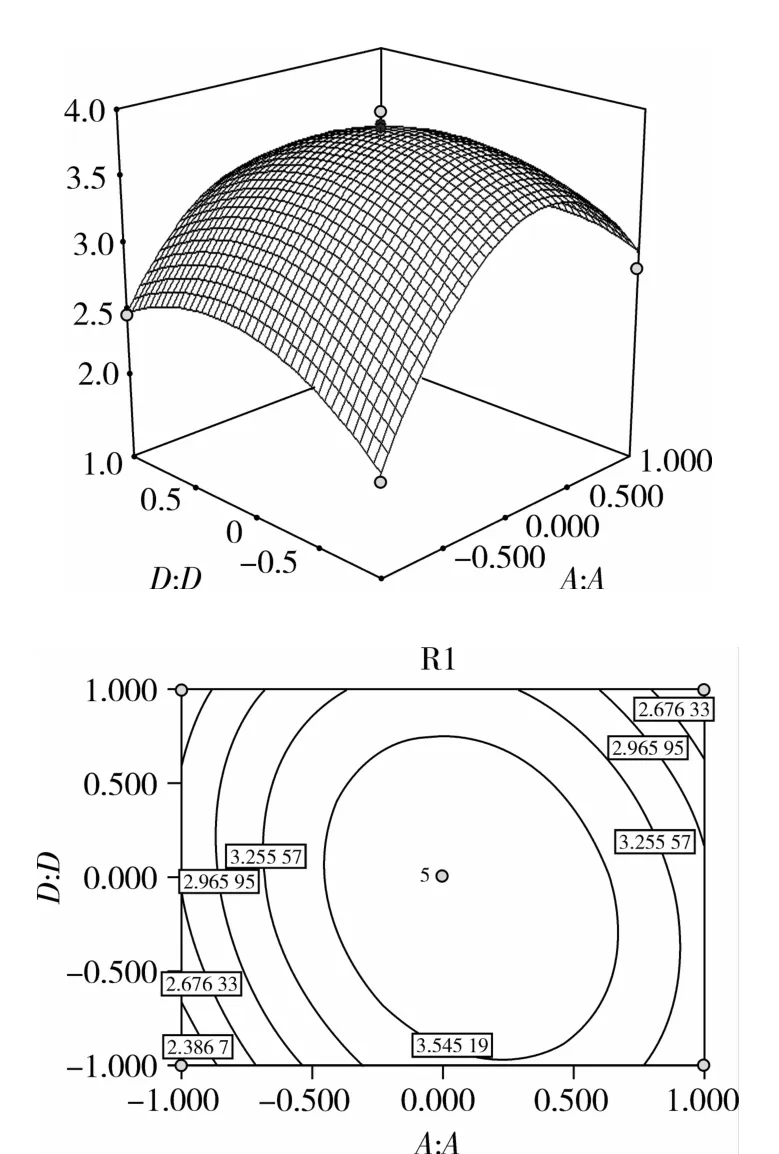
图6 底物浓度和酶解时间对还原糖含量交互影响的三维曲面图和等高线图
为了确定最佳点的值,对试验模型进行分析,以得到高还原糖低聚木糖的最佳制备工艺条件,经分析得出最佳制备条件为:底物浓度为3%,加酶量为41 mL/g(底物),51℃时酶解4.88 h所得的低聚木糖含量最高,3.88 mg/mL。为检验试验的可靠性,采用上述最优提取条件进行玉米芯中低聚木糖的提取,同时考虑到实际操作的便利,最佳条件修正底物浓度为3%,加酶量为40 mL/g(底物),50℃时酶解5 h所得的低聚木糖含量为3.86 mg/mL。与预测值比较可知,本试验优化得到的最佳条件参数准确可靠,具有实用价值。
2.3 优化条件下酶解液的组分分析
采用HPLC对玉米芯酶解液中低聚木糖组分进行分析,低聚木糖标准品的HPLC图谱如图7所示,从图7可以看出,1号峰为木糖,出峰时间11.426 min,2号为木二糖(10.324 min),3号为木三糖(9.875 min),4号为木四糖(9.216 min),5号为木五糖(8.571 min)。酶解液中低聚木糖组分的HPLC图谱如图8,由积分面积可知低聚木糖(木二~木五)的相对含量达68.1%,说明此水解条件能够较好的制备低聚木糖。
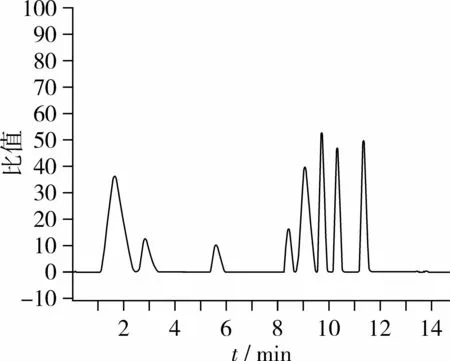
图7 低聚木糖标准品HPLC图谱

图8 酶解液中低聚木糖组分的HPLC图谱
3 结论
采用Box-Behnken中心组合试验设计,经响应面分析结合实际值确定玉米芯酶法制备低聚木糖的最佳工艺条件为底物浓度3%,加酶量为40 mL/g(底物),50℃时酶解5 h所得的酶解液中还原糖含量为3.86 mg/mL。能够使玉米芯中的木聚糖充分水解得到低聚木糖,并通过HPLC进行水解产物的分析,证明水解产物中含有较高的木二糖、木三糖、木四糖及木五糖等低聚木糖组分,低聚木糖(木二~木五)的相对含量达68.1%,因此说明优化的水解条件能够较好的制备低聚木糖。
[1]郑建仙.功能性低聚糖[M].北京:化学工业出版社,2004:178-184
[2]Mäkeläinen H,Juntunen M,Hasselwander O.Prebiotic Potential of Xylo-Oligosaccharides[J].Prebiotics and Probiotics Science and Technology,2009,12(1):245-258
[3]Hsu C K,Liao JW,Chung Y C,et al.Xylooligosaccharides and fructooligosaccharides affect the intestinalmicrobiota and precancerous colonic lesion development in rats[J].Journal of Nutrition,2004,134(6):1523-1528
[4]魏涛,赵建元,高兆兰,等.低聚木糖调节BALB/c小鼠肠道菌群及润肠通便作用研究[J].安徽农业科学,2013,41(1):159-163
[5]张洪宾,丁长河,周迎春,等.低聚木糖生产现状及其应用[J].粮食与油脂,2012,11:46-48
[6]许正宏,熊筱晶,陶文沂.低聚木糖的生产及应用研究进展[J].食品与发酵工业,2004,3(6):46-51
[7]袁建国,程显好,侯永勤,等.低聚木糖的研究开发[J].精细与专用化学品,2002,10(10):17-19
[8]吴彬,马正智,周伟,等.从稻壳中提取制备低聚木糖研究进展[J].中国食品添加剂,2009,94-99
[9]王远,欧仕益.利用麦麸制备低聚木糖的研究[J].湖南农业大学学报:自然科学版,2009,(4):35-39
[10]Moure A,Gullo P,DomıNguez H,et al.Advances in the manufacture,purification and applications of xylo-oligosaccharides as food additives and nutraceuticals[J].Process Biochemistry,2006,41:1913-1923
[11]杨瑞金,许时婴,王璋.低聚木糖的功能性质与酶法生产[J].中国食品添加剂,2000(2):89-93
[12]石波,李里特.低聚木糖的制备与分离[J].食品添加剂,2004,25(1):113-114
[13]张培刚,张静文,张凤清.玉米芯中低聚木糖的定性定量研究[J].食品科学,2009,19(30):125-127
[14]邵佩兰,徐明,朱晓红.影响玉米芯木聚糖提取的因素探讨[J].宁夏农学院学报,2002,23(2):56-57
[15]朱凯杰,陆国权,张迟.响应面优化DNS测定还原糖方法[J].中国粮油学报,2013,28(8):107-113
[16]Sari Metsämuuronen,Katja Lyytikäinen,Kaj Backfolk,et al.Determination of xylo-oligosaccharides in enzymatically hydrolysed pulp by liquid chromatography and capillary electrophoresis[J].Cellulose,2013,20(2):1572-1582.
