利用液相色谱-质谱多反应监测方法测定食物中主要的牛奶过敏原α-酪蛋白
2013-07-13冯小燕张津吕美玲高明霞张祥民
冯小燕,张津,吕美玲,高明霞,张祥民*
(1.复旦大学化学系,上海 200433;2.安捷伦科技(中国)有限公司,北京 100102)
食品过敏原是指能够选择性地激活人体细胞,诱导产生特异性抗体应答,引起变态反应的抗原性物质。过敏原种类繁多,且对人群的危害越来越严重[1]。一般地,引起食物过敏症的过敏原多数来源于食物中的蛋白质,蛋白质中与过敏反应相关的为其表面的抗原决定簇。常见的过敏食物是牛奶、鸡蛋、鱼、甲壳类(蟹、虾)、花生、大豆、坚果类(板栗、杏、腰果等)及小麦等,约占所有过敏食物的90%[2]。其中,牛乳及乳制品作为八大类致敏食品之一,尤其影响婴幼儿和儿童的身体健康。现已知牛乳中有30种以上的蛋白质同过敏反应有关,包括酪蛋白和乳清蛋白等主要成分[3]。目前,国内的过敏原研究尚处在起步阶段,研究对多种过敏原的同时检测分析技术,已成为当前食品过敏原研究的热点之一[4,5]。
质谱多反应监测(MRM)技术因具有灵敏、准确和特异等优点,在基于蛋白组学的生物标志物研究、蛋白质翻译后修饰、定量蛋白质组和蛋白质相互作用等研究领域日渐受到重视[6,7]。近年来,MRM 技术在蛋白质组学领域的应用得到进一步拓展,使复杂目标物的定性定量结果更为可靠[8,9]。
目前最常使用的检测过敏原的分析方法是基于抗体的酶联免疫吸附测定(ELISA)方法和基于DNA的聚合酶链式反应(PCR)方法。但是,ELISA 方法存在交叉作用且一次只能检测一个目标物,效率较低;PCR 方法虽然可以实现多种目标物同步检测,但是容易出现假阳性结果,两种方法都难以适用于当今各种复杂食品的检测[10,11]。本研究利用高效液相色谱-质谱联用技术(LC-MS),选择牛奶中主要过敏原α-酪蛋白(α-casein)为研究对象,建立检测食物中牛奶过敏原的多反应监测(MRM)方法。
1 实验部分
1.1 仪器、试剂与材料
Agilent 1260液相色谱-G6460三重四极杆质谱联用仪(Agilent,USA);质谱5800 MALDI-TOF-TOFMS(Applied Biosystem,USA);岛津Shimadzu 紫外分光光度计UV-1240(UV mini);超滤离心管Amicon Ultra-0.5,3000MWCO(Millipore,Billerica,USA);所有实验用水由Milli-Q 超纯水系统(Millipore,Bedford,MA,USA)制得。
氨基丁三醇(trizma base,光谱纯)、α-酪蛋白(光谱纯)、卵清蛋白(ovalbumin,OVA,光谱纯)、二硫苏糖醇(DTT,HPLC 级)、碘乙酰胺(IAA,HPLC级)、胰蛋白酶(trypsin,测序级)(Sigma-Aldrich,USA);盐酸、碳酸氢铵、甲酸(均为分析纯,中国医药集团上海化学试剂公司);乙腈(ACN)(HPLC 级,Dikma Technologies Inc,USA)。
脱脂奶粉、牛奶饼干、蛋黄派、小麦粉样品为市售。
1.2 样品提取
称取0.1 g 样品粉末,加入1 mL pH 8.2的Tris-HCl 提取液于60℃充分振荡1 h 后,置于4℃条件下以14000 r/min 离心10 min,取上清液再次离心10 min。将经过两次离心得到的上清液置于超滤离心管中超滤浓缩去除小分子杂质得到蛋白质提取液,并用Bradford 方法对提取到的总蛋白质进行定量。
1.3 蛋白质酶解
使用胰蛋白酶对提取的蛋白质进行酶解。将一定浓度的蛋白质溶液在沸水中煮5 min 变性,加入DTT(终浓度50 mmol/L)在60℃反应30 min,再加入2倍(物质的量)DTT的IAA,室温下避光反应1 h。加入NH4HCO3溶液使体系中蛋白质的终浓度为1 g/L,NH4HCO3浓度达到25 mmol/L。加入胰蛋白酶(酶∶蛋白质=1∶40,质量比)于37℃酶解16 h。
酶解液直接进行液相色谱、质谱分析。
1.4 液相色谱-质谱条件
1.4.1 液相色谱条件
反相色谱柱:Inertsil ODS-SP(250 mm ×4.6 mm,5μm)。流动相:A 为10%乙腈水溶液(含有0.1%(体积分数)甲酸),B 为95%乙腈水溶液(含有0.09%(体积分数)甲酸)。流动相梯度:5 min 内从0线性上升到20%B,5 min 内从20%B 线性上升到65%B,5 min 内从65%B 线性上升到90%B并且保持3 min,然后3 min 内线性回到100%A 并稳定9 min,整个梯度在30 min 内完成。流速:0.55 mL/min。进样体积:10μL。
1.4.2 MALDI-TOF-TOF-MS 条件
4700 ExplorerTM软件控制,激光波长337 nm,正离子反射模式,质谱加速电压20 kV,扫描范围400~3000 Da。
1.4.3 三重四极杆质谱条件
采用ESI 电离源;干燥气温度:350℃;干燥气流量:5 L/min;雾化气压力:310.275 kPa(45.0 psi);鞘气温度:250℃;鞘气流量:11.0 L/min;毛细管电压:4000 V(+)/3500 V(-);喷嘴电压:500 V。
2 结果与讨论
2.1 MRM 条件筛选优化
目前普遍认为α-酪蛋白和β-酪蛋白是牛奶的主要过敏原成分[12,13]。本研究的目的是检测食物中是否含有牛奶主要过敏原成分,为此主要选择含量较多的α-酪蛋白作为研究对象。α-酪蛋白的还原烷基化酶解液直接进入5800MALDI-TOF 质谱分析,得到一系列肽指纹图谱(见图1)。
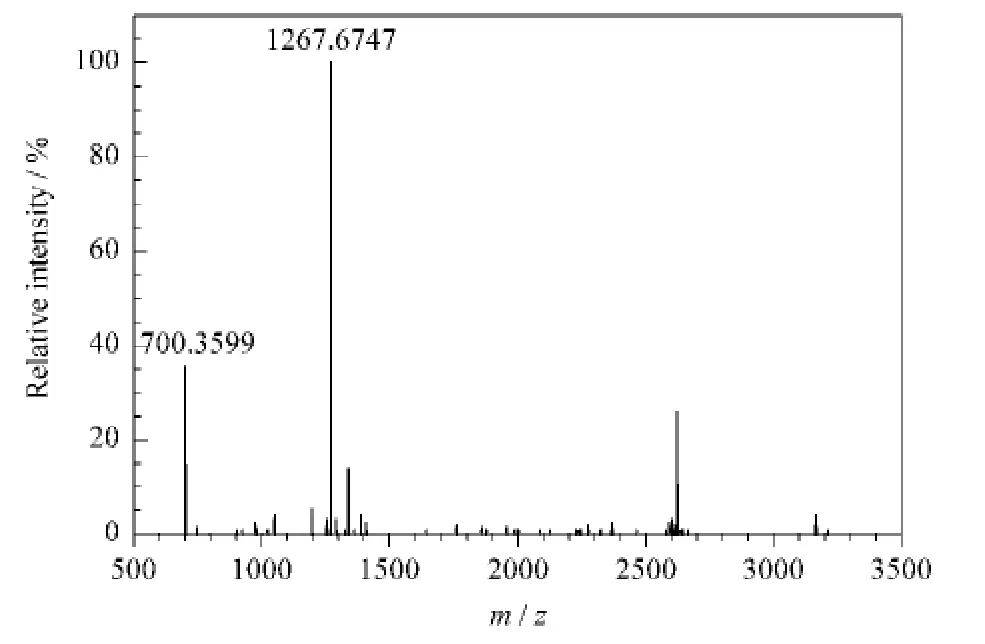
图1 α-酪蛋白经胰蛋白酶酶解得到的肽指纹图谱Fig.1 MS spectrum of a tryptic digest of α-casein standard
按照选择MRM 特征离子对的标准,母离子应符合以下条件:对于目标蛋白质有唯一性,带电荷+2价到+4价,而子离子的相对分子质量介于150~1400 Da 之间,具有一定强度和稳定性。将αcasein 肽指纹信息利用Mascot 数据库进行匹配验证,并结合相关文献[14,15],确定了MRM 牛奶过敏原的特征离子对,并且利用G6460三重四极杆质谱自带的肽段优化软件对碎裂电压(Fragmentor)和碰撞电压(CE)等参数进行了优化(见表1)。

表1 LC-MS/MS 检测牛奶过敏原酶解肽段的MRM 参数Table 1 Parameters of the LC-MS/MS in MRM mode for profiling of tryptic peptides of the milk allergen protein
2.2 α-酪蛋白标准品考察方法的可靠性
为了减小不同样品体系、不同进样批次中的离子化效率的差异,我们选择了OVA 作为内标,每次进样加固定量的OVA 酶解液,以OVA的特征离子对673.3/222.9作为内标离子对,将各离子对的峰面积以内标离子对为参照进行统一校正。对于不同浓度的α-酪蛋白标准蛋白质,得到各个特征离子对的MRM 提取离子流图(见图2),对各提取离子流图进行积分和校正,得到相应质量浓度下的峰面积(见表2)。
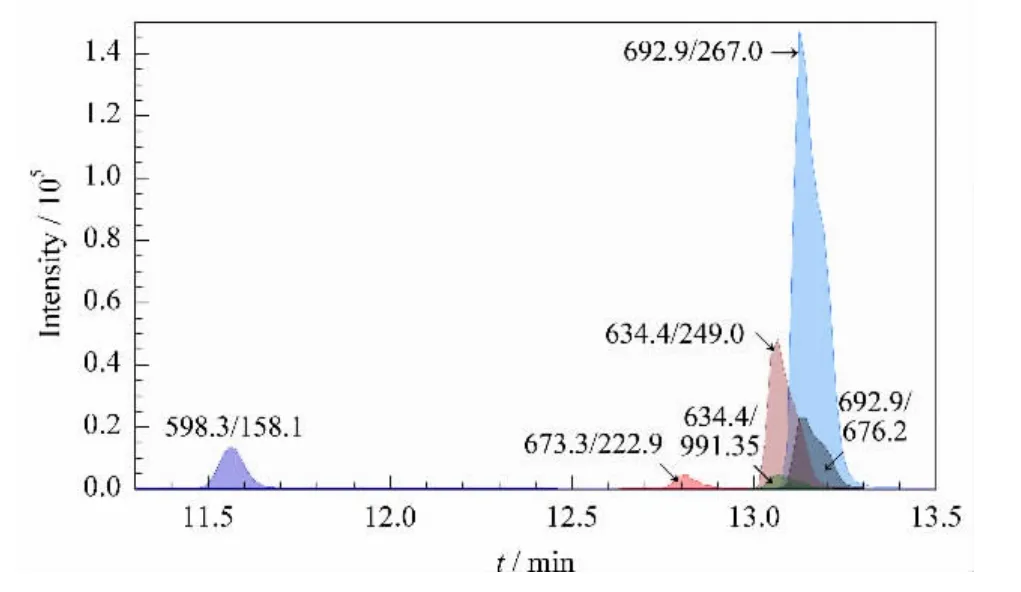
图2 α-酪蛋白各特征离子对的MRM 提取离子流图Fig.2 Extracted MRM transitions for α-casein standard
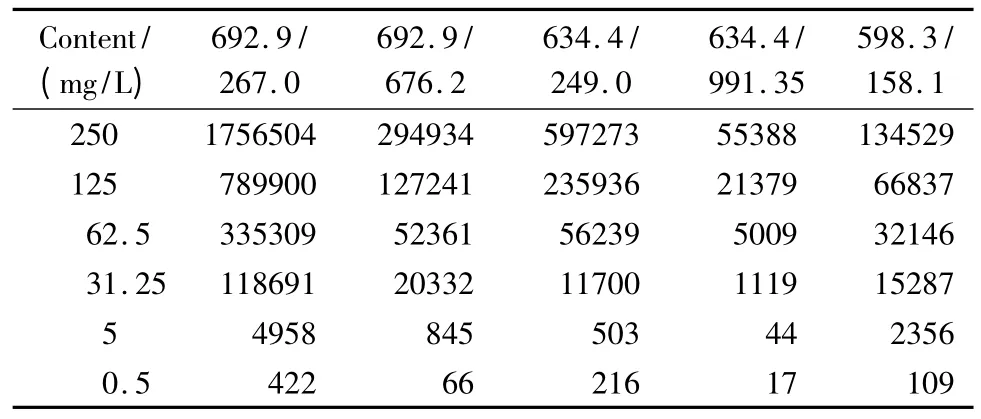
表2 不同质量浓度下α-酪蛋白的MRM 离子对峰面积Table 2 Peak areas of extracted MRM transitions for α-casein at different mass concentrations
在5对离子对中,598.3/158.1的离子流图峰形对称性较好,其余离子对的峰形均有些不对称,原因可能是其他4个离子对保留时间都有重叠,离子化和碎裂过程彼此略有干扰。以峰面积对质量浓度作线性曲线,结果表明5对离子对的检出限为0.5 mg/L,在0.5~250 mg/L 范围内均有良好线性可以达到高灵敏检测的要求。其中最强信号离子对为692.9/267.0:y=7.1348x -62.982,r2=0.995;最佳线性离子对为598.3/158.1:y=0.5406 x -0.8565,r2=0.9999(y 表示峰面积,103;x 表示蛋白质的质量浓度,g/L)。
为了进一步验证该方法的准确性和重现性,我们将小麦提取液的酶解液作为空白本体,添加不同质量浓度(0.03、0.04、0.05 g/L)的α-酪蛋白标准蛋白质酶解液,进行MRM 检测,所得离子对峰面积利用之前标准曲线的线性关系式进行定量,回收率均在90%~106%之间,3次检测结果的相对标准偏差小于10%。
2.3 实际样品检测
对于实际奶粉样品进行了提取蛋白质、酶解以及MRM 检测。虽然实际样品中杂质较多,质谱检测的母离子扫描有较多杂质峰,但是MRM 方法在第二、第三两步选择离子的过程中除去了大量干扰离子,只保留目标离子对,因此提取离子流图与标准α-酪蛋白完全一致(见图3)。
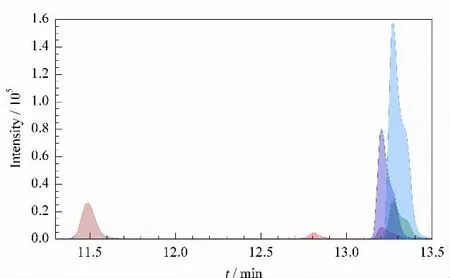
图3 脱脂奶粉各特征离子对的MRM 提取离子流图Fig.3 Extracted MRM transitions for α-casein from skim milk powder
用同样方法对牛奶饼干、蛋黄派的夹心和外层均进行了提取蛋白质、酶解以及MRM 检测,由于实际样品中牛奶成分较少,导致部分离子对含量很低甚至无法检测。所以选择离子信号最强的离子对692.9/267.0作为定量离子对,得到以下提取离子流图(见图4)。

图4 各实际样品的MRM 提取离子流图(692.9/267.0)Fig.4 Extracted MRM transition(692.9/267.0)for α-casein in real samples
由所得谱图的峰面积,根据前面所得线性关系式计算实际含有α-酪蛋白的含量(见表3)。
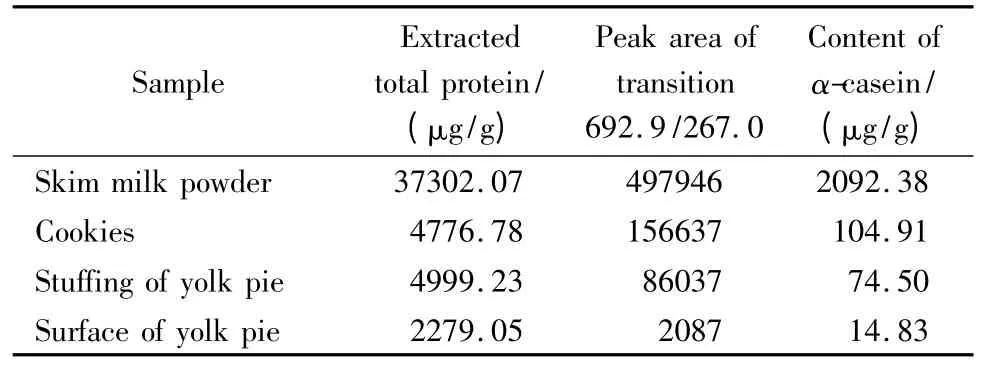
表3 MRM 法检测实际样品中α-酪蛋白的含量Table 3 Contents of α-casein in real samples
由实际样品结果可以看出奶粉中含有α-酪蛋白最多,而其余3种实际样品均含有α-酪蛋白,表明该食品生产过程中添加了牛奶或者奶粉。如果在包装上加以标明,则可以避免牛奶过敏者误食。
3 结论
本研究通过建立质谱MRM 方法,对牛奶蛋白质中的主要过敏原α-酪蛋白酶解肽段进行了分析。其最低检出限为0.5 mg/L。α-酪蛋白标准曲线在0.5~250 mg/L 范围内线性良好。该方法对于牛奶样品具有较好的特异性和灵敏度,并具有应用于其他过敏食品或过敏蛋白质的前景。该方法还可以推广至其他过敏原蛋白的研究,发展可以应用于多重食物过敏原的高灵敏检测技术。通过这一检测方法的建立,有助于解决我国食品安全中的过敏问题,并为制定我国食品过敏原标签管理奠定了一定的技术基础。
[1]Picariello G,Mamone G,Addeo F,et al.J Chromatogr A,2011,1218:7386
[2]Stevenson S E,Houston N L,Thelen J J.Regulatory Toxicology and Pharmacology,2010,58:S36
[3]Guo L,Huo G C,Zhang Y H.Food Science and Technology(郭鸰,霍贵成,张英华.食品科技),2007(4):262
[4]Zhang X,Wu D X,Liu G H,et al.Journal of Food Safety and Quality(张霞,吴冬雪,刘国红,等.食品安全质量检测学报),2012,3(4):290
[5]Zhang Z J,Mao L T,Xiang J J,et al.Food Science and Technology(张在军,毛露甜,向军俭,等.食品科技),2005(4):69
[6]Lange V,Picotti P,Domon B,et al.Molecular Systems Biology,2008,4:222.DOI:10.1038/msb.2008.61
[7]Picotti P,Rinner O,Stallmach R,et al.Nature Methods,2010,7:43
[8]Zhao Y,Jia W,Wang J F,et al.Anal Chem,2011,83:8802
[9]Whiteaker J R,Zhang H,Zhao L,et al.J Proteome Res,2007,6:3962
[10]Monaci L,Losito I,Palmisano F,et al.J Chromatogr A,2010,1217:4300
[11]van Hengel A J.Anal Bioanal Chem,2007,389:111
[12]Monaci L,Tregoat V,van Hengel A J,et al.Eur Food Res Technol,2006,223:149
[13]Mao L T,Xiang J J,Zhang Z J.Food Science(毛露甜,向军俭,张在军.食品科学),2007,28(5):305
[14]Heick J,Fischer M,Popping B.J Chromatogr A,2011,1218:938
[15]Ansari P,Stoppacher N,Rudolf J,et al.Anal Bioanal Chem,2011,399:1105
