应用质量源于设计的理念优化大鼠血浆中大黄蒽醌的分析方法
2013-07-13沈熊陆继伟梁健杨春欣吕迁洲
沈熊,陆继伟,梁健,杨春欣,吕迁洲*
(1.复旦大学附属中山医院药剂科,上海 200032;2.上海市食品药品检验所,上海 201203)
蒽醌类化合物为大黄主要有效成分[1],对其药代动力学的研究已有报道,其中血药浓度测定多采用高效液相色谱-紫外检测法(HPLC-UV)[2]、高效液相色谱-串联质谱法(HPLC-MS/MS)[3]或超高效液相色谱法(UPLC)[4]等;用高效液相色谱-荧光检测法(HPLC-FLD)测定大黄药材中蒽醌的方法已有文献报道[5],但用于测定血浆中大黄活性成分尚未见报道。HPLC-FLD 具有比HPLC-UV 灵敏度高、同时又比HPLC-MS/MS 成本低的优点。
质量源于设计(quality by design,QbD)是由美国食品和药品管理局(FDA)引入的概念,药品设计决定最终质量的理念已逐渐为业界所接受[6],并形成了与之对应的设计模式。其主要目的为:建立设计空间(即各种影响质量的关键因素及参数的范围组合和交互作用),并借此拓展出灵活的管理办法。QbD 理念最初主要用于药品制备的工艺设计,近年来,建立设计空间的概念已逐渐应用于色谱分析等领域[7-9]。鉴于此,本研究尝试采用QbD 理念,用Plackett-Burman 设计筛选影响色谱分离的主要因素,进而选用Box-Behnken 设计-响应面法优化测定大鼠血浆中5种大黄蒽醌的HPLC-FLD 方法。
1 实验部分
1.1 仪器、试药与动物
Waters 高效液相色谱仪(1525泵,2707自动进样器,1500柱温箱,2475荧光检测器,Breeze2色谱工作站)。对照品芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚均购自中国食品药品检定研究院,甲醇为色谱纯,实验用水为超纯水,其余试剂为分析纯。大黄蒽醌提取物为自制。
清洁级SD 大鼠,体重180~200 g,由复旦大学实验动物科学部提供,合格证号:SCXK(沪)2009-0019,实验前适应1周,大黄蒽醌提取物适量口服灌胃给药。
1.2 色谱条件
根据文献[1,5],采用Luna C18色谱柱(250 mm×4.6 mm,5μm,美国菲罗门公司),流动相由0.1%(v/v)磷酸水溶液和甲醇组成,等度洗脱,荧光检测激发波长为440 nm,发射波长为540 nm;根据实验设计,磷酸溶液pH 值为1.78~2.66,甲醇在流动相中的体积分数为78%~84%,流速0.8~1.2 mL/min,柱温25~35℃,进样体积10~30μL。
1.3 溶液的配制和血浆样品的预处理
混合对照品溶液:分别精密称取5种大黄蒽醌对照品适量至25 mL 容量瓶中,加甲醇溶解并稀释至刻度,置4℃冰箱中保存,作为贮备液。临用前分别吸取各贮备液适量置于同一100 mL 量瓶中,加甲醇稀释至刻度,即为大黄蒽醌衍生物的混合对照品溶液。
混合对照品血浆溶液:向大鼠血浆样品(200μL)中精密加入混合对照品溶液适量,漩涡混匀,即得。
血浆样品的预处理:根据文献[3],以3倍体积的甲醇沉淀血浆蛋白,漩涡混匀,以10000 r/min 离心5 min,取上清液转移至1.5 mL PE 管(聚乙烯管)中,在恒温水浴(40℃)氮气吹干。残渣加入50μL流动相,超声溶解,以5000 r/min 离心3 min,取上清液作为供试品溶液。
1.4 Plackett-Burman 实验设计
在预实验基础上,考察5个色谱因素对4个色谱响应值的影响。5个因素包括流动相中甲醇的体积分数、流速、柱温、磷酸溶液pH 值、进样体积,4个响应值为最先洗脱色谱峰(芦荟大黄素)和相邻杂质间的分离度(R1)和理论塔板数(n1)、最末洗脱峰(大黄素甲醚)的保留时间(tR5)以及大黄酸的拖尾因子(T2)。各因素及水平如表1所示。
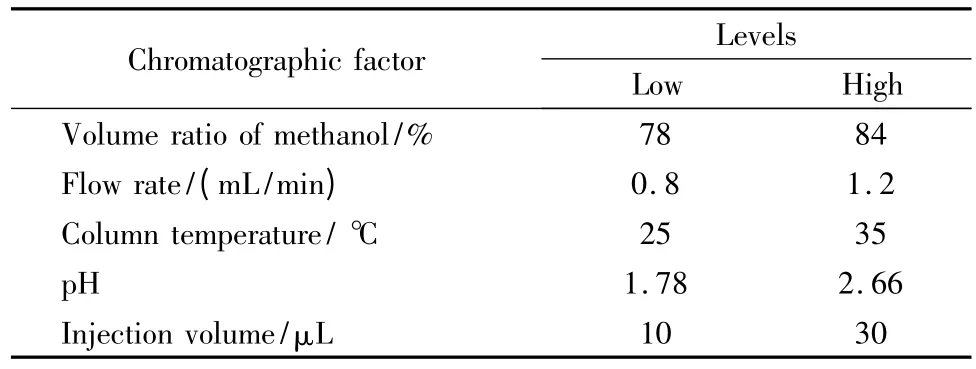
表1 Plackett-Burman 实验设计的色谱因素、水平及响应值Table 1 Chromatographic factors and response variables for Plackett-Burman experimental design
1.5 Box-Behnken 设计-响应面法优化HPLC 条件
保持以下色谱条件不变:进样体积20μL,激发波长440 nm,发射波长540 nm,0.1%(v/v)磷酸pH 值为2.20。选取流动相中甲醇含量、流速和柱温,分别记为A、B、C,进行Box-Behnken 实验,考察A、B、C 三因素对响应值R1、n1和tR5的影响。各因素取3水平,分别记为-、0、+,设计参数见表2。
2 结果和讨论
2.1 实验设计方法的选择
系统适用性是验证一个HPLC 系统正常运行、结果可靠的重要标准[10]。此外,溶剂用量、分析时间以及色谱柱使用寿命等也是分析工作者关注的事项[11]。分析工作者须对此作出综合评价和取舍。色谱柱类型、流动相组成等因素及其交互作用决定了这些指标的优劣。系统适用性等硬性指标必须符合要求,而溶剂消耗等指标又可以根据个人习惯灵活掌握,这充分符合QbD 理念。
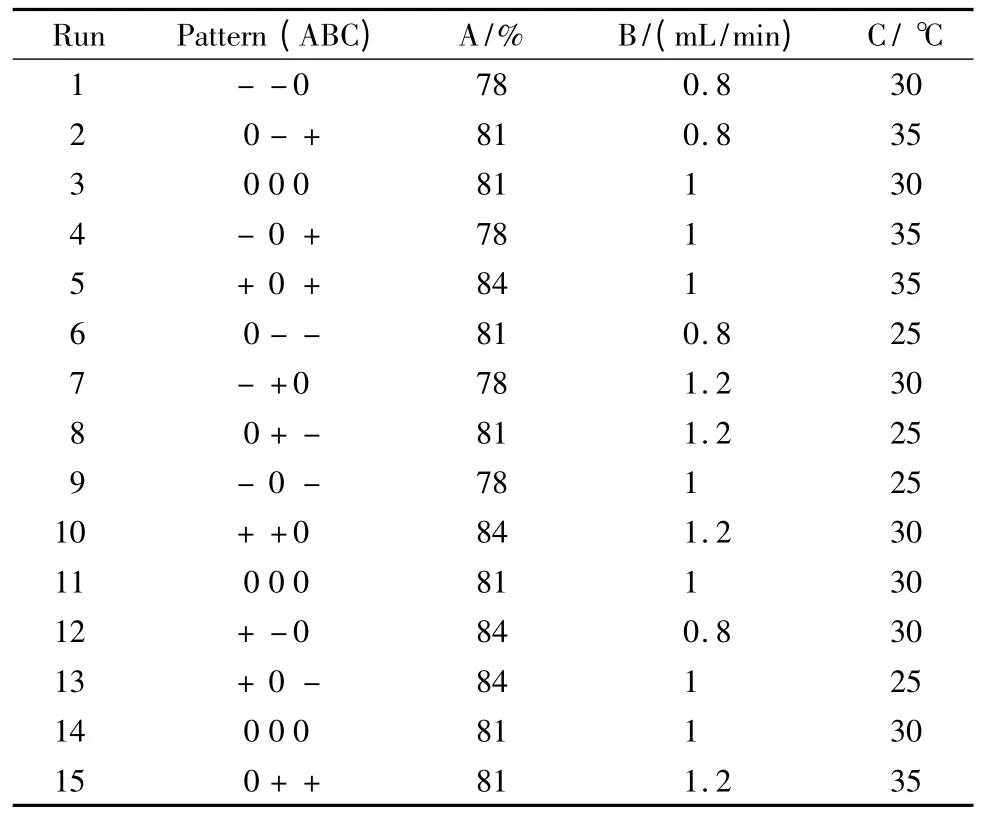
表2 Box-Behnken 优化实验设计的参数Table 2 Optimization parameters for Box-Behnken experimental design
传统的建立高效液相色谱分析的方法多采用单因素法[12,13],其缺点是试验次数多,且不能考察因素之间的交互作用。肖文军等[14]采用正交设计确定HPLC 方法,该方法可以考察因素间的相互作用,但正交设计是建立在因素和响应值呈线性关系的基础上,当二者呈非线性关系时,预测性会受到影响。
响应面法(response surface methodology,RSM)是近年来常用的集数学和统计学方法于一体的优化方法,该方法常结合实验设计来测定最优值[15]。最常用的实验设计为中心组合设计(central composite design,CCD)[8]和Box-Behnken 设计(BBD)[9],这些方法不仅可以考察因素间的交互作用,而且适合探索二次方程的响应面及二次多项式模型。其中BBD 实验次数较少,因此更为简便。同时,由于影响色谱系统的因素较多,因此有必要在响应面分析之前筛选出具有显著效应的因素。Plackett-Burman设计(PBD)被广泛地用于因素-主效应的估计,PBD可以利用最少的实验次数,快速而有效地筛选出对结果影响显著的因素[9]。因此,本研究采用PBD 筛选主要因素,并联用BBD 优化HPLC 方法。
2.2 预实验、考察因素及响应值的选择
本研究中流动相的磷酸溶液pH 值在1.78~2.66之间,普通HPLC 色谱柱的pH 适用范围在2~8之间,因此考察了可在pH 2以下使用的几种色谱柱,结合分离度、保留时间等指标,最终选用Luna C18色谱柱(250 mm×4.6 mm,5μm,美国菲罗门公司,pH 稳定性1.5~10)。
本研究涉及的各条件下,5种大黄蒽醌的出峰顺序依次为:芦荟大黄素、大黄酸、大黄素、大黄酚和大黄素甲醚,依次记为1~5,结构式见图1。随着流动相中甲醇体积分数的增大,化合物3的保留时间会迅速减小;当甲醇体积分数升高到85%时,化合物2和3的色谱峰出现部分重叠,其原因可能是由于化合物3含有3个羟基,当甲醇体积分数提高时,其与甲醇形成氢键的可能性也提高,从而加快了洗脱速率。以化合物3和2的分离度R3>1.5为标准,确定甲醇体积分数的最高水平为84%;又以化合物5的出峰时间<30 min 为标准,确定甲醇体积分数的最低水平为78%。
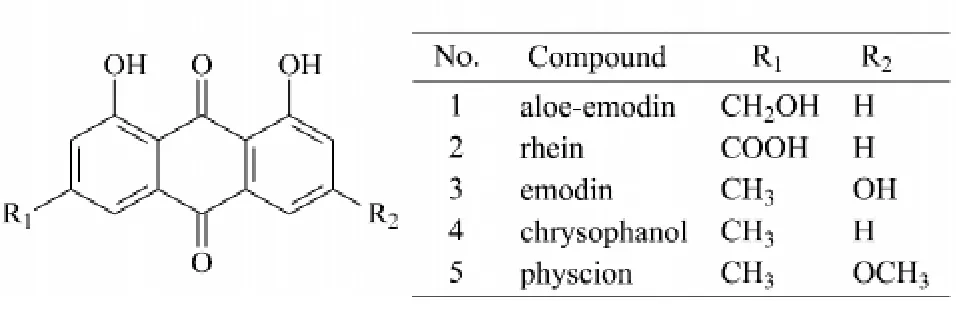
图1 5种测定物质的结构式Fig.1 Chemical structures of the five investigated compounds
根据文献[1],确定流动相中磷酸溶液的体积分数为0.1%,测得pH 约为2.20,因此分别取pH 1.78和2.66作为实验设计的“低”和“高”水平。
色谱系统的适用性试验通常包括理论塔板数、分离度、拖尾因子和重复性等4个参数[16],本研究选取前三者作为响应值。此外,分析时间也是分析工作者经常考虑的因素,缩短分析时间,可以节约溶剂和提高工作效率,因此选取最末洗脱峰的保留时间tR5作为第4个考察指标。
对于同时测定多个组分的色谱分析而言,考察每个组分对应的各响应值不仅工作量大,而且也没有必要。参考“木桶理论(Cannikin Law)[17]”并结合预实验,本研究选取每一类指标中“最弱”的一项进行考察,当该项指标符合要求时,则同类指标均能符合标准。本研究中,化合物1的理论塔板数n1最低,因此选取n1以考察理论塔板数;大鼠血浆中的极性成分会影响最先洗脱的化合物1的分离,而其他相邻组分在本文所述条件下分离度均大于1.5,因此选取化合物1和相邻杂质的分离度R1考察分离度;同理选取化合物2考察拖尾因子(T2)。
2.3 Plackett-Burman 实验设计
结果显示,具有显著意义(p<0.05)的色谱因素包括流动相中甲醇体积分数、流速和柱温。各因素对拖尾因子T2均无显著性影响(p >0.05),因此在接下来的实验中不再考察拖尾因子;流动相中甲醇体积分数对其他3个响应值的影响最为显著。
2.4 Box-Behnken 实验设计
选择R1、n1及tR5为响应值,对A、B和C 3个因素进行优化,建立因素和响应值关系的二次方程:Y=β0+β1A+β2B+β3C +β12AB +β13AC +β23BC +β11A2+β22B2+β33C2,其中Y 为响应值,βi代表不同的回归系数。应用统计分析软件Design Expert 7.0对数据进行多元回归和方差分析,结果如表3所示,可见因素A 对R1、n1和tR5均具有显著影响;因素B 对tR5、因素C 对R1也有显著影响。为简化方程求解,在保证拟合度的前提下,进行了相应的方程简化,在p<0.1水平上拒绝无显著相关的项目后,诸响应值与实验因素的拟合方程列于表4。
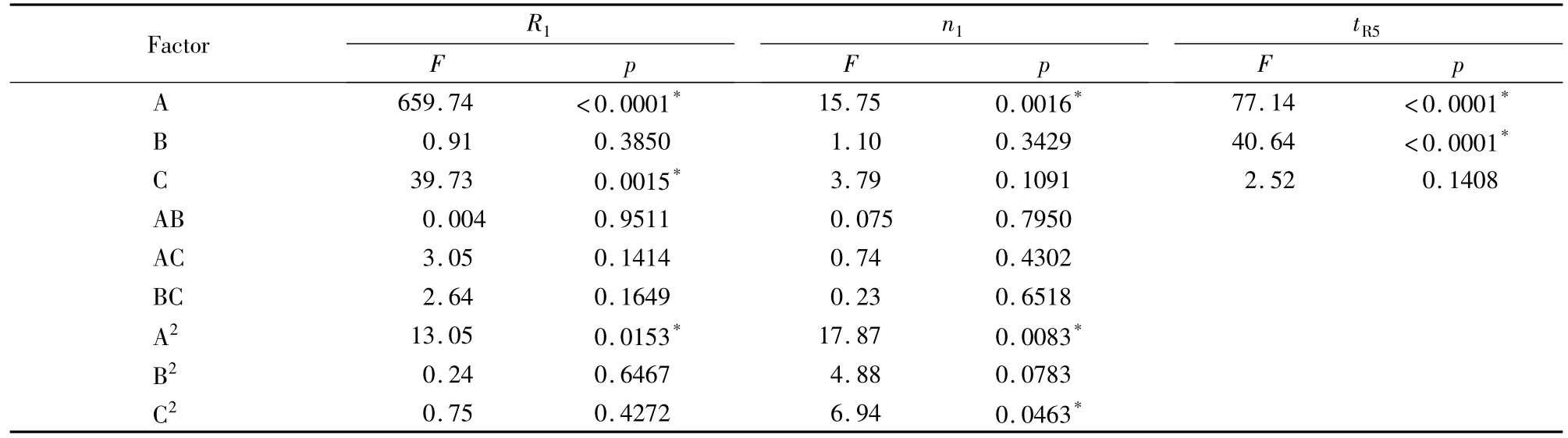
表3 Box-Behnken 设计的方差分析结果Table 3 Analysis of variance(ANOVA)results for Box-Behnken design

表4 Box-Behnken 设计的响应模型和统计参数Table 4 Response models and statistical parameters obtained from ANOVA for Box-Behnken design
建立响应面和等高线图(图2)以直观分析各因素及其相互作用对响应值的影响。等高线图中曲线的弯曲程度反映模型的非线性程度。结果显示,当柱温恒定时,流动相中甲醇体积分数增大,R1呈近似线性的下降,而流速对R1影响不明显;tR5随甲醇体积分数和流速的增大呈线性下降;结合表4,各因素对n1的影响呈二次多项式模式,而因素间的交互作用对其影响不显著(p >0.05)。
用Derringer 渴求函数(desirability function)评价各响应值的综合作用,其公式如下:
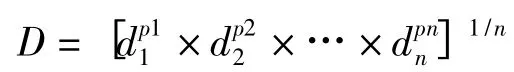
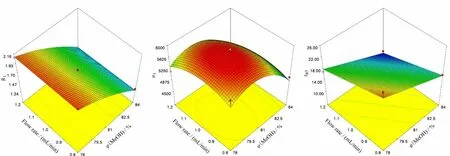
图2 各考察因素对响应值影响的响应面(3D)和等高线图Fig.2 Response surfaces(3D)and contour plots showing the effects of examined factors on responses
其中,pi 为响应值的权重,本文权重取1,n 为响应值的数目,di为单个响应值的渴求函数。D 值在0~1之间;D 值越接近1则说明所确定的最优条件越接近全局最优条件。本研究设响应值目标为:n1>3000,R1>1.5,tR5取最小值,利用Design-Expert 7.0软件整合渴求函数计算的功能,得最大化总体渴求值(D)为0.81,相对文献[1]提高了19.1%。因素的最佳水平组合为:流动相中甲醇体积分数为81.4%,等度洗脱,流速为1.1 mL/min,柱温为31℃。取供试品溶液按照最优条件重复进样6次,考察实测值与预测值的偏差,结果显示偏差不超过5%,表明模型具有良好的预测性。
2.5 验证性实验
在优化的色谱条件下,考察了方法的系统适用性。各色谱峰均能得到有效分离,见图3。大鼠经大黄提取物给药后,血浆中能测到化合物1~4,其中化合物2浓度最高,而化合物5的浓度低于检出限(LOD),与文献[3]报道一致。首先出峰的化合物1与杂质峰的分离度不小于1.5;理论塔板数按化合物1计不低于3000。同一供试品溶液重复进样6次,5种化合物峰面积的日内精密度(RSD)不超过2.1%。制备各被测物质的标准曲线,其线性方程、相关系数(r)、LOD(S/N=3)及线性范围见表5。
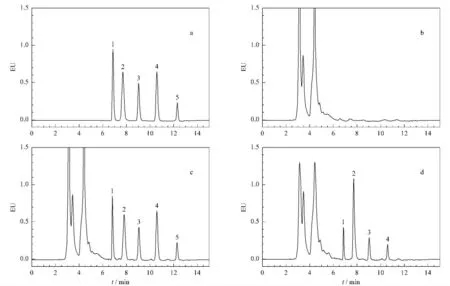
图3 (a)5种大黄蒽醌混合对照品溶液、(b)大鼠空白血浆溶液、(c)大鼠空白血浆加对照品溶液及(d)大鼠经大黄提取物给药后血浆溶液的色谱图Fig.3 Chromatograms of(a)the mixed standards,(b)a blank plasma,(c)a plasma sample spiked with the mixed standards,and(d)a plasma sample after administration of rhubarb extract
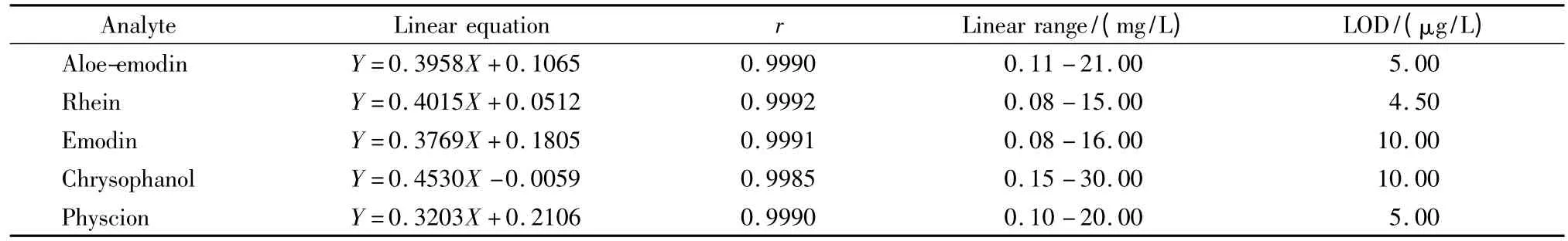
表5 血浆样品中5种测定物质的标准曲线、相关系数、线性范围及检出限(n=5)Table 5 Linear equations,correlation coefficients(r),linear ranges,and limits of detection(LODs)of the five analytes in plasma sample(n=5)
3 结论
应用质量源于设计原理,采用实验设计的方法,建立并优化高效液相色谱-荧光检测法测定大鼠血浆中大黄蒽醌的方法。该方法准确可靠,通过实验设计建立的模型具有良好的预测性,表明质量源于设计理念和实验设计的方法可有效地应用于优化高效液相色谱分析方法。
[1]The Pharmacopoeia Committee of the People’s Republic of China.Pharmacopoeia of People’s Republic of China.Part 1.Beijing:China Medical Science Press(国家药典委员会.中华人民共和国药典:一部.北京:中国医药科技出版社),2010:22
[2]Wang P,Miao S Y,Meng X L,et al.Pharmacology and Clinics of Chinese Materia Medica(王平,缪舒益,孟宪丽,等.中药药理与临床),2009,25(5):47
[3]Song R,Xu L,Xu F,et al.J Chromatogr A,2010,1217(45):7144
[4]Li J,Li H L,Xu S.Chinese Journal of Experimental Traditional Medical Formulae(李佳,李红磊,许珊.中国实验方剂学杂志),2011,17(10):94
[5]He D X,Chen B,Tian Q Q,et al.J Pharm Biomed Anal,2009,49:1123
[6]The International Conference on Harmonisation of Technical Requirements for Registration of Pharmaceuticals for Human Use(ICH).Harmonised Tripartite Guideline,Q8,Pharmaceutical Development,Current Step 4 Version.(2009-08).http://www.ich.org/fileadmin/Public_Web_Site/ICH_Products/Guidelines/Quality/Q8_R1/Step4/Q8_R2_Guideline.pdf
[7]Monks K E,Rieger H J,Molnár I.J Pharm Biomed Anal,2011,56:874
[8]Hadjmohammadi M,Sharifi V.J Chromatogr B,2012,880:34
[9]Awotwe-Otoo D,Agarabi C,Faustino P J,et al.J Pharm Biomed Anal,2012,62:61
[10]Sun G X,Wu B,Bi K S.Chinese Journal of Chromatography(孙国祥,吴波,毕开顺.色谱),2010,28(9):877
[11]Lu J,Pang Y J,Li Y B,et al.Chinese Journal of Chromatography(陆军,庞燕军,李彦博,等.色谱),2012,30(6):641
[12]Tang X F,Zhen Q N,Fan Z M,et al.Chinese Journal of Chromatography(唐秀芳,甄乾娜,樊子勉,等.色谱),2012,30(6):613
[13]Zhang X X,Xiao Z Y,Zhang H Y,et al.Chinese Journal of Chromatography(张晓旭,肖志勇,张红艳,等.色谱),2012,30(8):792
[14]Xiao W J,Li Q,Xiong X Y,et al.Chinese Journal of Analytical Chemistry(肖文军,李勤,熊兴耀,等.分析化学),2011,39(9):1459
[15]Hibbert D B.J Chromatogr B,2012,910:2
[16]The Pharmacopoeia Committee of the People’s Republic of China.Pharmacopoeia of People’s Republic of China:Part 1.Beijing:China Medical Science Press(国家药典委员会.中华人民共和国药典:一部.北京:中国医药科技出版社),2010:Appendix VI D,Appendix 36
[17]Tao R.Chongqing Medicine(陶蓉.重庆医学),2011,40(26):2699
