结直肠癌组织中K-ras 基因突变的毛细管电泳检测
2013-07-13石冬琴王荣谢华田薇贾正平郭建魁
石冬琴,王荣*,谢华,田薇,贾正平*,郭建魁
(1.全军高原损伤防治重点实验室,兰州军区兰州总医院临床药理基地,甘肃兰州 730050;2.浙江农林大学林业与生物技术学院,浙江临安 311300)
K-ras 基因是ras 基因家族中3种癌基因的一种,为表皮生长因子受体(epidermal growth factor receptor,EGFR)信号传导通路的下游基因,与结直肠癌关系密切[1]。我国大肠癌发病率已占到常见肿瘤的第四位,且发病率已达5%,高于2%的国际水平;每年新发病例约40万,其中30~40岁的中年人居多。各个国家和地区的结直肠癌中K-ras 基因突变率并不相同,欧美为30%~68%[2,3],而中国为14%~43.8%[4,5]。K-ras 基因最常见的激活方式是点突变,其中90%发生在第一外显子的第12、13位密码子上,其中70%发生于第12位密码子,30%发生于第13位密码子[6];极少文献报道第19、61、63位密码子发生突变。第12、13位密码子常用的检测方法主要有DNA 测序[7]。根据结直肠癌患者中Kras 基因是野生型还是突变型,将传统意义上的一种疾病分成两种独立的疾病进行治疗。结直肠癌患者中K-ras 基因为突变型的约占40%,而其余60%左右的K-ras 基因为野生型,目前临床治疗中抗EGFR靶向药物对K-ras 野生型大肠癌患者疗效显著,而对突变型无效,如不加区分采取同一种药物治疗将会增加不良反应风险和治疗费用。因此,对K-ras突变类型的检测[7-13],可以筛选出抗EGFR 靶向药物治疗有效的大肠癌患者,实现肿瘤病人的个体化治疗,从而达到良好的预后,延长患者生存期。临床统计分析发现,大肠原发病灶的患者手术后5年复发转移率较高,即病情分期越晚者复发转移的风险越高。早期检测K-ras 基因,可早期治疗,从而有效降低病人复发转移的风险。因此,检测K-ras 基因第12/13位密码子的突变情况,对于结直肠癌的临床早期诊断、治疗和预后有重要意义。
本实验采用毛细管电泳-激光诱导荧光检测(CE-LIF)结合单链构象多态性(SSCP)技术,采用作者所在课题组已建立的CE-SSCP 方法检测了临床结直肠癌手术标本和经福尔马林固定石蜡包埋(FFPE,formalin-fixed and paraffin-embedded)同一组织标本中K-ras 基因第12/13位密码子突变,并应用DNA 直接测序法进行验证,其结果可为结直肠癌的临床诊断和治疗提供科学理论依据。
1 实验部分
1.1 仪器、试剂与材料
P/ACE System5000型毛细管电泳仪、P/ACE System5000 station 数据处理软件、P/ACE System laser module 488 nm 激光检测器(美国Beckman 公司);石英毛细管柱(河北永年光导纤维厂);DYY-8C 型电泳仪、DYCZ-24E 型电泳槽(北京市六一仪器厂);AE240型电子天平(瑞士Mettler 公司);高速离心机(德国Heraeus 公司);PCR 扩增仪(杭州晶格科学仪器有限公司)。
聚环氧乙烷(PEO,Mr=300000)、四甲基乙二胺(TEMED)、过硫酸铵(APS)、丙烯酰胺(国药集团化学试剂有限公司),γ-甲基丙烯酰基-三(甲氧基)硅烷(MAPS)(Johson Matthey 公司),三羟甲基氨基甲烷(Tris,上海山浦化工有限公司),硼酸、乙二胺四乙酸二钠(EDTA)(天津化学试剂厂),SanPrep柱式PCR 产物回收试剂盒SK8142、Taq DNA 聚合酶、PCR 试剂、DNA Marker-B GM331、6× Loading Dye Solution SD8314、pUC19 DNA/Msp I(Hpa II)Marker(上海生工生物工程技术服务有限公司),Golden View 核酸染料、核酸染料SYBR Green Ⅰ(10000×,50μL/支;厦门百维信公司),以上试剂均为分析纯。
0.5× Tris-硼酸(TBE)缓冲液成分:0.045 mol/L Tris-硼酸+0.001 mol/L EDTA;1×Tris-乙酸(TAE)缓冲液成分:0.04 mol/L Tris-乙酸+0.001 mol/L EDTA。
样品测序由上海生工生物工程技术服务有限公司完成。
结直肠癌及癌旁正常组织样本(包括临床手术后组织和经FFPE 处理的同一组织)共76例152个样本,其中男53例,女23例,年龄20~84岁,平均年龄(65±2)岁。所有标本取自兰州军区兰州总医院病理科,结直肠部切除组织并经病理切片证实,其中高分化腺瘤6例,中分化腺瘤46例,低分化腺瘤13例,黏液腺瘤11例。
1.2 实验步骤
1.2.1 DNA 提取
结直肠癌及癌旁正常组织的DNA 提取:用扭力天平称取结直肠癌及癌旁正常组织40 mg,剪碎匀浆后加入蛋白酶-K 消化,采用传统的酚-氯仿法提取基因组DNA。采用紫外分光光度计对提取的基因组DNA的纯度和浓度进行检测,在260、280 nm波长下的光密度D的比值(D260/D280)为1.7~1.9,符合DNA 检测要求。于-20℃下保存待用。
FFPE 组织标本的DNA 提取:用电子天平称取石蜡切片20~25 mg,放入2 mL的无菌离心管中。首先对其进行脱蜡:加入1 mL的二甲苯充分摇匀,于3000×g 下离心2 min,弃去上清液;加入1 mL无水乙醇混匀,于3000×g 下离心2 min,弃去上清液,再重复脱蜡一次;然后依次用100%、95%和75%的乙醇各1 mL 洗至沉淀为松散的白色。脱蜡完全后的组织由原来的粉红透明状变为松散的白色沉淀状。然后对其进行消化:将脱蜡后的组织放入37℃温箱中15~30 min,待乙醇挥发干净后,加入200μL的STE 溶液(100 mmol/L Tris-HCl(pH 8.0),20 mmol/L EDTA,8 g/L SDS),于90℃水浴锅中加热10 min 后,加入20 g/L 蛋白酶-K,在55℃水浴中加热3 h 以上直至絮状物消失。于3000×g下离心1 min,取上清液,采用传统的酚-氯仿法提取基因组DNA,D260/D280值为1.7~1.9,于-20℃下保存待用。
1.2.2 K-ras 基因的PCR 扩增及纯化
所选引物为文献[14]中所述的K-ras 基因第一外显子第12/13位密码子所需特异性引物,上游引物:5'-AGGCCTGCTGAAATGACTGAATA-3,下游引物:5'-CTGTATCAAAGAATGGTCCTGCAC-3。扩增产物长度约184 bp。PCR 反应体系为25μL,其中含dNTP 200μmol/L、引物0.05μmol/L、Taq 聚合酶5 U/μL、模板DNA 0.5μg。PCR 反应循环条件:94℃变性30 s,59.6℃退火30 s,72℃延伸30 s,共行30个循环。由于扩增过程中产生的引物二聚体以及dNTP、引物、镁离子等会影响分析结果,本实验采用SanPrep 柱式PCR 产物回收试剂盒纯化PCR扩增产物。
1.2.3 琼脂糖凝胶电泳检测
取纯化后PCR 扩增产物5μL,加入1μL 6×蛋白上样染料溶液(Loading Dye Solution)进行2%琼脂糖凝胶电泳检测。电泳缓冲液为1×TAE 缓冲液(pH 8.5),用Golden View 核酸染料染色,并用凝胶成像分析系统照相和分析结果。
1.2.4 CE-SSCP 检测
根据文献[15]的方法涂层毛细管柱(37 cm ×75μm,有效长度27 cm)。取5μL PCR 产物加入纯水20μL,95℃变性15 min,立即在冰浴中放置5 min,于3000×g 下离心10 s。向25μL 经变性处理的样品中加入5μL SYBR GreenⅠ并混合均匀,在10 kV电压下负极电动进样15 s,采用课题组已建立的以3% PEO 为筛分介质分离pUC19 DNA/Msp I(Hpa II)Marker的最佳分离条件,对结直肠癌临床手术直接取用组织和FFPE 组织标本中的K-ras 基因的第12/13位密码子的突变情况进行检测。
1.2.5 DNA 测序分析
用ABI-PRISM 3730测序仪测序验证经CE-SSCP 检测的样品。
2 结果与讨论
2.1 pUC19 DNA/Msp I(Hpa II)Marker 最佳分离条件
采用课题组已建立的CE 分离pUC19 DNA/Msp I(Hpa II)Marker的最佳条件[15]:筛分介质PEO的含量为3%、缓冲液TBE的pH 8.3、电压15 kV、温度15℃。CE 分离结果如图1所示:共得到11个峰,基本达到基线分离,15 min 内达到完全分离。表明建立的方法具有分离快速、分离度良好的优点。
2.2 琼脂糖凝胶电泳结果
2%琼脂糖凝胶电泳分析纯化的扩增产物,结直肠癌组织及癌旁正常组织的电泳扩增结果见图2。如图2可见,扩增获得了纯度较高的目的产物。
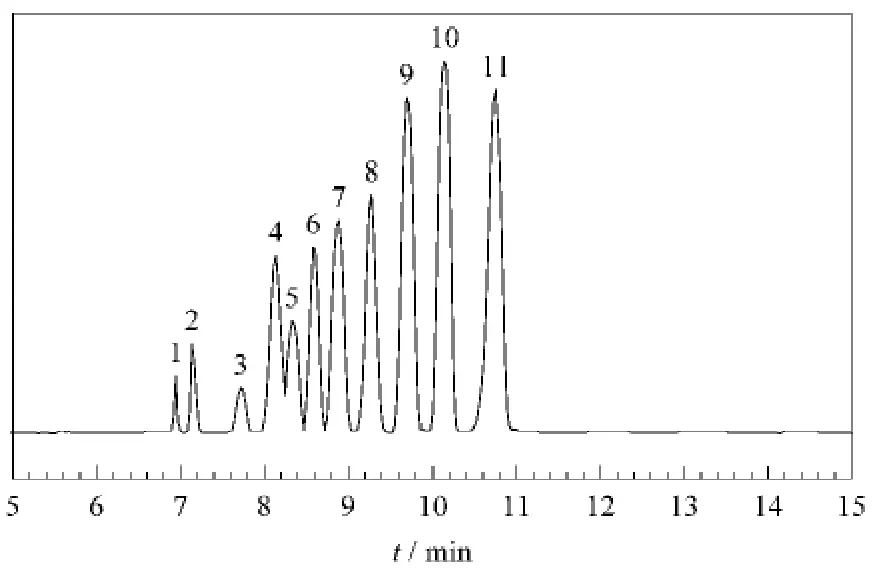
图1 毛细管电泳分离pUC19 DNA/MspⅠ(HpaⅡ)Marker Fig.1 Electropherogram of pUC19 DNA/MspⅠ(Hpa Ⅱ)Marker separation by CE

图2 琼脂糖凝胶电泳检测PCR 扩增产物的谱图Fig.2 Electropherogram of PCR amplification by AGE
2.3 CE-SSCP 结果
SSCP 分析的原理是基于单链DNA 具有不同的构象,DNA 链上单个碱基的变化会引起其构象的变化,构象不同则电泳淌度随之改变,通过电泳将构象上有差异的单链分离。临床手术所取样品按照1.2.4节的条件处理,获得变性样品,经CE-LIF 检测分析,结果见图3。图3a 为结直肠癌旁正常组织扩增变性样品,图3b 为结直肠癌组织扩增变性样品。比较上述两图,发现结直肠癌组织中除有正常样品的野生型单链DNA 外,还存在有异常单链DNA,即结直肠癌K-ras 基因第12/13位密码子突变样本中除具有野生型DNA 变性后会有的两个单链DNA 外,还存在突变基因变性后的两条单链DNA。因此,可通过癌旁正常组织(图3a)的电泳谱图(作为野生型标准对照谱图)判读癌组织突变型(图3b)的K-ras 基因第12/13位密码子的突变是否发生。
FFPE 组织标本和临床手术直接取用组织样品的检测结果一致。
通过CE-LIF 检测各类组织样品,证实所建立的方法可有效地检测结直肠癌K-ras 基因第12/13位密码子的突变。

图3 CE-SSCP 检测变性(a)结直肠癌旁正常组织和(b)结直肠癌组织的DNA 电泳图Fig.3 Electropherograms of degenerated DNA samples of(a)normal tissue and(b)colorectal cancer tissue by CE-SSCP
2.4 测序结果
为进一步确认CE-LIF 检测的样本发生突变的类型,对相应样本进行了测序分析。测序结果显示,K-ras 基因突变为单个碱基点突变,即K-ras 基因第12位密码子主要突变类型有GGT→GAT、GGT→GCT和GGT→CGT;第13位密码子主要突变为GGC→GAC,其中以碱基G 替换为碱基A(G→A)的点突变为主。
2.5 临床样本K-ras 基因突变结果
分别对76例患者临床手术切除组织获得的癌组织及癌旁组织共计152个样本进行K-ras 突变基因第12、13位密码子检测,经CE-LIF 检测和基因测序,表明CE-SSCP 检测和基因测序结果一致,K-ras基因第12、13位密码子突变类型见表1。
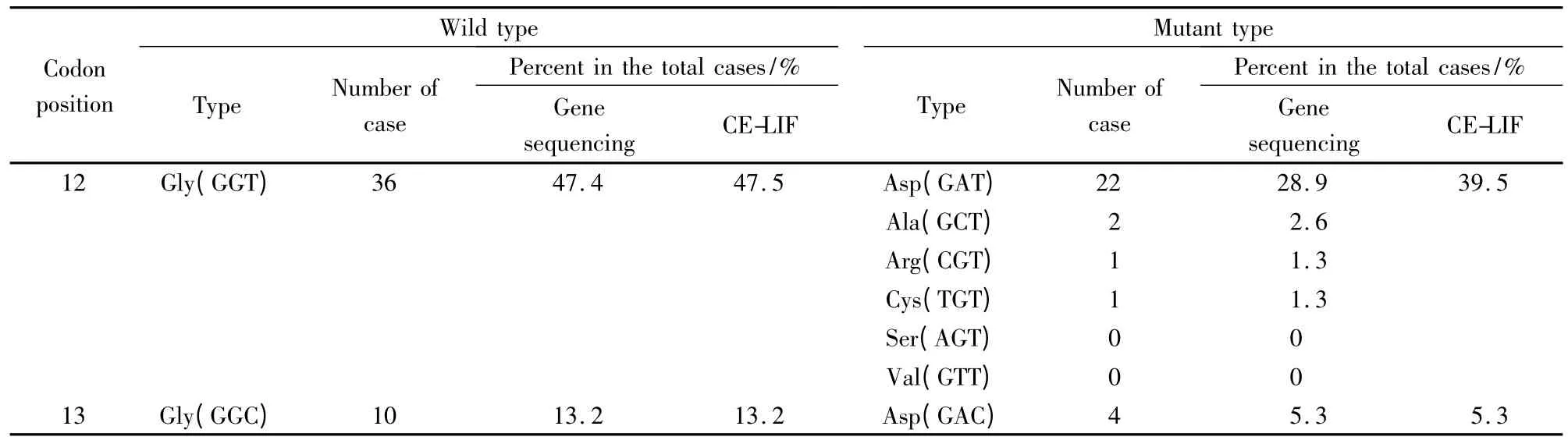
表1 76例患者中K-ras 基因第12、13位密码子突变类型的CE-LIF 检测和基因测序结果Table 1 Results of codons 12 and 13 mutation type of K-ras in the 76 cases by CE-LIF and gene sequencing
3 结论
采用课题组已建立的方法[15]检测了76例结直肠癌患者组织中K-ras 基因第12/13位密码子突变情况,结果显示30例发生突变,突变率为39.5%(30/76),该结果与文献报道中国的结果(14%~43.8%)[4,5]一致。结直肠癌患者中K-ras 基因的高突变率,表明K-ras 基因突变在结直肠癌的发生及发展中有重要作用。基因突变常以碱基的缺失、插入、替代为主,从而引起癌基因的激活与抑癌基因的失活。本研究通过直接测序证实,K-ras 基因碱基发生点突变,以碱基G 替换为碱基A 为主要突变类型,其中第12位密码子GGT 突变为GAT的突变率为28.9%(22/76),第13位密码子GGC 突变为GAC的突变率为5.3%(4/76)。与以往文献报道的中国人K-ras 基因突变以第12位密码子(GGT→GAT)多见[4]的结果一致。
尽管已有文献[16]报道采用CE 方法对K-ras 基因进行了检测,但本研究结果证实,作者所在课题组所建立的以3%PEO 为筛分介质的CE-SSCP 分析方法可以在11 min 内分离pUC19 DNA/Msp I(Hpa II)Marker 11个DNA 片段及4个单链DNA(ssDNA),较文献报道的以6%线性聚丙烯酰胺为筛分介质的CE 方法分离时间短,且多次检测证实分析条件稳定。
近年来,靶向药物的出现为结直肠癌的治疗带来了希望,但治疗效果与K-ras 基因突变与否有密切的关系,因此K-ras 基因突变与抗结直肠癌治疗效果的相关性受到人们的重视,K-ras 基因突变的检测在治疗及预后方面有重要意义。同时,K-ras 基因突变的检测有助于实现肿瘤治疗的个体化,不仅可以提高药物疗效,减轻患者病痛,而且能够减少患者经济负担和医疗支出。此外,CE-SSCP 法与直接基因测序法相比,具有操作简单、运行成本低、不需要设计检测探针的优点,可用于临床批量检测。
[1]Ciardiello F,Tortora G.N Engl J Med,2008,358:1160
[2]Halatsch M E,Hirsch-Ernst K I,Weinel R J,et al.Anticancer Res,1998,18:2323
[3]Doolittle B R,Emanuel J,Tuttle C,et al.Exp Mol Pathol,2001,70(3):289
[4]Yuan P,Sun M H,Zhang J S,et al.Chinese Journal of Clinical and Experimental Pathology(袁平,孙孟红,张锦生,等.临床与实验病理学杂志),2000,16(6):464
[5]Tang W Z,Gao F,Li W,et al.Tumor(唐卫中,高枫,李卫,等.肿瘤),2006,26(3):282
[6]Frattini M,Saletti P,Romagnani E,et al.Brit J Cancer,2007,97(8):1139
[7]Patil D T,Fraser C R,Plesec T P.Curr Oncol Rep,2010,12:160
[8]Khamvata-Ford S,Garrett C R,Meropol N J,et al.J Clin Oncol,2007,25(22):3230
[9]Jonker D J,O'Callaghan C J,Karapetis C S,et al.N Engl J Med,2007,357(20):2040
[10]Qiu L X,Mao C,Zhang J,et al.Euro J Cancer,2010,46(15):2781
[11]Ciardiello F,Tortora G.N Engl J Med,2008,358:1160
[12]Sameer A S,Chowdhri N A,Abdullah S,et al.Indian J Cancer,2009,46:219
[13]Yen L C,Uen Y H,Wu D C,et al.Ann Surg,2010,251:254
[14]Jhawer M,Gosl S,Wilson A J,et al.Cancer Res,2008,68(6):1953
[15]Liu Y Y,Wang R,Jia Z P,et al.Acta Chimica Sinica(刘圆圆,王荣,贾正平,等.化学学报),2009,67(4):323
[16]Shi X Z,Li J H,Zhao C X,et al.Chinese Journal of Analytical Chemistry(石先哲,李建华,赵春霞,等.分析化学),2005,33(2):177
