应用胶乳凝集技术诊断番鸭小鹅瘟病
2012-08-30朱小丽陈少莺林锋强程晓霞陈仕龙黄梅清李兆龙
朱小丽,陈少莺,林锋强,程晓霞,陈仕龙,黄梅清,王 劭,李兆龙
(福建省农业科学院畜牧兽医研究所福建省畜禽疫病防治工程技术研究中心,福建福州 350013)
番鸭小鹅瘟病是1997年以来在福建省莆田、福清等番鸭饲养区出现的番鸭疫病,其病原为鹅细小病毒(Goose parvovirus,GPV),临床主要表现为不同程度腹泻、部分病番鸭肠粘膜脱落形成栓塞,发病率50%~70%、病死率40%~65%,给养鸭业造成严重的经济损失[1-3]。而且该病与番鸭细小病毒病在流行病学、临床症状和病理变化相似,两者在血清学上有交叉反应,临床上难于鉴别诊断,常被基层兽医误诊为番鸭细小病毒病[4-7]。因此建立鉴别诊断番鸭小鹅瘟病的快速诊断试剂至关重要。胶乳凝集方法(LPA)具有操作简便、快速和判定直观等优点,适于基层兽医防疫部门及专业户用做临床诊断、流行性病学调查。本研究根据程由铨等制备GPV胶乳的方法[4],应用抗番鸭源GPV单克隆抗体(GPV-MAb-D11)致敏聚苯乙烯胶乳,研制出GPV乳胶试剂,建立了LPA的检测方法。
1 材料和方法
1.1 病毒株与抗体 番鸭源GPV-PT(对番鸭胚成纤维细胞TCID50为10-5.0/0.1 ML)、番鸭呼肠孤病毒(MDRV)、新型鸭呼肠孤病毒(MDRV)、番鸭细小病毒(MPV)、鸭源副黏病毒(PMV)和鸭肝炎病毒(DHV)及其相应血清均由本实验室分离鉴定并保存;抗番鸭源GPV MAb(GPV-M cAb-D11)由本实验室制备。
1.2 主要试剂及实验动物 10%聚苯乙烯胶乳购自Sigma公司;牛血清白蛋白(BSA)和甘氨酸(GBS)购自厦门泰京生物技术有限公司;基因组DNA提取试剂盒购自天根生化科技(北京)有限公司;PCR试剂购自Fermentas公司;健康番鸭购自莆田广东温氏家禽有限公司。
1.3 抗原制备 将12日龄发育正常的番鸭胚尿囊腔接种GPV-PT种毒0.1 ML/胚,37℃培养,每日观察2次,收获接种后48 h~120 h死亡胚胚液,3 000 r/min离心10 Min,取上清液加入甲醛至终浓度为0.1%,37℃灭活24 h后即为GPV抗原,4℃~8℃保存。同理制备 MDRV、MPV、PMV和DHV抗原。
1.4 抗体浓度的测定 按考马斯亮蓝法测定抗体蛋白质浓度,分装,-20℃以下保存。
1.5 胶乳致敏 将10%聚苯乙烯胶乳用pH8.2 GBS缓冲液稀释至1%,6 000 r/min离心5min,弃上清液,沉淀用GBS重悬至原体积,加入等体积GPV-MAb-D11,混和后,37℃水浴感作40 Min,以含1%BSA的GBS洗2次,6 000 r/min离心5min,沉淀重悬于0.1%BSA-GBS,乳胶终浓度为1%,按总量加入叠氮钠至终浓度为0.025%,共制备5批胶乳试剂(批号为0901~0905)。
1.6 LPA试验 将10μL待检样品与等量致敏胶乳在洁净玻片上混匀,37℃水浴15min,观察凝集反应,同时设致敏胶乳对照、GPV阳性对照和PBS阴性对照。结果判定:++++:1 Min~3 min内出现粗大凝集块,液体澄清;+++:形成较大的凝集块,并且液体澄清;++:50%胶乳凝集,颗粒明显,液体较澄清;+:少量胶乳凝集,液体较浑浊;阴性:无颗粒凝集,液体呈均匀乳状。以出现“+”以上凝集判为阳性;以出现“+”凝集的抗原最高稀释度的倒数为抗原凝集价。
1.7 LPA特异性测定 将2批胶乳试剂分别与GPV、MPV、MDRV、NDRV、PMV、DHV和正常培养液、组织悬液进行LPA试验,评价其特异性。
1.8 LPA敏感性测定 将2批胶乳试剂分别与不同浓度的GPV抗原进行LPA试验,测定其LPA检测最小蛋白量,评价其敏感性。
1.9 LPA重复性 3批胶乳试剂与GPV抗原分别进行3次效价测定,评价其批内和批间重复性。
1.10 LPA试剂保存期测定 将5批乳胶试剂置于4℃保存,每隔1个月与特异性抗原进行LPA试验,测定其保存期。
1.11 LPA与PCR符合率的比较 2日龄健康番鸭经腿肌人工感染GPV-PT 0.2m L/羽,同时设健康对照隔离饲养,于感染后3 d、5 d、7 d各迫杀3羽,取肝、脾、胰、肾组织制作匀浆,进行GPV抗原检测:(1)LPA检测:匀浆中加入等体积氯仿振荡3m in~5 min,以6 000 r/m in离心15 Min,取水相进行LPA检测;(2)PCR检测:取匀浆提取DNA,按照参考文献[7]进行PCR检测,比较LPA和PCR的符合率。
1.12 临床疑似病例检测 收集临床疑似番鸭小鹅瘟病例18例,取肝、脾、胰、肾组织制作匀浆进行LPA和PCR检测,比较LPA和PCR的符合率。
2 结果
2.1 MAb致敏浓度的筛选 MAb致敏胶乳的蛋白浓度为0.5 mg/mL时,LPA试验凝集颗粒较大,液体较澄清,凝集反应时间20 Min,抗原凝集价最高为25;蛋白浓度为0.2 g/mL时,LPA试验凝集颗粒大而清晰,液体清亮,凝集反应时间15 min,抗原凝集价最高为25;蛋白浓度为0.1 mg/mL时,LPA试验凝集颗粒较小,液体混浊,凝集反应时间为35m in;抗原凝集价最高为23;蛋白浓度为0.05mg/mL时LPA试验无凝集。结果表明MAb最佳致敏浓度为0.2mg/mL。
2.2 LPA特异性试验 0901批和0902批胶乳试剂只与GPV反应产生特异性凝集反应,凝集颗粒大而清晰,液体清亮不与 MPV、MDRV、NDRV、PMV、DHV和正常培养液、正常组织悬液发生特异性凝集反应,表明胶乳试剂特异性好。
2.3 LPA敏感性 0901批和0902批胶乳试剂分别与不同毒价的GPV抗原进行LPA试验,当GPV毒价为 104、5 000、2 500、1 500、1 000 TCID50时均可以产生特异性凝集颗粒,而当GPV毒价为500、100 TCID50时,LPA检测为阴性。结果表明LPA可以检出GPV毒价最低为1 000 TCID50,胶乳试剂敏感性高(表 1)。

表1 LPA方法的敏感性Table 1 Sensitivity of the LPA method
2.4 LPA重复性试验 将0901、0902和0903批胶乳试剂与GPV胚液和病鸭肝脾组织悬液分别进行3次效价测定,结果均分别为26和22。表明胶乳试剂批内和批间重复性良好。
2.5 LPA保存期试验 5批次乳胶试剂在4℃保存11个月效价不变,均可以达到26,12个月时效价开始下降,14个月时降为21,表明胶乳试剂4℃保存11个月内质量稳定(表2)。

表2 乳胶试剂的保存期测定Table 2 Determ ination of the Latex reagent storage period
2.6 LPA方法检测人工感染番鸭 人工感染GPV-PT株番鸭肝、脾组织匀浆经氯仿抽提后,能与乳胶试剂产生肉眼可见的特异性凝集颗粒,而对照组健康番鸭肝、脾组织匀浆均无凝集反应,与PCR比较,总符合率达93.3%(表3)。同时,番鸭人工感染后3 d即可以在组织匀浆中检出GPV抗原,而此时感染鸭尚未表现出临床症状,因此应用乳胶试剂建立的LPA方法可以为该病的早期诊断提供一种新手段。
2.7 临床疑似病例检测 采用LPA检测临床样品18例,其中GPV阳性11份,GPV阴性7份;PCR检测18例,其中GPV阳性12份,阴性6份;两种方法检测结果仅有1份样品不一致,符合率为94.5%(17/18)(表4)。因此LPA方法可为临床疑似病例的快速诊断。
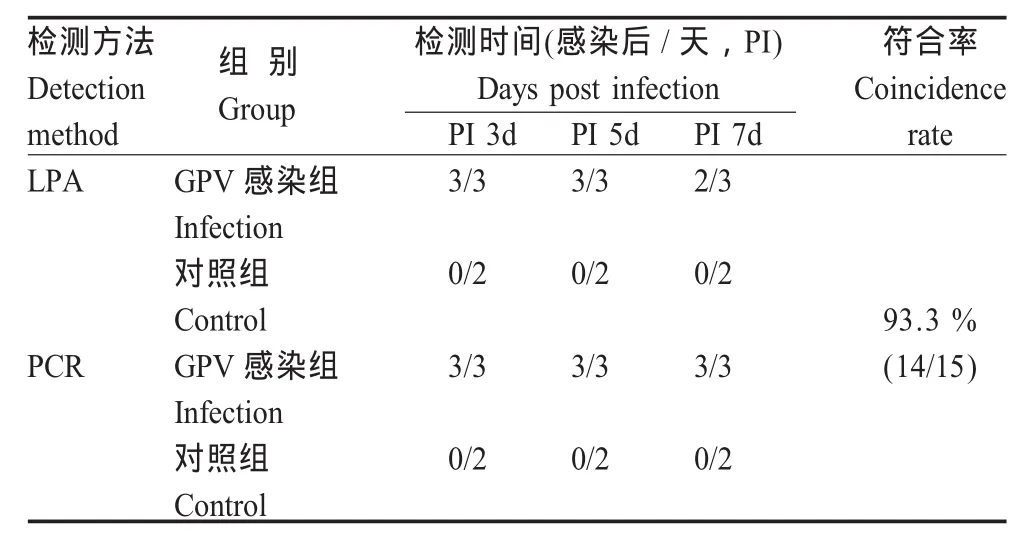
表3 应用LPA和PCR检测临床疑似GPV病例Table 3 The application of LPA and PCR detect infected artificially the GPV antigen of Muscovy ducks in the organization
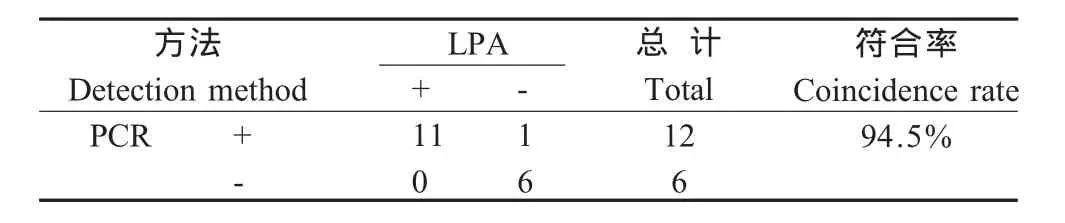
表4 应用LPA和PCR检测临床可疑GPV病例Table 4 The application of LPA and PCR detect clinically samples
3 讨论
至今国内外对小鹅瘟病的诊断进行了较多研究及报道,如病毒分离鉴定、免疫荧光、ELISA、AGP、PCR等均可以用于检测GPV抗原。其中,病毒分离鉴定和中和试验是确诊GPV的经典方法,但操作烦琐、费时(7 d以上),而且分离培养后的病毒还需结合其他诊断方法才可以判断为GPV感染;双夹心ELISA法只能用于检测细胞培养物中的GPV抗原,操作烦琐,不适用于临床快速诊断[8];小鹅瘟免疫荧光检测方法具有检出率高、特异性强、简便、快速(一般只需2 h)等特点,但需配备荧光显微镜[9]。近年发展的PCR、核酸探针等技术虽具有较高的特性和敏感性,但对使用者的操作技能要求较高,技术性强、操作繁杂而且费用较高等。而乳胶凝集试验操作简便、快速、特异、结果判定直观方便(不需特殊仪器,仅凭肉眼观察即可)、质量稳定,特别适于基层和临床快速诊断、流行病学调查[7,10]。本研究应用抗番鸭源小鹅瘟MAb标记聚苯乙烯乳胶,研制成小鹅瘟病乳胶诊断试剂,并建立了检测GPV抗原的LPA试验。在LPA检测中,该试剂仅与GPV呈凝集反应,而与MPV不反应,表现良好的特异性;LPA与PCR符合率达90%以上,表现良好的准确性。而且操作简便、检测时间小于60min。该方法目前国内外均未见报道。
临床上番鸭可以感染小鹅瘟病和番鸭细小病毒病,而且存在两者的混合感染;GPV与MPV不仅在病毒大小形态、结构蛋白、理化特性和核酸类型等方面极为相似[11-12],而且在血清学方面存在明显交叉反应[4],仅根据流行病学、临床症状和病理变化难于诊断。因此,应用高免血清建立的免疫学检测方法难以区分发病番鸭群中GPV和MPV的感染问题。本研究应用抗GPV特异性MAb标记聚苯乙烯乳胶并建立的LPA方法则能够鉴别MPV和GPV感染,解决了临床诊断上的难题。
[1]程晓霞,陈少莺,朱小丽,等.番鸭小鹅瘟病毒的分离与鉴定[J].福建农业学报,2008,23(4):355-358.
[2]Qiu Jian-m ing,Cheng Fang,Yoto Y,et al.The expression strategy of goose parvovirus exhibits features of both the dependovirus and parvovirus genera[J].J Virol,2005,79(17):11035-11044.
[3]Irvine R,Holmes P.Diagnosis and control of goose parvovirus[J].In Practice,2010,8(32):382-386.
[4]程由铨,胡奇林,陈少莺,等.番鸭细小病毒和鹅细小病毒生化及基因组特性的比较[J].中国兽医学报,2001,21(5):429-433.
[5]胡奇林,陈少莺,林天龙,等.应用PCR快速鉴别番鸭和鹅细小病毒[J].中国预防兽医学报,2001,23(6):47-50.
[6]张云,耿宏伟,郭东春,等.鹅和番鸭细小病毒全基因克隆和序列分析[J].中国预防兽医学报,2008,30(6):415-419.
[7]鲜思美,文心田,都启晶,等.鹅细小病毒和番鸭细小病毒PCR鉴别诊断方法的建立[J].山地农业生物学报,2009,28(3):235-239.
[8]郑大恒,李永明,温贵兰,等.小鹅瘟病毒荧光抗体的制备与应用[J].中国兽医科技,2003,11(11):33-36.
[9]王忠,丛艳峰,李玉玲.小鹅瘟血清学和分子生物学诊断方法[J].黑龙江畜牧兽医,2009(1):88-89.
[10]张伟,季艳菊,陈芳艳,等.华南地区小鹅瘟和番鸭“三周病”分离野毒株部分VP基因序列的差异分析[J].黑龙江畜牧兽医,2009(10):64-67.
[11]Le Gall-ReculéG,Jestin V.Biochem ical and genom ic characterization of muscovy duck parvovirus[J].Arch Virol,1994,139(1-2):121-131.
[12]Zadori Z,Erdei J,Nagy J.Characteristics of the genome of goose parvovirus[J].Avian Pathol,1994,23:359-364.
