基于锁核酸探针的双重荧光实时RT-PCR检测方法鉴别新城疫中强毒株与弱毒株
2012-08-30秦智锋刘建利卢体康林庆燕吕建强曹琛福阮周曦曾少灵陈书琨廖立珊张彩虹花群义
秦智锋,刘建利,卢体康,林庆燕,吕建强,曹琛福,阮周曦,曾少灵,陈书琨,廖立珊,孙 洁,张彩虹,花群义
(1.深圳出入境检验检疫局,广东深圳 518001;2.深圳市外来有害生物质检测技术研发重点实验室,广东深圳 518045)
新城疫病毒(Newcastle disease virus,NDV)属于副黏病毒科(Paramyxoviridae)副黏病毒属I型(APMV-1)病毒,该病毒主要危害鸡、珠鸡和火鸡,能够在被侵袭的鸡群中迅速传播。NDV被我国列为一类传染病,也是世界动物卫生组织(OIE)须呈报的疫病,是国际动物产品贸易中重点检查的重大动物疫病。根据病毒株致病力的差异,将NDV分为强毒力型、中等毒力型及弱毒力型。NDV中强毒株在鸡群中传播迅速,危害严重[1];而弱毒株仅引起鸡群呼吸道感染和产蛋量下降,多与其他疾病共同发病而造成一定的危害[2]。因此,建立鉴别NDV并有效区分中强毒株和弱毒株的新型快速分子生物学检测方法成为迫切要求,对有效控制疫情、降低经济损失具有重要意义。
锁核酸(Locked nucleic acid,LNA)是一种新型的寡核酸衍生物,与TaqMan探针相比,具有两个明显的优点:一是可增强热稳定性和杂交的特异性,二是LNA探针长度较短,可增加设计的灵活性。
本研究利用LNA探针技术,针对中强毒株和弱毒株特异序列分别设计了碱基锁定的LNA探针,极大地提高了探针的Tm值和特异性,并建立了同时鉴别诊断NDV中强毒株与弱毒株的双重荧光定量锁核酸RT-PCR(Duplex LNA rRT-PCR)检测方法。
1 材料和方法
1.1 病毒与血清 NDV标准强毒株F48E9、中等毒力I系疫苗(Mukteswar株)购自中国兽药监察所;NDV标准弱毒株Ⅱ系(B1株)、Ⅲ系(F株)、IV系(Lasota株)和Clone-30弱毒疫苗株均由深圳市兽医防疫监督所馈赠;NDV,禽流感病毒(AIV)H5、H7、H9标准阳性血清,均购自哈尔滨兽医研究所;9日龄SPF鸡胚购自北京梅里亚维通实验动物技术有限公司。
1.2 主要试剂 AgPath-IDTMOne-Step RT-PCR Kit购自美国ABI公司;Qiagen Viral RNA Mini Kit购自Qiagen公司;美国农业部推荐的副粘病毒I型(APMV-1)实时荧光RT-PCR(APMV-1-rRT-PCR)检测引物探针和NDV中强毒株(vNDV)引物探针[3]由上海基康公司合成。
1.3 样品的采集与检测 采集2003年以来深圳地区鸡场样品进行NDV监测。每个鸡场分大、中、小3个采样群采样。每个采样群分别采集喉头棉拭子和泄殖腔棉拭子30份,每3份合成一个混合样,即每个鸡场采集30份混合样品,于当日送至实验室进行检测。样品到达实验室后,采用美国农业部推荐的APMV-1-rRT-PCR进行筛选检测[3]。
1.4 NDV株的分离与鉴定 对APMV-1-rRT-PCR筛选阳性的样品,按照《新城疫诊断技术》(GB/T 16550-2008)进行鸡胚分离与鉴定。将样品处理后接种9日龄SPF鸡胚,接毒3 d后,无菌收获尿囊液进行鉴定。
参照OIE手册中推荐的标准[4],采用标准的血凝方法(HA)程序进行检测。以血凝价超过≥23初步判定为具有血凝活性。
将具有血凝性的抗原统一稀释成4血凝单位的溶液,分别与NDV标准阳性血清,AIV H5、H7、H9亚型标准阳性进行血凝抑制试验(HI)。以血凝抑制价≥23判定为同血清亚型一致的亚型抗原。
1.5 duplex LNA rRT-PCR检测方法的建立
1.5.1 引物与探针设计采用bioEdit(7.0.9.0)软件,将GenBank中NDV主要代表性强毒力病毒株、中等毒力病毒株和弱毒力病毒株的F基因全序列,以ClusalW方式进行排列,选取F基因裂解位点两端保守区域设计简并引物,选取裂解位点序列设计鉴别诊断简并探针。中强毒株探针和弱毒株探针均使用了简并碱基脱氧次黄嘌呤(I)。引物与探针序列见表1,中强毒株探针的5'端用FAM标记,弱毒株探针用HEX标记,探针的3'端用BHQ基团淬灭。
1.5.2 duplex LNA rRT-PCR检测方法建立参照QIAamp Viral RNA Mini Kit说明书操作,于全自动核酸抽提工作站中抽提中强毒株5株(强毒株F48E9、中等毒株I系疫苗、vNDV-YF、vNDV-HB和vNDV-KD)、弱毒株 6株(Ⅱ系、Ⅲ系、IV系、Clone-30、aNDV-YF和aNDV-RR)和阴性对照尿囊液中病毒核酸。
参照ABI公司AgPath-IDTMOne-Step RT-PCR Kit操作说明书配制荧光RT-PCR反应液。进行实时荧光PCR扩增,反应程序如下:50℃30 Min,95℃10m in;95℃ 10 s、55℃ 30 s、72℃ 30 s,5个循环;95℃10 s、60℃40 s,35个循环,设置60℃时同时收集FAM和HEX两种荧光。
1.5.3 Duplex LNA rRT-PCR与Taq Man rRT-PCR检测方法灵敏度比较选取强毒株F48E9和弱毒株IV系疫苗尿囊液,10倍系列稀释成1×10-1~10-10等10个稀释度,用EZ1抽提核酸,按照所建立的方法进行灵敏度试验。同时采用美国农业部推荐的Taq-Man-APMV-1-rRT-PCR检测方法和TaqMan-vNDV-rRT-PCR检测。测定duplex LNA rRT-PCR和Taq-Man rRT-PCR检测NDV的灵敏度。

表1 NDV中强毒株与弱毒株鉴别引物与探针Table 1 Primers and probes for pathotyping of NDV
1.5.4 Duplex LNA rRT-PCR检测方法特异性试验采用duplex LNA rRT-PCR方法,检测中强毒株和弱毒株均同时收集了FAM和HEX两种荧光,来检测两个探针的特异性。
利用duplex LNA rRT-PCR检测方法,对实验室保存的鸡肉正常组织、鸡血清样品、火鸡肌肉组织、鸽组织、猪肉组织、正常鸡胚尿囊液、AIV H1N1、H3N2、H5N1、H7Nx、H9N2和传染性支气管炎病毒、传染性法氏囊病病毒、马立克病毒等其他家禽病毒和大肠杆菌、沙门氏菌、单增李氏特杆菌等细菌共22份非NDV阳性样品进行检测,进一步确定所建立方法的特异性。
1.6 临床样品检测 对2010年~2011年深圳鸡场新城疫普查监测的样品312份混合棉拭子进行duplex LNA rRT-PCR检测,同时按照美国农业部推荐的标准TaqMan-APMV-1-rRT-PCR进行检测,按照出入境行业标准《新城疫中强毒株检测方法荧光RT-PCR法》 (SN/T 1686-2005)进行TaqMan-vNDV-rRT-PCR检测。确定所建立方法的可行性。
2 结果
2.1 NDV的检测与鉴定结果 自2003年以来,共采集NDV监测混合棉拭子样品近6 000份。Taq-Man-APMV-1-rRT-PCR检测结果阳性的共有121份。对2004年以前的筛选阳性样品,全部采用鸡胚进行病毒分离后进行HA和HI鉴定。2003年和2004年共鉴定出NDV中强毒株3株,弱毒株2株,由哈尔滨兽医研究所进行毒力鉴定。详细检测结果见表2。最终分离出5株NDV,用于duplex LNA rRTPCR检测方法建立以及对强弱毒株检测的特异性分析。对于2005以后的样品,采用国家出入境行业标准《新城疫中强毒株检测方法荧光RT-PCR法》(SN/T 1686-2005)进行中强毒株鉴定。

表2 2003年~2004年分离的NDV毒株Table 2 Isolation of NDV during 2003-2004
2.2 Dup lex LNA rRT-PCR检测方法的建立结果在25μL反应体系中,加入分别用FAM标记的中强毒株探针和HEX标记的弱毒株探针,在设定的反应条件下进行duplex LNA rRT-PCR鉴别检测。在阴性对照成立的情况下,FAM标记的中强毒株探针特异性地实时扩增出5株不同中强毒株,HEX标记的弱毒株探针特异性地实时扩增出6株不同弱毒株,两者之间无交叉反应(图1)。

图1 11株NDV株duplex LNA rRT-PCR鉴别检测结果Fig.1 The differentiation of 11 NDV strainsw ith duplex LNA rRT-PCR
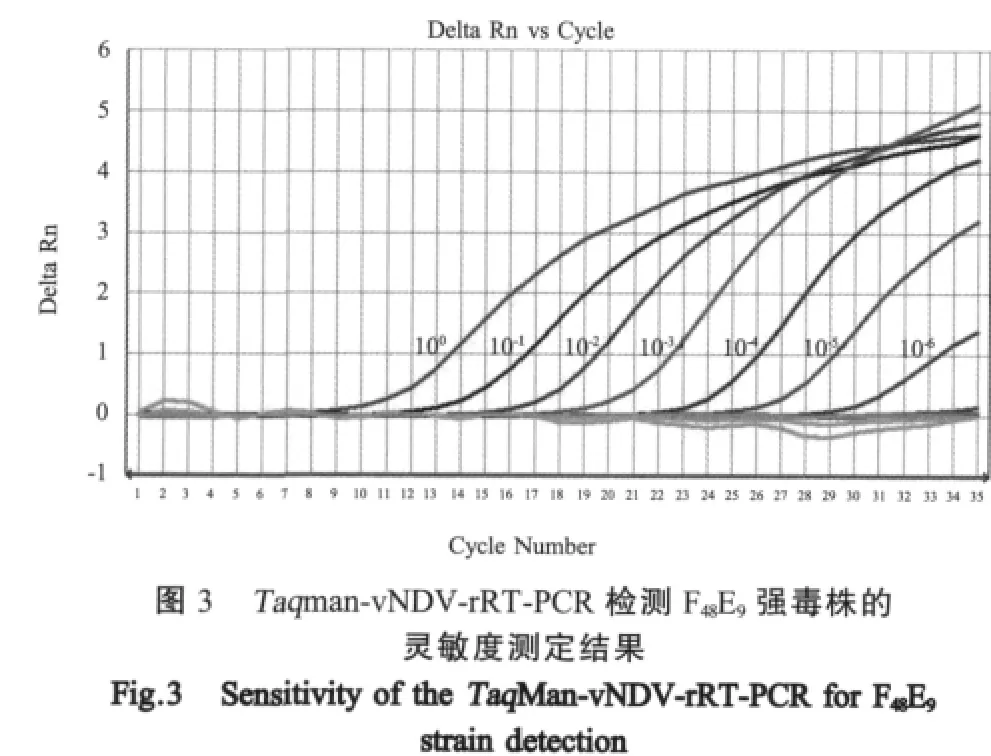
2.2.1 Duplex LNA rRT-PCR与Taq Man rRT-PCR检测方法灵敏度比较结果将10倍系列稀释的F48E9和IV系疫苗同时进行duplex LNA rRT-PCR单重检测灵敏度测定和TaqMan rRT-PCR灵敏度测定。测定结果显示,duplex LNA rRT-PCR单重检测F48E9的灵敏度为 10-5(图2),而TaqMan-vNDV-rRT-PCR检测F48E9的灵敏度为 10-6(图3)。通过计算,F48E9毒株 10-6稀释度相当于 1个 EID50[3],而 duplex LNA rRT-PCR检测方法单重检测强毒株F48E9的灵敏度为10个EID50。Duplex LNA rRT-PCR检测强毒株灵敏度要比TaqMan-vNDV-rRT-PCR检测方法的灵敏度低10倍,而且荧光增幅也有一定的差距。Duplex LNA rRT-PCR单重检测LaSota的灵敏度为 10-6(图4),而TaqMan-APMV-1-rRT-PCR检测 LaSota的灵敏度为10-7(图5)。通过计算,LaSota毒株10-7稀释度相当于10个EID50[3],而duplex LNA rRT-PCR单重检测弱毒株 LaSota的灵敏度为 0.1个 EID50。Duplex LNA rRT-PCR检测弱毒株灵敏度要比Taq-Man-APMV-1-rRT-PCR检测方法的灵敏度低10倍,并且荧光增幅也有一定的差距。

图2 Duplex LNA rRT-PCR单重检测F48E9强毒株的灵敏度测定结果Fig.2 Sensitivity of duplex LNA rRT-PCR for F48E9 strain detection
2.2.2 Duplex LNA rRT-PCR检测方法特异性试验结果在对5株强毒株和6株弱毒株建立duplex LNA rRT-PCR检测方法过程中,同时收集了FAM和HEX两种荧光,显示两个探针的特异性强,相互之间无交叉反应(图1)。通过对22种非NDV阳性样品的检测,结果全部为阴性(图略),所建立的NDV duplex LNA rRT-PCR检测方法的特异性为100%(22/22)。表明该方法特异性强,与其他检测对象无交叉反应。而TaqMan-APMV-1-rRT-PCR方法对11个NDV株进行检测时,无法检测到clone 30毒株,即使将退火温度降至45℃,仍然显示为阴性结果。

2.2.3 临床样品检测结果针对2010年~2011年312份混合棉拭子样品进行duplex LNA rRT-PCR检测和TaqMan-rRT-PCR检测,结果显示两者的一致性完全相符。共筛选检测出NDV中强毒株样品2份,NDV弱毒株样品3份。
3 讨论
在探针的设计过程中,本实验采用了简并碱基I,既保证了扩增时有一定的优选顺序,又有效避免了漏检。碱基I称作脱氧次黄嘌呤,是一个自然存在的碱基,虽然不是真正意义上的通用碱基N,但当与其它碱基结合时,会比其它错配碱基相对更稳定。脱氧次黄嘌呤与其它碱基的结合能力为dI∶dC>d I∶dA>dI∶dG>d I∶dT。鉴于裂解位点探针所先的位置均有4个碱基存在,但碱基G的数量最多,碱基T的数量最少,为了更好地实施检测,所以选择了I而非N进行探针的设计。碱基I在DNA聚合酶的催化下,脱氧次黄嘌呤首选与dC结合,其次再与A或G结合,最后与T结合,既保证了亲和性不同,又避免了漏检现象的发生。
本研究采用LNA探针的方法,在NDV裂解位点设计了针对中强毒株的LNA探针和针对弱毒株的LNA探针,使用同一引物来进行扩增,建立了同一反应中同时鉴别检测NDV毒力的双重实时荧光RT-PCR检测方法。由于采用了双重荧光标记探针检测,而且探针中采用了简并探针的方法,中强毒株探针和弱毒株探针中均具有3个简并碱基,保证了检测方法的特异性,避免了假阴性的出现。Kim报道TaqMan-vNDV-rRT-PCR在检测NDV强毒株时存在有一定的漏检现象,特别是检测Dove/Italy/2736/2000时出现假阴性[4]。而TaqMan-APMV-1-rRT-PCR在检测弱毒株Clone 30时也出现了漏检,仅能够检测出部分NDV株,该检测方法仍需改进或与其它方法联合使用。本研究所建立的方法对所检测样品的特异性达到100%,检测样品中11个NDV株全部为阳性,并有效区分其中的中强毒株和弱毒株。在临床样品试验中,duplex LNA rRT-PCR共筛查到NDV强毒株2份、弱毒株3份,与Taq-Man-rRT-PCR结果相一致。验证了本研究所建立方法适合用于实际样品中NDV的检测。
根据理论推算,探针中每一个碱基的错配可导致降低约一个Ct值,这有可能降低检测的灵敏度。本研究所建立的duplex LNA rRT-PCR检测方法与TaqMan-rRT-PCR检测方法相比,在灵敏度方面大约低10倍,这是本研究方法仍需改进的地方。
Wang、Farkas和EW A ldoust等建立了基于Taq-Man-rRT-PCR检测方法来鉴别区分NDV的中强毒株和弱毒株[5-7]。基于分子方法对NDV致病性进行分型的报道还包括地高辛或放射标记的杂交探针法、SYBR Green实时荧光RT-PCR法和荧光水解探针法(包括普通的TaqMan探针法)。但已报道的NDV检测的分子生物学检测方法在特异性方面都存在问题,不能检测出全部NDV株,已有检测方法仍需改进或与其它检测方法联合使用[7]。而LNA探针技术通过化学修饰来锁定核酸,可增强双链体的热稳定性,有效提高目标序列杂交的特异性。本研究利用全新的LNA探针法,建立了同时区分中强毒株和弱毒株的双重实时荧光RT-PCR检测方法。该方法能够特异性检测NDV并有效区分中强毒株和弱毒株,适合用于鸡场和进出境动物产品中NDV的快速检测。
[1]OIE,Manual of diagnostic tests and vaccines for terrestrial animals 2008[EB].http://www.oie.int/international-standard-setting/terrestrial-manual/access-online/,2011.
[2]Cattoli G,Fusaro A,Monne I,et al.Emergence of a new genetic lineage of Newcastle disease virus in West and Central A fricaimplications for diagnosis and control[J].Vet Microbiol,2010,5:168-176.
[3]Pedersen JC.Real-time RT-PCR for detection of virulent Newcastle disease virus in clinical samples[EB].http://www.oie.int/eng/normes/mmanual/A_summ ry.htm,2005.
[4]Kim L M,A fonso C L,Suarez D L.Effect of probe-site Mismatches on detection of virulent Newcastle disease viruses using a fusion-gene real-time reverse transcription polymerase chain reaction test[J].Vet Diagn Invest,2006,18:519-528.
[5]Pham H M,Konnai S,Usui T,et al.Rapid detection and differentiation of Newcastle disease virus by real-time.
[6]Wang Zhen,Vreede F T.Rapid detection and differentiation of Newcastle disease virus isolates by a triple one-step RT-PCR[J].JVet Res,2001,68:131.
[7]M iller P J,Decanini E L,et al.Newcastle disease:Evolution of genotypes and the related diagnostic challenges[J].Infect Genet Evol,2010,10:26-35.
