非洲猪瘟病毒p72蛋白杆状病毒表达系统的构建及其抗原性分析
2012-08-07侯绍华柏丽华郭晓宇姜一曈朱鸿飞
侯绍华,柏丽华,郭晓宇,贾 红,姜一曈,朱鸿飞
(中国农业科学院北京畜牧兽医研究所动物医学研究室,北京100193)
非洲猪瘟(African swine fever,ASF)是由ASF病毒(ASFV)引起猪的一种以高热、淋巴及内脏器官严重出血为特征的急性、热性、高度传染性疾病[1]。家猪和野猪是该病毒的自然宿主,家猪感染后的临床表现和病理变化以及流行病学特点类似于急性猪瘟,但病程更为急剧,致死率高达100%[2]。世界动物卫生组织(OIE)将其列为必须呈报的动物疫病。
ASFV是一种有囊膜的双链DNA病毒,属于虫媒DNA病毒,其基因组全长170 kb~190 kb,中间有125 kb左右的保守区,两端为可变区,末端具有串联反转重复序列,这种序列可随机缺失或获得,造成了基因组长度的多样性[3]。p72蛋白为ASFV的核衣壳蛋白,位于细胞内病毒粒子的中层或表层。p72是一种非常保守的抗原性蛋白,对自然感染具有免疫反应原性[4]。因此,常被用作血清学诊断和免疫学检测抗原[5]。
虽然我国目前尚未发现该病,但最近几年相邻国家非洲猪瘟的爆发和流行时有发生,使得我国对该病的防控形势异常严峻。由于缺乏有效的疫苗,预防主要依赖严格的边境和口岸检疫,以阻止病毒的入侵[6]。本实验利用Bac-to-Bac杆状病毒表达系统表达p72重组蛋白,并对其抗原性进行分析,为建立安全、可靠、适合推广的非洲猪瘟血清学检测方法奠定了基础。
1 材料和方法
1.1 菌株、载体及细胞 大肠杆菌(E.coli)DH5α购自北京全式金生物技术有限公司;含ASFV p72全长基因的重组质粒pGEX-6p-p72、DH10Bac感受态、pFastBac HTa杆状病毒穿梭载体及Sf9昆虫细胞均本实验室保存。
1.2 主要试剂 限制性内切酶和T4 DNA连接酶购自TaKaRa公司;脂质体转染试剂CellfectinRⅡReagent、SF-900Ⅱ培养基购于 Invitrogen公司;HRP Affinipure Goat Anti-Swine IgG(H+L)为Earth OX产品;ASFV ELISA抗原检测试剂盒购自西班牙INGENASA公司。
1.3 血清和蛋白 抗ASFV阳性血清由深圳出入境检验检疫局花群义教授惠赠;抗典型猪瘟病毒(CSFV)、圆环病毒Ⅱ型(PCV2)、伪狂犬病病毒(PRV)、蓝耳病病毒(PRRSV)阳性血清为本实验室保存;原核表达的非洲猪瘟病毒ASFVp72重组蛋白为本实验室制备纯化。
1.4 引物设计 根据GenBank中登录的ASFV p72基因序列,用primer 5.0设计引物,Fp72:CCGG AATTCATGGCATCAGGAGGAGCT(EcoRⅠ)和Rp72:CCGCTCGAGACTTAGGTACTGTAACGCAG CAC(XhoⅠ)。鉴定重组病毒引物为M13引物,引物均由上海生工生物工程技术服务有限公司合成。
1.5 p72基因的扩增 以pGEX-6p-p72为模板进行P72全长基因扩增。反应体系50 μL;反应条件:94℃ 5 min;94℃45 s、56℃ 45 s、72℃ 2 min,30个循环;72℃10 min。PCR产物经0.8%琼脂糖凝胶电泳,胶回收目的片段。
1.6 重组质粒pFastBacHTa-p72的构建 分别用EcoRⅠ和XhoⅠ酶切 pFastBac HTa和 p72基因片段,回收纯化后以T4 DNA连接酶连接,连接产物转化DH5α感受态细胞,培养后,提取重组质粒,经PCR、酶切鉴定筛选阳性重组质粒,由上海生工生物工程技术服务有限公司测序,重组转座质粒命名为pFastBacHTa-p72。
1.7 重组杆粒rBacmid-p72的构建 参照Bac to Bac Baculovirus Expression Systems使用手册,将pFastBac HTa-p72转化含有穿梭载体bacmid的E.coliDH10Bac中,制备rBacmid-p72,并采用M13引物、P72特异性引物分别进行PCR鉴定。
1.8 rBacmid-p72转染Sf9昆虫细胞 按CellfectinⅡReagent操作说明书的方法,将 0.5 μg、1 μg 、1.5 μg 和 2 μg 不同浓度的 rBacmid-p72 与 8 μL 转染试剂转染于Sf9单层细胞,27℃继续培养3 d~5 d后收集上清,标记为P1代重组病毒,同时设空细胞对照。将P1代重组病毒液按照1%的体积分数进行传代,得到P2、P3代重组病毒,提取杆状病毒DNA为模板,分别采用M13引物和P72特异性引物进行PCR检测重组病毒DNA。
1.9 重组杆状病毒的表达和检测 将P3代重组杆状病毒上清以1%~5%体积分数接种Sf9昆虫细胞单层,同时设置未接毒空白对照,27℃培养72 h~96 h,收集细胞。细胞裂解后进行SDS-PAGE电泳,电泳产物电转印于硝酸纤维素膜上,以1%明胶作为封闭液,以1∶10稀释的抗ASFV阳性血清为一抗,以1∶5 000稀释的HRP标记的羊抗猪IgG为二抗,采用增强型HRP-DAB底物显色剂显色,进行western blot鉴定。
1.10 杆状病毒表达重组ASFV p72蛋白的纯化大量培养重组杆状病毒接种的Sf9昆虫细胞,收集感染细胞,2 000 r/min离心5 min,弃上清,以PBS重悬后超声破碎,12 000 r/min,4℃离心30 min获得包涵体。以结合缓冲液(5 mmol/L咪唑,6 mol/L盐酸胍,pH7.4)溶解包涵体后,0.45 um滤膜过滤。用AKTA purifier全自动蛋白纯化仪进行His亲和层析,目的产物以HiprepTM26/16 Desalting柱子脱盐,以去除咪唑,并置换到pH7.4的PBS缓冲体系中,用紫外分光光度计进行蛋白定量。
1.11 真核和原核表达的ASFV p72重组蛋白抗原性分析 以进口商品化的ASFVELISA抗原检测试剂盒作评价体系,分析真核、原核两种表达系统表达的ASFV p72重组蛋白在反应性、亲和性等方面的差异。将纯化的杆状病毒和原核表达的ASFV p72重组蛋白稀释成不同浓度,作为待检抗原,按试剂盒说明书加入阴性、阳性对照进行检测。
2 结 果
2.1 pFastBac HTa-p72的构建 将PCR扩增的p72基因克隆至pFastBac HTa中,重组质粒经EcoRⅠ/XhoⅠ双酶切,0.8%琼脂糖凝胶电泳,得到1 941 bp、4 856 bp的片段,经p72特异性引物PCR鉴定,扩增出1 941 bp的特异性片段,均与预期结果相符。测序结果显示,核苷酸序列一致性为100%,表明ASFV p72基因插入位置、大小及读码框均正确(图1)。

2.2 rBacmid-p72的构建 将阳性重组质粒转化DH10Bac,经蓝白斑筛选后挑取白色菌落,提取重组杆粒,以M13引物进行PCR鉴定,扩增出大小约4 470 bp的特异性片段,与预期结果相符。以未插入P72基因的穿梭质粒pFastBac HTa转化DH10Bac得到的病毒为模板,扩增出2 430 bp的条带,表明P72基因成功重组到杆状病毒基因组(图2)。
2.3 rBacmid-p72转染Sf9昆虫细胞 将重组rBacmid-p72杆粒转染sf9昆虫细胞。72 h后细胞呈现明显病变,变现为细胞变大变圆,细胞界限变得模糊、胞质中分布大量颗粒样物质,折光性增强,增殖缓慢后期开始脱落。
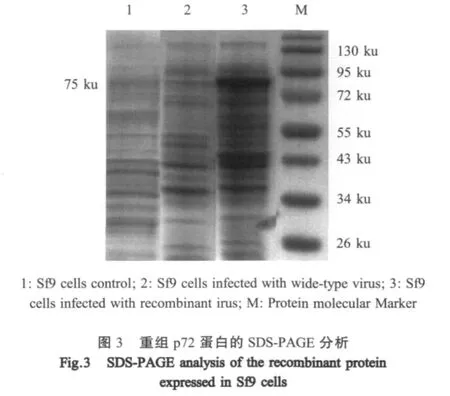
2.4 重组蛋白的SDS-PAGE及western blot分析分别收集接毒后24 h、48 h、72 h、96 h的细胞裂解产物进行SDS-PAGE。结果表明,在分子量约75 ku处出现特异性蛋白条带,与预期相符。野生型病毒感染的Sf9细胞及未接毒Sf9细胞对照无此条带(图3),表明p72重组蛋白得以表达。Western blot分析,重组p72蛋白可以与抗ASFV阳性血清反应出现特异性条带,大小约75 ku,表明重组蛋白具有良好的反应原性(图4)。病毒感染后72 h表达量最高,72 h与96 h的表达量无明显区别。重组p72蛋白与抗CSFV、PCV2、PRV、PRRSV阳性血清均不反应,表明该蛋白具有很强的特异性(图中未显示)。

2.5 ASFV p72重组蛋白反应原性分析 分别将杆状病毒表达的重组p72蛋白和原核表达的p72重组蛋白作为待检抗原,以ASFV ELISA抗原检测试剂盒检测两种蛋白的反应原性。结果表明,相对于原核表达的p72重组蛋白,试剂盒的捕获抗体、检测抗体与杆状病毒表达的P72重组蛋白在0 μg~20 μg抗原量间表现出更好的亲和力和反应性,显示出杆状病毒表达系统制备的重组ASFV p72蛋白相对于原核表达的p72重组蛋白在作为检测抗原方面的优越性(图 5)。


3 讨 论
p72蛋白是ASFV的主要结构蛋白,由B646L基因编码,分子量约为73.09 ku。该蛋白存在于病毒衣壳的外面,结构较为保守,在病毒感染晚期表达,具有较好的免疫原性和抗原性[7],与不同病毒株ASFV的单克隆抗体结合试验结果表明,p72是一种保守的抗原性蛋白,较早用于ASF抗体的检测[8]。当ASFV感染家猪以后,可在体内产生高水平的p72抗体[9]。因此,通过检测p72抗体可以监测猪感染非洲猪瘟的情况。李维彬等用原核表达系统成功表达了p72蛋白,但原核表达系统翻译后加工修饰体系不完善,表达产物的生物活性较低[10]。本实验在昆虫-杆状病毒表达系统中表达了ASFVp72重组蛋白,表达产物分子质量在75 ku左右,比理论值(72 ku)略大,分析可能是与p72蛋白在昆虫细胞内发生了不完全糖基化有关。经western blot鉴定,重组p72蛋白可以与抗ASFV阳性血清能发生特异性反应,而与猪其他病毒阳性血清不反应,表明真核表达的ASFV重组p72蛋白的特异性较强。经进口抗原检测试剂盒检测,杆状病毒表达的重组p72蛋白的亲和力和反应性比原核表达的p72蛋白更强,显示真核系统表达的p72蛋白更接近蛋白的天然构象,功能稳定,活性更强。这为进一步研制基于ASFVp72抗原的抗体检测试剂盒以及研究其生物学功能、病毒致病机制等奠定了基础。
[1]Hess W R.African swine fever:a reassessment[J].Adv Vet Sci Comp Med.1981,25:39-69.
[2]殷震,刘景华.动物病毒学[M].2版,北京:科学出版社,1997,1197-1205.
[3]Mebus C A.African swine fever[J].Adv virus res,1988,35:251-269.
[4]Lopez-Otin C,Freije J M,Parra F,et al.Mapping and sequence of the gene coding for protein p72,the major capsid protein of Africa swine fever virus[J].Virology,1990,175(2):477-484.
[5]Costard S,Wieland B,de Glanville W,et al.African swine fever:how can global spread be prevented?[J].Phil Trans K Soc B,2009,364:2683-2696.
[6]Rowlands R J,Michaud V.African Swine Fever Virus Isolate,Georgia[J].Emerg Infect Dis,2008,14(12):1870-1874.
[7]Vidal M I,Stiene M,Henkel J,et al.A solid-phase enzyme linked immunosorbent assay using monoclonal antibodies,for the detection of African swine fever virus antigens and antibodies[J].J Virol Methods,1997,66(2):211-218.
[8]Freije J M,Munoz M.High-level expression inEscherichia coliof the gene coding for the major structural protein(p72)of African swine fever virus[J].Gene,1993,123(2):259-162.
[9]Borca M V,Irusta P,Carrillo C,et al.African swine fever virus structural protein p72 contains a conformational neutralizing epitope[J].Virology,1994,201(2):413-418.
[10]李维彬,蒋正军,王玉炯.非洲猪瘟病毒衣壳蛋白P72在大肠杆菌中的表[J].中国预防兽医学报,2006,28(3):267-271.
