的士宁与MK801共同作用改善大鼠脑缺血再灌注后学习记忆能力缺陷
2012-07-13涂静宜周彩凤王瑞敏
朱 莹 涂静宜 张 熙 周彩凤 刘 斌 王瑞敏*
(河北联合大学医学实验研究中心,①附属医院 河北唐山 063000)
脑血管疾病是严重危害人类健康的三大疾病之一,具有高发病率、高致残率和高病死率的特点,是中老年人致死和致残的主要疾病。缺血使细胞供氧减少引起突触间隙谷氨酸浓度显著增加,导致对突触后受体的过度刺激,特别是NMDA受体亚型。造成突触后神经元的大量Ca2+内流,通过激活各种胞内酶而使细胞死亡[1]。缺血缺氧后神经元释放大量兴奋性氨基酸,通过激活兴奋性氨基酸NMDA受体而引起神经元内的钙离子超载,是神经元缺血缺氧性损伤的重要机制[2]。MK801是NMDA受体的非竞争性阻断剂,整体动物实验研究显示,MK801可以有效减轻脑的缺血性损伤,但也有相反报道[3,4],本实验室研究表明缺血后单独给予MK801对神经元损伤无明显保护作用。
NMDA受体甘氨酸位点拮抗剂能有效保护局部缺血的大脑组织[5],它在抑制脑部某些区域高水平谷氨酸影响的同时,又能相对保持脑部其他区域正常神经递质的传递,且没有其他NMDA受体拮抗剂普遍存在的细胞空泡化的现象[6]。士的宁(strychnine)能特异性阻断甘氨酸与其受体的结合。本研究采用缺血后尾静脉注射甘氨酸及其拮抗剂的士宁,研究其形态学及学习记忆能力的改变旨在探讨其在海马神经元缺血损害中的作用,为缺血性脑损害探索新的治疗途径。
1 材料与方法
1.1 材料 SPF级成年雄性SD大鼠购于北京实验动物中心,体质量250~300g,于22~26℃环境下自由喂养。NBT/BCIP购自Amresco公司。其他试剂均为国产分析纯。Morris水迷宫设备为淮北正华仪器设备有限公司生产。
1.2 大鼠脑缺血再灌注模型的建立及实验分组 制作大鼠4动脉结扎全脑缺血模型[7]:实验第1天,大鼠腹腔注射水合氯醛(350mg/kg),麻醉后,电凝双侧椎动脉使之永久闭塞,并分离双侧颈总动脉。24h后在大鼠清醒状态下用动脉夹夹闭双侧颈总动脉造成全脑缺血,持续10min,松开动脉夹使脑血流再通。缺血时保持其直肠温度在36.5~37.5℃。成功的脑缺血模型表现为:大鼠于4动脉闭塞后30~60s内昏迷,翻正反射、角膜反射消失,双侧瞳孔散大,能自主呼吸,脑电图呈直线。实验动物随机分为 Sham组、I/R组:缺血10min再灌注12d)、缺血及MK801组、甘氨酸及其抑制剂组。Sham组不结扎双侧颈总动脉,其余处理同I/R组。每组动物15只。
1.3 尾静脉注射 MK801组缺血10min后即刻注射MK801,剂量:1.0mg/kg。的士宁与MK801的共同作用组缺血10min后即刻尾静脉注射Glycine+Strychnine+MK801,剂量:1.0mg/kg,Glycine:400mg/kg,Strychine:0.5mg/kg。
1.4 Morris水迷宫 参照 Yan等方法[8],实验第1天(即缺血后第7天),大鼠分别从各个象限面壁入水,记录到达平台时间(时间限90 s),如果大鼠在90 s内不能找到平台,引导其找到平台,在站台上休息 20s,此为训练实验。间隔 4h、1、2、3、4d(即缺血再灌注第7、8、9、10、11天)分别重复以上实验,此为正式实验,系统自动记录大鼠入水后找到平台的游泳时间即潜伏时间(latency time)和游泳的路程;实验目的在于检测大鼠的学习能力。缺血再灌注第11天,完成潜伏实验后4h进行空间探索实验,即撤掉站台,将大鼠分别从不同象限入水,测量其90s内在原有平台象限停留的时间即探索时间和游泳路程。此实验用于衡量大鼠的空间记忆能力。
1.5 样本取材及焦油紫染色 大鼠缺血10min再灌注12d后,用20% 水合氯醛(350mg/kg)腹腔注射麻醉后于剑突下横向沿胸壁左右向剪开暴露心脏,用平头穿刺针从心尖插入左心室,剪开右心耳,生理盐水灌洗至肝脏变白,4%多聚甲醛约300mL先快后慢灌注至四肢僵硬,断头取脑,后固定6小时,30%的蔗糖脱水至脑组织沉底,OCT包埋。海马行冰冻连续冠状切片,厚度25μm。
焦油紫染色方法:按本室方法[9]制备大鼠脑石蜡切片,进行焦油紫染色,光镜下观察海马CAl区锥体细胞的损伤情况。神经元细胞核清晰可见,胞体着色良好的计为成活神经元,CA1区每1mm长存活神经元数目代表神经元生存密度。
2 结果
2.1 的士宁与MK801共同作用对海马CA1区锥体神经元的损伤具有保护作用 如图1所示:Sham组海马CA1区锥体细胞排列整齐,形态完整,核膜边界清楚,核仁清晰,深染。I/R(缺血10min再灌注12d),海马CA1区锥体细胞显著损伤,细胞排列紊乱,大部分细胞胞核固缩,碎裂,核膜界限不清。MK801组(缺血10min后即刻尾静脉注射MK801再灌注12d)海马CA1区存活的神经元较I/R组无显著增加。而的士宁与MK801的共同作用(缺血10min后即刻尾静脉注射Gly+Stry+MK801再灌注12d)海马CA1区存活的神经元较I/R组有更显著增加,与sham组无显著差别。

图1 的士宁(strychnine)与MK801共同作用对缺血再灌注后海马CA1区神经元生存的影响
2.2 的士宁与MK801共同作用有效改善大鼠脑缺血再灌注后空间学习记忆功能 Morris水迷宫实验显示大鼠的潜伏时间及其活动轨迹(图2A,C:a~d),脑缺血后第 7、8、9、10、11 天每组大鼠的潜伏时间逐渐缩短;再灌注同天,I/R组潜伏时间与Sham组相比明显延长,的士宁与MK801共同作用组较Vehicle组明显缩短。图2B,C:e~h为大鼠的探索时间和活动轨迹。结果显示Sham组活动轨迹集中于站台附近;I/R组与Vehicle组活动轨迹较分散;MK801组活动轨迹较分散,的士宁与MK801共同作用组活动轨迹集中于站台附近,大致同Sham组。
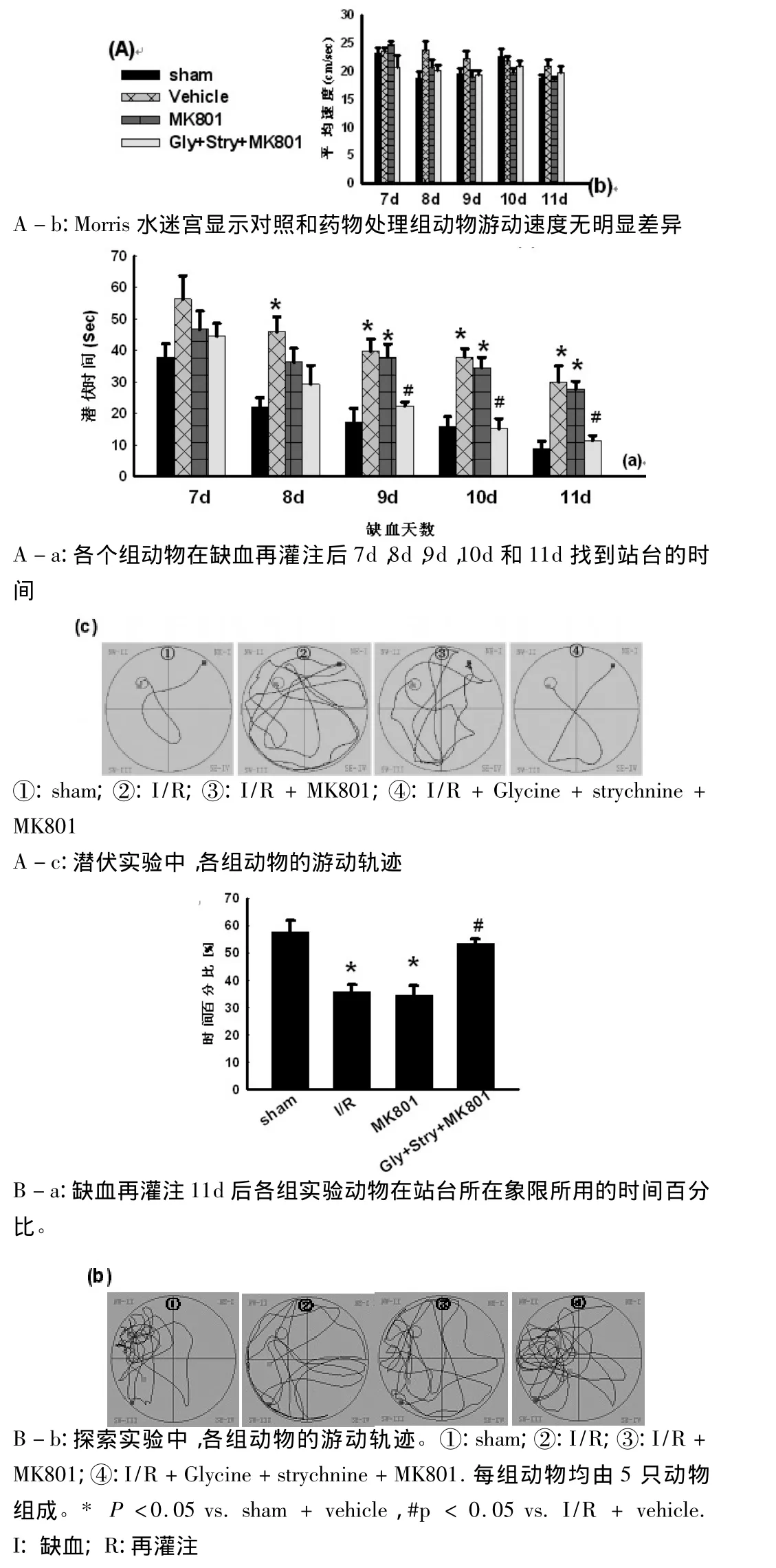
图2 Morris水迷宫实验观察的士宁(strychnine)与MK801共同作用对大鼠缺血后学习记忆能力的影响
3 讨论
脑复苏中存在全脑缺血再灌注损伤,而对脑缺血再灌注损伤的研究仍然是急诊医学中的重点,脑缺血再灌注模型的制作则是研究工作的重要环节[10]。在建立全脑缺血再灌注模型的方法中,四血管阻塞法建立大鼠全脑缺血再灌注动物模型是应用较为广泛的一种建模方法,该方法具有操作相对简便,可较好地模拟临床上因低血压休克、心肺脑复苏等造成的全脑缺血性损伤过程,易于做大宗实验等优点,至今仍广泛应用于研究中[11]。
海马结构作为边缘系统的重要组成部分,在学习记忆、情绪反应及植物神经功能等方面发挥着重要作用。有证据表明,海马对于空间信息的获得、检索、巩固和存储是必需的[12]。海马CA1区神经元对缺血具有选择性敏感,脑缺血再灌注可导致脑易感区选择性迟发性神经元损害,以海马CA1区最为敏感[13,14]很多学者都以海马CA1区神经元损伤作为模型,试图研究脑缺血的病理生理机制[15,16]。慢性脑低灌注大鼠海马神经元变性、坏死和脱失,导致空间学习记忆能力的显著下降[17],应用Morris水迷宫检测定位航行潜伏期和空间探索次数,结果显示缺血再灌注大鼠在造模后11日出现定位航行潜伏期延长和空间探索次数减少,与本实验中海马CA1区神经元的减少一致,表明海马神经元的减少与缺血再灌注大鼠的认知功能障碍有关。
NMDA受体激活后可造成大量Ca2+内流,引起Ca2+超载并促发自由基连锁反应,使得神经元死亡,导致缺氧缺血性脑损伤,故如何阻止细胞外钙离子流入细胞内,是研究缺氧缺血性脑病治疗中的重要课题。缺血前给予MK 801能占领离子通道结合点,阻止NMDA受体的反应,减轻细胞外钙离子进入细胞内所引起的神经细胞损伤[18],达到预防和治疗缺氧缺血性脑损伤的目的。而本研究表明在缺血后给予MK801没有明显的保护作用,其原因可能与缺血时由于能量耗竭,使细胞膜表面钠钾-ATP酶活性降低,导致离子交换障碍,使膜离子梯度难以维持,细胞膜去极化,使钙通道开放,细胞内增多的钙离子,已经引起钙离子超载。而这时候给予MK801即没有明显的保护作用。
甘氨酸属于抑制性神经递质,激动甘氨酸受体可使神经元膜超极化,降低神经元的兴奋性。如脑缺血时使用可望抑制谷氨酸等兴奋性氨基酸对神经元的兴奋性毒性,起到神经保护作用。甘氨酸虽然激动甘氨酸受体能力最强,但在脑内它同时还是谷氨酸受体中NMDA亚型受体的辅助激动剂,不当使用反会加强谷氨酸对神经元的兴奋性毒性,加重缺血缺氧性脑损伤[19]。本研究结果显示,加入外源甘氨酸后,脑损伤加重,且学习记忆能力也较缺血再灌注大鼠有一定程度的下降。
许多研究证实非竞争性[20]和竞争性[21]NMDA受体拮抗剂对大脑缺血有保护作用。许多研究认为,甘氨酸位点拮抗剂最有希望成为新型的治疗和预防神经退行性疾病的药物[22]。但是早期的NMDA受体拮抗剂因其全身使用的不良反应(学习能力受损[23]、精神症状[24]和神经毒性[25])而导致临床应用受限。NMDA受体甘氨酸位点拮抗剂的士宁能有效保护局部缺血的大脑组织[5],它在抑制脑部某些区域高水平谷氨酸影响的同时,又能相对保持脑部其他区域正常神经递质的传递,且没有其他NMDA受体拮抗剂普遍存在的细胞空泡化的现象。我们的研究发现,缺血再灌注损伤后CA1区神经元明显少于正常对照组。治疗组中,给于的士与MK801共同作用组CA1区神经元显著高于缺血再灌注组。且学习记忆功能高于缺血再灌注组,其原理尚不明确,需进一步研究。
[1] 黄世杰.新的强神经保护剂甘氨酸拮抗剂GV150526的发现和药理特征[J].国外医学药学分册,1999,26(1):23
[2] Lipton.Ischemic cell death in brain neurons[J].Physiol Rev,1999,79(4):1431
[3] Foster AC,Gill R,Kemp JA,et al.Protection of N - methyl- D - aspartate induced neuronal degeneration by systemic administration of MK801[J].Br J Pharmacol,1986,89:870
[4] Yam PS,Dunn LT,Graham DI,et al.NMDA receptor blockade fails to alter injury in focal cerebral ischemia[J].J Cereb Blood Flow Metab,2000,20(5):772
[5] Gill R,Hargreaves RJ,Kemp JA.The neuroprotective effect of the glycine site antagonist 3R-(+)-cis-4-methyl- HA966(L-687414)in a rat model of focal ischaemia[J].Cereb Blood Flow Metab,1995,15:197
[6] 邱伟强,张纯,王薇,等.NMDA受体甘氨酸位点拮抗剂Y1231对视网膜缺血再灌注损伤后 RGCs的影响[J].眼科研究,2008,26(6):401
[7] Wang RM,Zhang QG,Li CH,et al.Activati on of extracellular signalregulated kinase 5 may play a neuroprotective role in hippocampal CA3/DG region after cerebral ischemia[J].Neurosci Res,2005,80(3):391
[8] Yan X B,Hou H L,Wu L M,et al.Lithium regulates hippocampal neurogenesis by ERK pathway and facilitates recovery of spatial learning and memory in rats after transient global cerebral ischemia[J].Neuropharmacology,2007,53(4):487
[9] Zhang QG,Wang RM,Khan M,et al.Role of Dickkopf-1,an antagonist of the Wnt/beta-catenin signaling pathway,in estrogen-induced neuroprotection and attenuation of tau phosphorylation[J].Neurosci,2008,28(34):8430
[10]阳生光,苏科,涂燕喜,等.改良式大鼠全脑缺血再灌注模型的制作及海马回核因子-κB的表达研究[J].Chinese General Practice,2010,13(6):2001
[11] Diler AS,Ziylan YZ,Uzum G,et a1.Passage of spermid in across the blood-brain barrier in short recirculation periods following global cerebral ischemia:effects of mild hyperthermia[J].Neurosci Res,2002,43(4):335
[12] O'Keefe J,Speakman A.Single unit activity in the rat hippocampus during a spatial memory task[J].Exp Brain Res,1987,68(1):1
[13] Chen M,Chen Q,Cheng XW,et al.Zn2+mediates ischemia induced impairment of the ubiquit in proteasome system in the rat hippocampus[J].Neurochem,2009,111(5):1094
[14] Ito Y,Ohkubo T,Asano Y,et al.Nitric oxide production during cerebral ischemia and reperfusion in eNOS and nNOS knockout mice[J].Curr Neurovasc Res,2010,7(1):23
[15]陈远寿,陈 旻,张 弛.小鼠全脑缺血再灌注模型的制备及评价[J].中国老年学杂志,2011,31(3):435
[16] Clark WM,Madden KP,Rothlein R,et al.Reduction of central nervous system ischemic injury in rabbits using leukocyte adhesion antibody treatment[J].Stroke,2006,28(2):78
[17] Hillis AE,Barker PB,Beauchamp NJ,et al.MR perfusion imaging reveals regions of hypoperfusion associated with aphasia and neglect[J].Neurology,2000,55:782
[18]李炜如,姚裕家,曾珍,等.MK801缺氧缺血性大脑皮质神经细胞钙超载影响的研究[J].中华儿科杂志,1999,37(2):85
[19]王国华,姜正林,李 霞,等.甘氨酸受体激动剂对大鼠局灶性脑缺血再灌注损伤的神经保护作用[J].临床神经病学杂志,2010,23(1):38
[20] Matin P,Moron F,Lombard G,et al.Ultra structural and biochemical studies on the neuroprotective effects of excitatory amino acid antagonists in the ischemic rat retina[J].Exp Neurol,1997,146:419
[21] Boast CA,Gerhardt SC,Pastor G,et al.The N -methyl- D - aspartate antagonist CGS 19755 and CPP reduce ischemic damage in gerbils[J].Brain Res,1988,442:345
[22] 王小芳,杨光中.NMDA受体甘氨酸位点拮抗剂研究的新进展[J].国外医学药学分册,1999,26(3):129
[23] Morris RG,Anderson E,Lynch GS,et al.Selective impairment of learning and blockade of long-term potentiation by an N-methyl-D-aspartaten receptor antagonist,AP5[J].Nature,1986,319:774
[24] Wang CX,Shuaib A.NMDA/NR2B selective antagonists in the treatment of ischemic brain injury[J].Curr Drug Targets CNS Neurol Disord,2005,4:143
[25] Ikonom idou C,Tursk iL.Why did NMDA receptor antagonists fail clinical trials for stroke and traumatic brain injury[J].Lancet Neurol,2002,1:383
