脑桥中央和脑桥外髓鞘溶解症的临床与影像学特征
2011-09-14陈柳静杨楠王本国曾进胜梁秀龄陈玲
陈柳静 杨楠 王本国 曾进胜 梁秀龄 陈玲
脑桥中央髓鞘溶解症(central pontine myelinolysis,CPM)常继发于某些严重疾病,以假性延髓麻痹、四肢瘫痪和意识障碍为特征,类似病变也累及脑桥以外区域,称脑桥外髓鞘溶解症(extrapontine myelinolysis,EPM)。因其病因的特殊性,患者常常收治在非神经科的各临床科室,如对其认识不足容易引起误诊误治。为了进一步提高对该病的认识并积极预防,现报道收治的2例病例并进行文献回顾。
1 资料
例1:患者男,59岁,2008年11月13日因“四肢乏力 2个月”入院。患者2008年9月下旬渐觉四肢乏力,于外院查血压正常,神经系统体查肌力、肌张力正常,病理征未引出。生化示Na+108.7 mmol/L,Cl-74.5 mmol/L,血钾正常,头 CT 无异常。经口服补钠等对症治疗,低钠低氯未能纠正,反复出现意识模糊,血生化曾示 Na+99.6 mmol/L,Cl-65.1 mmol/L,伴反复发热及肺部湿罗音。2008年10月初开始限水、经静脉补钠(最快血钠平均每日上升约9.6 mmol/L)、抗感染治疗,仍反复出现意识模糊,2008年 10月中旬体查出现双侧 Babinski′s征(+)、可疑脑膜刺激征阳性,疑为“中枢神经系统感染”行脑脊液检查,压力、常规、生化均正常。遂入神经科进一步诊治。查体:嗜睡状,检查欠合作。构音不清、饮水呛咳,咽反射灵敏。伸舌困难,四肢肌张力稍高,四肢肌力检查不配合(约Ⅳ级),感觉检查不配合,四肢腱反射对称减弱,双下肢Babinski′s征(+)。2008年 11月17日(双侧Babinski′s征出现后1个月)头颅MRI示双尾状核、豆状核及脑桥对称性病灶,T1WI低信号,T2WI高信号,Flair高信号,无占位效应(图1)。考虑诊断为CPM/EPM。给予适当补钠、限水、氢化可的松,患者神志渐转清,四肢肌力无改善,双侧Babinski′s征(+),血钠、血氯恢复至正常范围下限,2008 年 12月9日复查头颅MRI病灶较前无明显改变。予出院。
例2:患者女,72岁,既往冠心病病史30年,高血压病史2年。2004年12月10日因“意识障碍20 d,四肢无力7 d”入院。患者2004年11月21日无明显诱因出现嗜睡,伴头晕沉感,四肢活动尚可,外院就诊体查肌力肌张力正常,病理征未引出。 血生化示 Na+106 mmol/L,Cl-78 mmol/L,K+2.6 mmol/L,并因急性心力衰竭一度出现血压低至80/40 mm Hg,给予静脉补钠、补钾纠正水电解质紊乱、升压、抗心衰处理。11月25日患者神志转清,可自行进食,血 Na+130 mmol/L,K+2.8 mmol/L,随后病情逐渐好转拟出院。12月3日患者突然不言语、不能张口、四肢无自主活动,此时生化血钠正常、K+3.1 mmol/L。12月10日入神经科,体查眼球各向活动可,可睁闭眼配合检查,不能皱眉、露齿、张口、伸舌,下颌反射(+),四肢肌力0~Ⅰ级,四肢腱反射(+)~(++),双下肢病理征阳性。12月12日(四肢瘫后9 d)行头颅MRI见脑桥及延髓上部长T1长T2信号(图2),考虑诊断为CPM,家属拒绝激素治疗并出院。
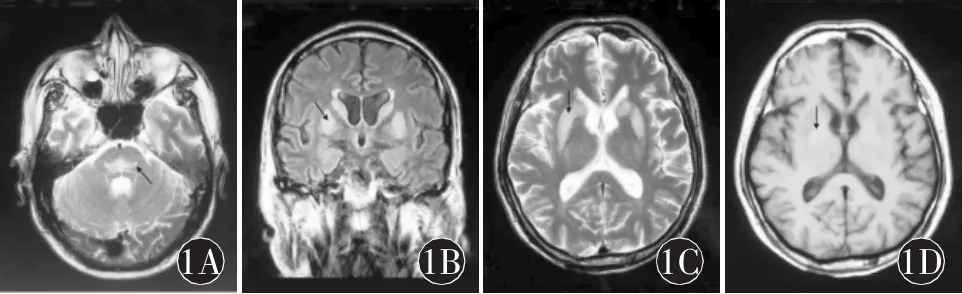
图1 例1患者头MRI示:A.脑桥中部“蝙蝠翼样”T2WI高信号;B-D.尾状核、豆状核对称性T1WI低信号,T2WI高信号,Flair高信号,无占位效应
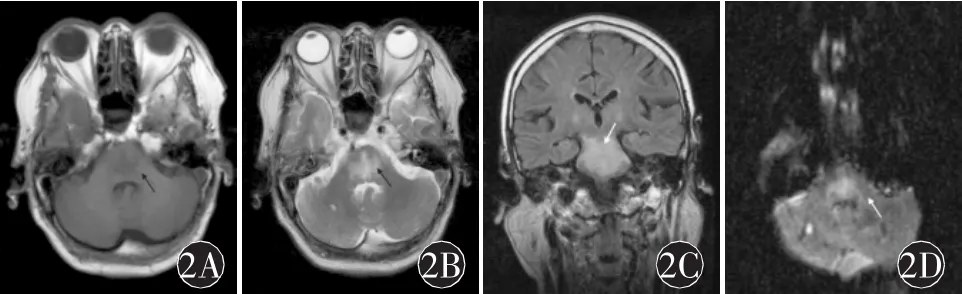
图2 例2患者头MRI示:A-B.横断面脑桥中部“蝙蝠翼样”T1WI低信号、T2WI高信号;C.脑桥及延髓上部 Flair高信号;D.弥散成像b=500时脑干高信号
2 讨论
CPM于1950年首先报道[1]:一位38岁的男性酗酒患者突发痉挛性四肢瘫痪和假性延髓麻痹。尸解发现其脑桥底部两侧有对称性类似蝙蝠的病灶,其病理特点是:髓鞘溶解,而神经细胞轴突完好。1959年Adams将本病命名为脑桥中央髓鞘溶解症。因为该病在病理学上髓鞘的脱失不伴炎症反应,与多发性硬化等脱髓鞘疾病不同而没有使用“脱髓鞘”的概念。后来人们将脑桥以外类似的对称病理改变称为EPM,EPM可累及尾状核、壳核、丘脑、大脑皮质及皮质下白质等部位。既往的报道中单独EPM出现的几率较小,大多是以CPM、CPM/EPM 形 式 出 现[2-3]。
国外报道常见病因是慢性酒精中毒、营养不良、水电解质紊乱及快速纠正史,其他包括肝移植术后、烧伤后、糖尿病等[3-4]。国内报道的首位病因为各种原因导致水、电解质紊乱及快速纠正史(54.0%)[5]。本次收治的患者均是有低钠血症及快速纠正史,其中例2患者伴有低钾血症,同时并存其他严重的内科疾病。关于髓鞘溶解的发生机制目前看法并不一致。大多数学者认为髓鞘溶解与脑内渗透压平衡失调相关。有大量研究关注低钠血症及其纠正速度对脑的影响:血钠浓度降低,水顺渗透梯度进入脑细胞,脑细胞通过容量调节反应和渗透压调节反应防止脑水肿发生。大脑的这种适应反应持续几小时至数天。慢性低钠血症患者经历了这种适应反应,故可以无脑水肿表现。当快速纠正慢性低钠血症,由于Na+、K+以及有机溶质不能尽快进入脑细胞,可能引起脑细胞急剧缺水,导致髓鞘和少突胶质细胞脱失[6]。然而这种理论不能解释其他水电解质状态下出现的髓鞘溶解,包括高钠血症纠正后[7]、缓慢的纠正低钠血症后出现的髓鞘溶解症[8]。
CPM患者常出现双相病程,初期为低钠血症引起的全脑症状或癫痫发作,当低钠血症纠正后症状好转,数日后病情恶化,以构音障碍、吞咽困难(皮质延髓束受累)和四肢瘫(皮质脊髓束受累 )为临床特征,也可出现闭锁综合征[4]。例2患者出现典型的双相病程,病情恶化后出现双侧皮质脑干束、皮质脊髓束受损的表现。而例1患者双相病程不明显,主要表现为长期低钠血症快速纠正后病情反而加重,四肢肌力下降不明显,并因合并肺炎、发热一度被误诊为中枢神经系统感染,后经脑脊液检查及结合病情分析已排除。故凡对有严重基础疾病特别是电解质紊乱者出现对称性神经系统症状应警惕该病的出现。现有报道的EPM临床表现多样,与受累部位有关,可出现共济失调、不自主运动或Parkinson样症状和肌张力障碍[9]。而例1患者虽然影像学上尾状核、豆状核受累,但除四肢肌张力高外,暂未发现对应的临床表现。
目前CPM、EPM没有明确的诊断标准,主要依据患者可能的病因、诱因、临床表现及影像学综合考虑,其中头颅MRI扫描是重要的辅助检查。CPM头颅MRI扫描显示桥脑基底部呈现长T1、长T2异常信号,有时呈特征性的蝙蝠翅样,无明显占位效应,增强扫描强化不明显。EPM则对称性累及基底节、丘脑及小脑皮层下等部位,在FLAIR加权中异常信号更为清楚。MRI往往在临床表现1~2周后才显示病变,因此最初的MRI正常并不能排除髓鞘溶解症[3]。本文两例患者行头颅MRI检查的时间分别是临床症状出现后的1个月、9 d,亦符合上述时间范围。近年有学者关注DWI(磁共振弥散加权成像)在髓鞘溶解症当中的作用,有个别报道显示患者四肢瘫后24 h内DWI上出现脑桥相应的异常信号[4],这提示DWI很有可能具有早期诊断的价值,然而目前尚未有足够证据证实。
髓鞘溶解症应注意与脑桥肿瘤、脑干梗塞和多发性硬化鉴别。不同于脑桥肿瘤,髓鞘溶解症的头颅MRI无明显占位效应,对比增强多不明显。髓鞘溶解症与基底动脉闭塞引起的脑干梗塞鉴别较困难,后者多数有动脉硬化的证据,脑桥被盖结构、中脑、丘脑出现更广泛的损害,而髓鞘溶解症病灶对称且不符合血管走行与分布。多发性硬化的脱髓鞘极少产生单一的脑桥基底部病变,其脑部病变多广泛且多发于脑室周围的白质,其它方面的表现亦有助于确诊。
CPM/EPM的发生重在预防,应注意患者存在的各种易感因素。有学者建议对无症状性低钠血症患者选择口服补钠及适当的水分限制缓慢提升血钠水平,不应静脉输注高张液体;对急性症状性低钠血症患者可选择静脉补钠,每日血钠提升的速度控制在8 mmol/L内;控制急性高钠血症患者的血钠下降速度在1 mmol/(L·h)内;控制慢性高钠血症患者血钠下降速度在 10 mmol/(L·h)内[10]。 CPM 目前尚无特异性治疗方法,主要是支持、对症治疗,积极治疗原发病是关键。也有学者推荐使用自由基清除剂及抗氧化治疗,然而疗效存在争议[10]。EPM的预后报道不一,既往的报道CPM、EPM预后很差,随着重症监护发展、影像学早期诊断,近年来的报道患者症状可逐渐改善甚至完全恢复[11]。
[1]Adams RD,Victor M,Mancall EL.Central pontine myelinolysis:ahitherto undescribed diseaseoccurringin alcoholicand malnourished patients[J].AMA Arch Neurol Psychiatry,1959,81(2):154-172.
[2]Musana AK,Yale SH.Central pontine myelinolysis:case series and review[J].Wis Med J,2005,104(6):56-60.
[3]Kallakatta RN,Radhakrishnan A,Fayaz RK,et al.Clinical and functional outcome and factors predicting prognosis in osmotic demyelination syndrome(central pontine and/or extrapontine myelinolysis) in 25 patients[J].J Neurol Neurosurg Psychiatry,2011,82(3):326-331.
[4]Martin RJ.Central pontine and extrapontine myelinolysis: the osmotic demyelination syndromes[J].J Neurol Neurosurg Psychiatry,2004,75(S3):22-28.
[5]郭筱华,赵忠新.脑桥中央髓鞘溶解症的流行病学、发病机制和临床特点[J].中华神经科杂志,2006,39(4):275-277.
[6]Sterns RH.The management of symptomatic hyponatremia[J].Semin Nephrol,1990,10(6):503-514.
[7]Go M,Amino A,Shindo K,et al.A case of central pontine myelinolysis and extrapontine myelinolysis during rapid correction of hypernatremia[J].Rinsho Shinkeigaku,1994,34(11):1130-135.
[8]Pietrini V,Mozzani F,Crafa P,et al.Central pontine and extrapontine myelinolysis despite careful correction of hyponatremia:clinical and neuropathological findings of a case [J].Neurol Sci,2010,31(2):227-230.
[9]Seiser A,Schwarz S,Aichinger-Steiner MM,et al.Parkinsonism and dystonia in central pontine and extrapontine myelinolysis[J].J Neurol Neurosurg Psychiatry,1998,65(1):119-121.
[10]Kumar S,Fowler M,Gonzalez-Toledo E,et al.central pontine myelinolysis,an update[J].Neurol Res,2006,28(3):360-366.
[11]Huq S,Wong M,Chan H,et al.Osmotic demyelination syndromes: Central and extrapontine myelinolysis[J].J Clin Neurosci,2007,14(7):684-688.
