抗精神病药物诱导代谢紊乱机制的研究进展☆
2011-04-18邢梦娟DakeQi崔东红
邢梦娟Dake Qi崔东红
·综 述·
抗精神病药物诱导代谢紊乱机制的研究进展☆
邢梦娟*Dake Qi△崔东红*
精神分裂症 抗精神病药物 代谢紊乱 机制
抗精神病药物是治疗精神分裂症的主要临床用药,也用于双相障碍、焦虑障碍等其它精神疾病的治疗。但因其明显的代谢紊乱不良反应而严重影响其依从性及疗效。早在1956年Bettie Hiles首次报告了第一代抗精神病药氯丙嗪可引起高血糖,但因其突出的锥体外系综合征等神经系统不良反应,使其代谢异常的副作用没有得到充分关注。直到上世纪90年代,随着神经系统不良反应轻微的第二代抗精神病药物 (the second generation antipsychotics,SGA)的广泛应用,其引起的体重增加、糖耐量异常、Ⅱ型糖尿病、血脂异常及心血管疾病等代谢异常,才受到应有的关注。大量报道指出服用SGA后,新发糖尿病明显增加[1]。大约1/3的新发糖尿病与服用奥氮平、利培酮及喹硫平有关[2]。不同SGA引起体重增加、血糖、血脂异常的风险不同,以疗效较好的氯氮平、奥氮平最为严重,阿立哌唑、齐拉西酮的影响最弱[3-5]。虽然SGA引发或加剧精神分裂症患者代谢紊乱的风险已经在临床上得到证实,但其发生机理仍然不清楚。本文将从外周、中枢等方面综述SGA导致代谢紊乱机制的研究进展。
1 SGA诱导代谢异常的外周机制
目前SGA诱导代谢紊乱的外周机制主要关注外周胰岛素敏感器官(如骨骼肌、肝脏、脂肪组织等)胰岛素信号的调节及与相关能量调节通路。
1.1 胰岛素抵抗的分子机制 胰岛素抵抗 (insulin resistance,IR)是全身代谢紊乱的核心问题,与多器官的代谢异常相关,主要涉及肝脏、脂肪组织和骨骼肌。当发生IR时,骨骼肌糖利用减退,肝糖释放增多。另外,脂肪组织不能继续储存脂肪,导致大量脂肪酸释放入血,使血糖、血脂及胰岛素水平异常增高,最终导致心血管疾病的发生。因此,IR的分子机制始终是研究的热点。在生理状态下,胰岛素与其受体结合,使受体底物的酪氨酸(Tyr)位点磷酸化,激活下游的磷脂酰肌醇-3激酶(phosphatidylinositol-3’kinase,PI3K),然后启动葡萄糖转运、糖原合成及相关蛋白质的合成[6]。目前普遍认为多种因素通过蛋白激酶C或c-Jun氨基端激酶诱导胰岛素受体底物丝氨酸(Ser)磷酸化,阻滞PI3K下游的蛋白激酶B(PKB or Akt)信号通路而产生IR。见图1。
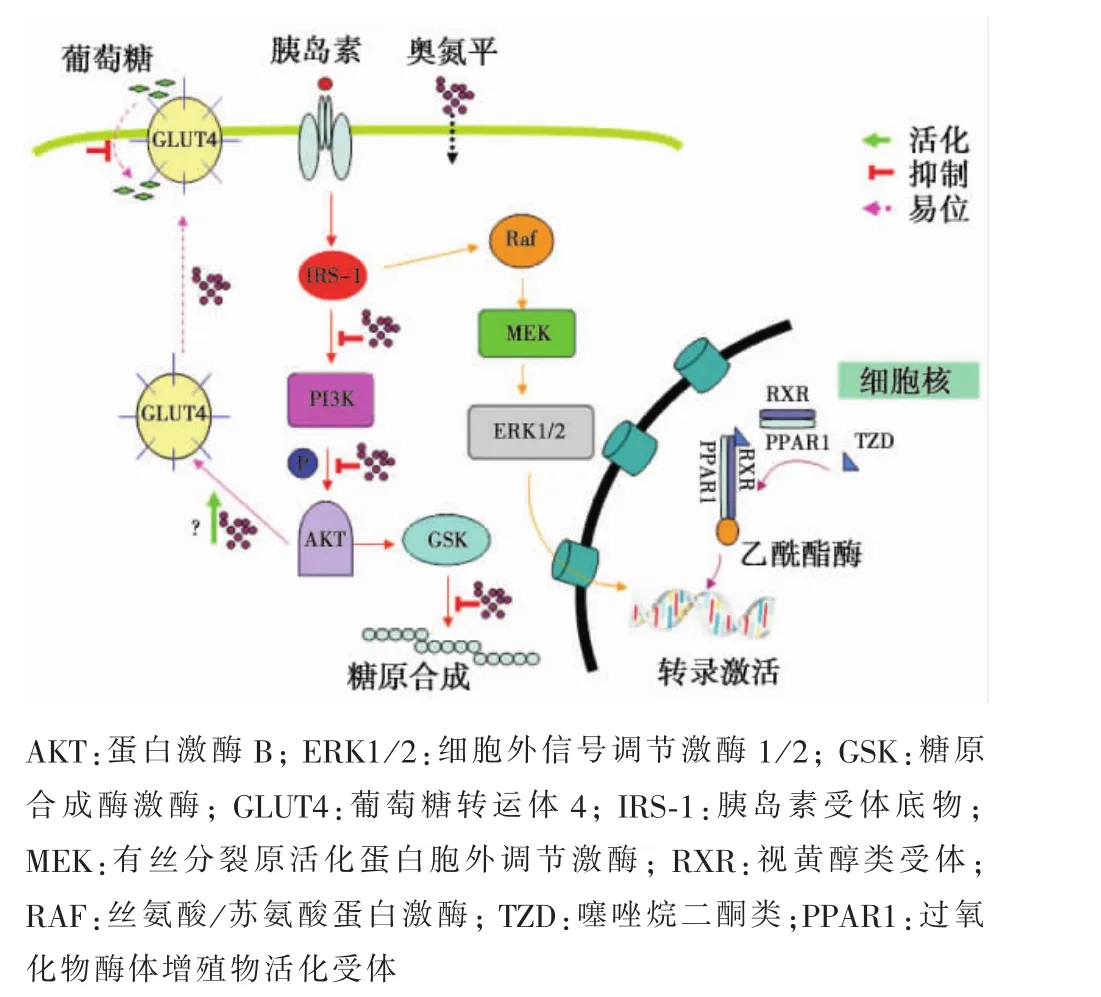
图1 胰岛素信号通路
1.2 SGA诱导糖代谢紊乱外周机制 糖代谢是能量代谢最重要的一个过程,许多研究报道了SGA可以直接影响糖的稳态调节,如糖转运、胰岛素分泌及细胞对糖的反应。骨骼肌、肝脏、脂肪组织IR是糖代谢异常的核心症状,但SGA引起这些组织、器官IR的机制尚不清楚。
1.2.1 骨骼肌 骨骼肌是胰岛素作用的主要靶组织,也是糖代谢的重要器官,约80%胰岛素调节的葡萄糖摄取由骨骼肌完成。因此,在全身IR发生中,骨骼肌起了重要作用。Engl等[7]发现用奥氮平长时间处理(72 h)大鼠成肌细胞L6,可以抑制胰岛素信号PI3K 66%的活性,并完全消除了Akt蛋白的磷酸化。Houseknecht等[8]发现急性氯氮平抑制了糖摄取,但在亚慢性动物模型(5 d)中未能重复这种现象。Albaugh等[9]也发现急性奥氮平大鼠模型血糖钳夹试验(HEC)中葡萄糖输入率(GIR)显著减少 (50%),但未发现肌肉组织Akt磷酸化改变。 Tulipano等[10]的研究也认为奥氮平不影响Akt的磷酸化,却可增加小鼠成肌细胞C2C12对2-脱氧葡萄糖(2-DG)的摄取,并具有剂量-效应关系,提出药物提高了糖的最大转运速度(Vmax),即使在PI3K抑制剂中奥氮平仍可显著增加葡萄糖摄取,而用DG预处理C2C12细胞时,2-DG吸收减少了40%。
Tulipano等[11]发现5-羟色胺(5-hydroxytryptamine,5-HT)可以快速刺激L6细胞吸收葡萄糖。随后Tulipano等[10]又发现奥氮平诱导糖吸收强于5-HT的作用,但在两者叠加时没有发现糖吸收的叠加效应,认为奥氮平可能是激活了内源性5-HT2A异构体而增加糖摄取,而氯氮平却完全抑制了5-HT诱导葡萄糖吸收,也可减少奥氮平诱导的2-DG吸收,提出氯氮平可能是抑制了5-HT2A的激活物α-甲基-5-HT。而在人横纹肌细胞的研究中,未发现奥氮平可增加葡萄糖摄取。
1.2.2 脂肪组织 前人在低浓度奥氮平处理脂肪细胞时没有发现胰岛素刺激引起细胞的糖转运变化;Houseknecht等[8]用100 μmoL的奥氮平处理脂肪细胞时发现,在无胰岛素时,脂肪细胞对2-DG的摄取仍增加了60%。Engl等[7]发现低浓度氯氮平(1 μmoL)不影响3T3-L1脂肪细胞的糖摄取,而提高浓度(10 μmoL)使进入脂肪中的糖减少。Minet-Ringuet等[12]发现的中等浓度氯氮平抑制了脂肪细胞的糖转运是一致的。其它相应的研究也支持奥氮平损害了脂肪细胞对胰岛素信号的反应能力,使其对糖的处理能力下降。Smith等[13]发现氯氮平使大鼠腹膜后脂肪Akt/PKB的磷酸化提高10倍,而总的Akt/PKB不变,提示氯氮平可干扰脂肪组织PI3K-Akt/PKB信号通路。
1.2.3 肝脏 Houseknecht等[8]以氯氮平、奥氮平急性处理大鼠,发现HEC的GIR显著减少,提出SGA使肝葡萄糖输出增加,但奥氮平不影响肝脏吸收2-DG,而氯氮平增强肝糖吸收。Martins等[14]外周静脉给予奥氮平时,也支持HEC的GIR显著减低,还发现肝脏的内源性葡萄糖生成增多及糖异生限速酶-葡萄糖-6-磷酸酶(glucose-6-phosphatase,G-6-P)、磷酸烯醇丙酮酸羧激酶的mRNA表达均升高。Tulipano等[11]也发现氯氮平对肝的影响是使肝的PEPCK酶表达升高。脑室给奥氮平后外周血糖出现相同表现,但对肝脏的糖处理不影响,提出奥氮平损伤了肝脏的HGO抑制作用。Smith等[13]发现急性氯氮平处理使大鼠肝脏的Akt/PKB显著磷酸化,提示氯氮平增强肝脏生成葡萄糖,提出氯氮平促进肝糖原分泌。Coccurello等[15]发现奥氮平动物模型的肝细胞浆中广泛的脂肪滴堆积,破坏了肝的糖脂代谢平衡。
1.2.4 内分泌激素 有研究提示奥氮平、氯氮平可影响大鼠离体胰岛的胰岛素释放,以及胆碱能受体受抑减弱了胰岛分泌胰岛素的能力。Barbaccia等[16]及Marx等[17]的研究也认为氯氮平通过γ-氨基丁酸 (GABA)-α受体减弱GABA对下丘脑-垂体-肾上腺轴的抑制,调节皮质醇分泌。此外,临床大量研究报道服用SGA的患者血清瘦素水平升高,但Albaugh等[18]的研究发现奥氮平降低瘦素水平。这种相互矛盾的结论也是可以理解的。由于SGA阻断了下丘脑与瘦素相互作用的5-HT2C受体,导致瘦素功能紊乱,使内分泌血糖稳定的调节混乱,导致脂肪细胞对糖的调节障碍。
关于SGA对胰岛素信号的影响做了多方面的探索,也取得了很多有益的成果,但也要考虑不可避免的局限性:首先,研究主要来源鼠类,种属差异可能有影响;其次,各研究的用药浓度变化很大,且均比临床偏高;第三,离体系统与整体系统的影响无法完全预测。然而,所有研究均在最大程度上模拟临床上SGA致代谢异常的表现,在一定程度上也反应了糖代谢的潜在机制。
1.3 SGA诱导脂肪代谢异常外周机制
1.3.1 甾醇调节因子结合蛋白(sterol regulatory element binding proteins,SREBPs) SGA与脂肪代谢异常密切相关。有报道认为SGA可以激活脂肪生成转录因子-SREBPs,使外周脂肪过度生成,引起体重增加。SREBPs是维持脂质稳态的关键调节因子,调节脂质合成基因的表达。Yang等[19]发现在奥氮平处理过的前脂肪细胞3T3-L1分化为成熟脂肪细胞时,甘油三酯聚集,并伴随SREBP-1及其下游基因脂肪酸合成酶及脂联素过表达。Hu等[20]也发现黄连素能通过抑制SREBP-1来对抗奥氮平、利培酮引起的体重增加。Hellard等[21]用功能整合基因组学方法发现SGA能激活SREBP调节的脂质生物合成基因,并发现与SREBPs相互作用的胰岛素诱导蛋白2(INSIG2)基因中的3个单核苷酸多态性 (rs17587100,rs10490624,rs17047764)与SGA引起的体重增加紧密关联。Kristian等[22]发现SGA抑制脂蛋白源性胆固醇转运到内质网中被酯化;激活SREBPs,上调脂质合成基因表达,从而干扰胆固醇的内转运和脂质合成。
1.3.2 腺苷酸活化蛋白激酶(AMP-activatedproteinkinase,AMPK)通路 已知在下丘脑中瘦素通过AMPK的磷酸化来调节腹部脂肪。目前研究提出AMPK活化后调节外周脂肪酸、胆固醇、糖代谢及相关蛋白合成的主要基因表达,同时抑制ATP合成加速能量消耗直到能量平衡。有研究报道奥氮平、氯氮平可以选择性地活化下丘脑的AMPK来调节脂肪的代谢。Park等[23]用卵巢切除大鼠发现,奥氮平可以增强AMPK的磷酸化,提出雌激素可以改善SGA引起的能量代谢障碍。
同样,AMPK也是调节肝能量代谢的重要因子,活化后可抑制肝细胞脂肪合成及刺激脂肪酸氧化。Kyoung等[24]发现SGA抑制了肝内的AMPK信号,并下调脂肪酸氧化基因表达,并发现AMPK信号异常后减少乙酰辅酶A脂合成及线粒体脂肪酸氧化,促使脂肪堆积及肝细胞脂肪合成。另外还发现,AMPK还可以通过SREBPs途径诱导肝的脂肪酸氧化。
1.3.3 脂联素 脂联素是脂肪细胞分泌的调节脂肪合成与分解代谢的一种激素。Togo等[25]首次提出精神分裂症患者在应用奥氮平或氯氮平后血清脂联素升高。但在逐渐肥胖的患者中脂联素水平又是下降的。在服用奥氮平的非肥胖/非糖尿病患者中,血清脂联素增加。Hanssens等[26]发现脂联素水平与体量指数(body mass index,BMI)负相关,伴代谢综合征的患者脂联素水平显著低,血糖正常的患者脂联素水平显著高于糖尿病患者,但仅在男患者中观察到。Hanssens等[27]也提出在服用SGA时,脂联素水平与代谢紊乱风险成反比。最近Albaugh等[9]的研究发现SGA可能是通过改变葡萄糖-脂肪酸循环 (Randle循环)引起代谢紊乱。
1.3.4 其它因素 临床上普遍认为SGA升高血脂,减弱胰岛素的敏感性,干扰糖脂代谢稳态,腰围、BMI与IR/糖尿病密切相关。一些研究提出SGA引起体重增加主要是由于脂肪组织的增加,Minet-Ringuet等[12]提出奥氮平使脂肪细胞肥大及白色脂肪堆积。Zhang等[28]用MRI定位发现服用SGA10周后体内脂肪增多,伴瘦素水平升高,认为SGA扰乱瘦素功能使脂肪异常分布。但Ryan等[29]的研究认为SGA治疗不会增加腹部脂肪,甚至有学者提出SGA治疗可使自由脂肪酸(free fat acid,FFA)水平降低。最近Albaugh等[9]也支持慢性奥氮平治疗可引起FFA下降,认为其不适当地增加脂肪的利用及分解抑制,可能是乙酰辅A羧化酶受抑制。Ferno等[30]提出由于氯氮平引起脂肪酸敏感转录因子-过氧化物酶体增殖子-α受体活化使肝脏脂肪变性及脂肪异常堆积。Smith等[13]通过对正常人的研究认为,是奥氮平抑制了脂肪细胞的脂蛋白脂肪酶活性而致脂肪异常代谢。
SGA动物模型在研究脂肪代谢中给了许多有意义的提示,但同时我们也应该考虑到这类模型可能并不太合适。首先,SGA不能诱发成动脉硬化模型,其次,血脂水平也与人类相差很大,由于大鼠是低低密度脂蛋白和高密度脂蛋白胆固醇水平,对脂代谢的研究应该应用更多合适品种如兔或者基因修饰动物。
2 代谢异常的中枢机制
中枢神经递质假说是最为广泛接受的精神病发病机制假说,神经递质与代谢的联系也是复杂多样。目前认为SGA可能通过神经递质信号干扰正常摄食与饱食中枢,增强食欲,导致代谢紊乱。近年来对神经递质信号引起体重增加的理论主要集中在去甲肾上腺素(NE)、乙酰胆碱(Ach)、多巴胺(DA)、组胺、5-羟色胺(5-HT)及其受体上:如NE受体α2兴奋可致体重增加及脂肪分解异常[31-32];乙酰胆碱受体M3(M-AChR M3)兴奋引起摄食增多及体重增加;神经肽Y增加摄食;慢性阻断组胺H1受体与体重显著增加相关;下调H1的mRNA表达可导致摄食增加及体重显著增加;5HT-2C受体活化影响瘦素效应间接增加摄食。引起这种变化最明显的SGA是氯氮平与奥氮平,它们主要是通过影响以上神经递质及受体功能引起脂代谢失调、BMI增加、体重增加等一系列的代谢紊乱问题[33]。
神经递质受体的遗传多态性可影响SGA诱导代谢紊乱的易感性。最近Melkersson等[34]分析5-HT受体2A(HTR2A)基因多态性与糖代谢及 BMI的关系时发现携带[-1438A,-783A,102T,452Tyr]等位基因引起的代谢风险最小。Al-Janabi等[35]发现5-羟色胺转运体基因相关多态性区(-15370A/G)、5-HT2A(102T/C)与 BMI关联,合成 5-HT的色氨酸羟化酶(-366C/T)与糖尿病关联,提示5-HT相关的多态性在SGA导致代谢不良反应中的重要作用。此外,Liu等[36]也发现肾上腺素能受体的ADRA1A基因启动子和内含子区域中的44个SNP与BMI相关,且与女性的关联更强。
3 其它机制
SGA引起代谢异常还可能通过其它途径,目前已知肿瘤坏死因子(TNF),白介素(IL-2,IL-6)及粒细胞集落刺激因子(G-CSF)等重要的炎症因子与代谢紊乱(如体重增加、IR、糖尿病及心脏疾病等)也有关。Baptista等[37]发现肿瘤坏死因子-α(TNF-α)水平与BMI增加相关。目前SGA在这方面的研究主要聚焦在TNF-α、可溶性肿瘤坏死因子-1(sTNFR-1)及可溶性肿瘤坏死因子-2(sTNFR-2)上,以及各种细胞因子表型及受体水平[38-39]与体重改变等。
4 小结
SGA是治疗精神分裂症等精神疾病的主要药物,在其发挥所期待的临床效应时却因为存在明显的代谢紊乱不良反应而阻碍了它们的使用。为了降低这类药物的不良反应,提高用药的依从性及疗效,各界已做了大量的探索,但SGA诱导的代谢异常机制目前仍不清楚。本文从SGA导致代谢紊乱的外周、中枢机制等方面综述了代谢异常的潜在机制,为今后深入的机理研究、实施恰当的个体化治疗方案及减少临床工作的风险提供依据及线索。
[1]Melkersson K, Dahl ML.Adverse metabolic effects associated with atypical antipsychotics(literature review and clinical implications)[J].Drug,2004,64(7):1-723.
[2]Lambert BL,Cunningham FE,Miller DR,et al.Diabetes risk associated with use of olanzapine, quetiapine and risperidone in verans health administration patients with schizophrenia[J].Am J epidemiol,2006,164(7):672-681.
[3]Haddad PM,Sharma SG.Adverse effects of atypical antipsychotics[J].CNS Drugs,2007,21(11):911-936.
[4]Haupt DW.Differential.metabolic effects of antipsychotic treatments[J].Eur Neuropsychopharmacol,2006,16(Suppl 3):149-155.
[5]Lieberman JA,Stroup TS,McEvoy JP.Effectiveness of antipsychotic drugs in patients with chronic schizophrenia[J].N Engl J Med,2005,353(12):1209-1223.
[6]Muntoni S,Muntoni S.Insulin resistance:pathophysiology and rationale for treatment[J].Ann Nutr Metab,2011,58(1):25-36.
[7]Engl J,Laimer M,Niederwanger A,et al.Olanzapine impairs glycogen synthesis and insulin signaling in L6 skeletal muscle cells[J].Mol Psychiatry,2005,10(12):1089-1096.
[8]Houseknecht KL, Robertson AS, Zavadoski W, et al.Acute effects of antipsychotics on whole body insulin resistance in rats:implications for adverse metabolic effects[J].Neuropsychopharmacology,2007,32(2):289-297.
[9]Albaugh VL,Vary TC,Ilkayeva O,et al.Atypical antipsychotics rapidly and inappropriately switch peripheral fuel utilization to lipids,impairing metabolic flexibility in rodents[J/OL].Schizophr Bull,2010,[2010-12-05].http://schizophreniabulletin.oxfordjournals.org/content/early/2010/05/21/schbul.sbq053.full.pdf+html
[10]Tulipano G,Spano P,Cocchi D.Effects of olanzapine on glucose transport,proliferation and survival in C2C12 myoblasts[J].Mol Cell Endocrinol,2008,292(1-2):42-49.
[11]Tulipano G,Rizzetti C,Bianchi I,et al.Clozapine-induced alteration of glucose homeostasis in thd rat: the contribution of hypothalamic-pituitary-adrenal axis activation[J].Neuroendocrinology,2007,85(2):61-70.
[12]Minet-Ringuet J, Even PC, Goubern M, et al.Long term treatment with olanzapine mixed with the food in male rats induces body fat deposition with no increase in body weight and no thermogenic alteration[J].Appetite,2006,46(3):254-262.
[13]Smith GC,Chaussade C,Vickers M,et al.Atypical antipsychotic drugs induce derangements in glucose homeostasis by acutely increasing glucagon secretion and hepatic glucose output in the rat[J].Diabetologia,2008,51(12):2309-2317.
[14]Martins PJ,Haas M,Obici S.Central nervous system delivery ofthe antipsychotic olanzapine induces hepatic insulin resistance[J].Diabetes,2010,59(10):2418-2425.
[15]Coccurello R,Brina D,Caprioli A,et al.30 days of continuous olanzapine infusion determines energy imbalance, glucose intolerance,insulin resistance,and dyslipidemia in mice[J].J Clin Psychopharmacol,2009,29(6):576-583.
[16]Barbaccia ML,Affricano D,Purdy RH,et al.Clozapine,but not haloperidol,increases brain concentrations of neuroactive steroids in the rat[J].Neuropsychopharmacology,2001,25(4):490-497.
[17]Marx CE,VanDoren MJ,Duncan GE,et al.Olanzapine and clozapine increase the GABAergic neuroactive steroid allopregnenolone in rodents[J].Neuropsychopharmacology,2003,28(1):1-13.
[18]Albaugh VL,Henry CR,Bello NT,et al.Hormonal and metabolic effects of olanzapine and lozapine related to body weight in rodents[J].OBESITY,2006,14(1):36-51.
[19]Yang LH,Chen TM,Yu ST,et al.Olanzapine induces SREBP-1-related adipogenesis in 3T3-L1 cells[J].Pharmacol Res,2007,56(2):202-208.
[20]Hu Y, Kutscher E, Davies GE.Berberine inhibits SREBP-1-related clozapine and risperidone induced adipogenesis in 3T3-L1 cells[J].Phytother Res,2010,24(12):1831-1838.
[21]Hellard LS,Theisen FM,Haberhausen M,et al.Association between the insulin-induced gene 2(INSIG2)and weight gain in a German sample of antipsychotic-treated schizophrenic patients:perturbation of SREBP-controlled lipogenesis in drug-related metabolic adverse effects? [J].Mol Psychiatry,2009,14(3):308-317.
[22]Kristiana I,Sharpe LJ, Catts VS, et al.Antipsychotic drugs upregulate lipogenic gene expression by disrupting intracellular trafficking of lipoprotein-derived cholesterol[J].Pharmacogenomics J,2010,10(5):396-407.
[23]Park S,Hong SM,Ahn IL,et al.Estrogen replacement reverses olanzapine-induced weight gain and hepatic insulin resistance in ovariectomized diabetic rats[J].Neuropsychobiology,2010,61(3):148-161.
[24]Kyoung KJ,Park J,Lee SY,et al.Atypical antipsychotic drugs perturb AMPK-dependent regulation of hepatic lipid metabolism[J].Am J Physiol Endocrinol Metab,2011,300(4):E624-632.
[25]Togo T,Kojima K,Shoji M,et al.Serum adiponectin concentrations during treatment with olanzapine or risperidone: a pilot study[J].Int Clin Psychopharmacol,2004,19(1):37-40.
[26]Hanssens L,van Winkel R,Wampers M,et al.A cross-sectional evaluation of adiponectin plasma levels in patients with schizophrenia and schizoaffective disorder[J].Schizophr Res,2008,106(2-3):308-314.
[27]Hanssens L,van Winkel R,Wampers M,et al.A cross-sectional evaluation ofadiponectin plasma levels in patients with schizophrenia and schizoaffective disorder[J].Schizophrenia Res, 2008,106:308-314.
[28]Zhang ZJ,Yao ZJ,Liu W,et al.Effects of antipsychotics on fat deposition and changes in leptin and insulin levels.Magnetic resonance imaging study of previously untreated people with schizophrenia[J].Br J Psychiatry,2004,184:58-62.
[29]Ryan MC,Flanagan S,Kinsella U,et al.The effects of atypical ntipsychotics on visceral fat distribution in first episode, drugnaive patients with schizophrenia[J].Life Sciences,2004,74(16):1999-2008.
[30]Ferno J,Vik-Mo AO,Jassim G,et al.Acute clozapine exposure in vivo induces lipid accumulation and marked equential changes in the expression of SREBP PPAR and XR target genes in rat liver[J].Psychophamacolgy(Berl),2009,203(1):73-84.
[31]Wang Y C,Bai YM,Chen JY,et al.Polymorphism of the adrenergic receptor alpha-2a-1291CNG genetic variation and clozapine induced weight gain[J].J Neural Transm,2005,112(11):1463-1468.
[32]Park YM,Chung YC,Lee SH,et al.Weight gain associated with alpha 2a-adrenergic receptor-1291CNG polymorphism and olanzapine treatment[J].Am J Med Genet B Neuropsychiatr Genet,2006,141B(4):394-397.
[33]Vergara-Rodriguez P, Vibhakar S, Watts J, et al.Metabolic syndrome and associated cardiovascular risk factors in the treatment of persons with human immunodeficiency virus and severe mental illness[J].Pharmacol Ther,2009,124(3):269-278.
[34]Melkersson KI,Gunes A,Dahl ML.Impact of serotonin receptor 2A gene haplotypeson C-peptide levelsin clozapine-and olanzapine-treated patients[J].Hum Psychopharmacol,2010,25(4):347-352.
[35]Al-Janabi I,Arranz MJ,Blakemore AI,et al.Association study of serotonergic gene variants with antipsychotic-induced adverse reactions[J].Psychiatr Genet,2009,19(6):305-311.
[36]Liu YR,Loh EW,Lan TH,et al.ADRA1A gene is associated with BMI in chronic schizophrenia patients exposed to antipsychotics[J].Pharmacogenomics J,2010,10(1):30-39.
[37]Baptista T,Beaulieu S.Are leptin and cytokines involved in body weight gain during treatment with antipsychotic drugs[J].Can J Psychiatry,2002,47(8):742-749.
[38]Kluge M,Schacht A,Himmerich H,et al.Effects of clozapine and olanzapine on cytokine systems are closely linked to weight gain and drug-induced fever[J].Psychoneuroendocrinology,2009,34(1):118-128.
[39]Zai G,Müller DJ,Volavka J,et al.Family and case-control association study of the tumor necrosis factor-alpha (TNF-alpha)gene with schizophrenia and response to antipsychotic medication[J].Psychopharmacology,2006,188(2):171-182.
(责任编辑:曹莉萍)
2011-01-12)
☆ 国家自然科学基金资助项目(编号:30670755),上海市浦江人才计划 (编号:10PJ1408800),上海市自然科学基金 (编号:06ZR14147)
* 上海交通大学医学院附属精神卫生中心(上海 230030)
△ 耶鲁大学医学院内科
