血管内皮细胞生长因子165在诱导骨髓间充质干细胞内皮化中的作用
2010-05-25马俊伟常楚战杰梁晓旭
马俊伟,常楚,战杰,梁晓旭
(1.中国医科大学 附属一院骨科,沈阳 110001;2.沈阳医学院 奉天医院手外科,沈阳 110024)
骨髓间充质干细胞(mesenchymal stem cells,MSCs)因其具有低免疫原性、多向分化及高增殖潜能而倍受关注。MSCs和血管内皮细胞同来源于中胚层,理论上具有向血管内皮细胞分化的可能。我们采用健康Wistar大鼠的MSCs,研究其体外诱导分化为血管内皮细胞的能力和相应诱导条件,为组织工程的应用创造条件。
1 材料与方法
1.1 主要试剂及仪器
血管内皮细胞生长因子165(vascular endothelial growth factor 165,VEGF165),美国 PeproTech 公司;L-DMEM培养液、胎牛血清、胰蛋白酶,美国Gibco公司;血管内皮细胞生长因子受体1(vascular endothelial growth factor receptor-1,VEGFR-1/Flt-1)抗体、浓缩型免疫组化试剂盒,武汉博士德生物工程有限公司;YJ-875型超净工作台,苏州净化设备厂;倒置相差显微镜,日本Olympus公司。
1.2 MSCs分离培养
将Wistar大鼠(体质量100 g左右,雌雄不限,中国医科大学实验动物中心提供)处死后,无菌条件下取出大鼠股骨和胫骨,用PBS冲出骨髓,充分混匀后按1∶2比例缓慢加在比重为1.073 g/L的percoll分离液上,2 000 r/min离心30 min,吸取液面交界处的单个核细胞,L-DMEM培养液洗涤2次。将上述细胞以1×106/cm2密度接种于含10%胎牛血清的L-DMEM培养基(含100 U/ml青霉素和100 U/ml链霉素)的25 cm2培养瓶中,置于37℃、饱和湿度、5%CO2培养箱中进行原代培养,24 h后吸出未贴壁细胞悬液重新培养,排除成熟内皮细胞的干扰,以后每3 d换液1次,除去非贴壁细胞。每日在倒置相差显微镜下观察并记录原代细胞生长情况,待细胞80%以上融合后用0.25%胰蛋白酶消化按1∶2比例传代,传至第3代的MSCs作为种子细胞。
1.3 细胞诱导分化条件
根据培养液将其分组,A组:为基础液,含有10%胎牛血清 L-DMEM、维生素 C(50 μg/ml)、青-链霉素(100 U/ml);B 组:A 组基础液+5 ng/ml VEGF165;C组:A组基础液+10 ng/ml VEGF165;D组:A组基础液+50 ng/ml VEGF165;E 组:A 组基础液+100 ng/ml VEGF165。将传至第3代细胞分别接种于相应的培养板中,加入相应的培养液进行培养观察。
1.4 MTT法检测VEGF165对MSCs增殖的影响
将细胞按每孔200μl接种于96孔培养板中,每组3孔,移入37℃、5%CO2培养箱,培养24 h后,每孔中加MTT溶液20μl,继续培养4 h,终止培养,轻轻吸弃孔内培养液,每孔加入150μl DMSO,振荡10 min。在酶联免疫检测仪于波长570 nm(630 nm校准)测量吸光度(A)值。
1.5 细胞诱导分化
用0.25%胰蛋白酶消化生长状态良好的体外培养的第3代大鼠MSCs,终止消化,离心,弃上清,用含有10%胎牛血清的L-DMEM培养液再悬细胞,并稀释形成密度为1×106/ml的液体,加入事先配好的各组培养液混匀后接种于6孔培养板中培养14 d。每3 d换液1次,每日镜下观察细胞形态变化。
1.6 VEGFR-1/Flt-1免疫细胞化学染色
分别收集各组培养14 d后的细胞,PBS洗2~3次,每次5 min,无水甲醇固定20 min,滴加3%H2O2,室温静置30 min,滴加正常山羊血清封闭液,室温20 min,滴加一抗,室温静置1 h,滴加二抗40~50μl,37℃ 2 h,PBS洗 4次,每次 5 min,DAB 显色5~10 min,在显微镜下掌握染色程度,苏木素复染、封片,镜检,记录VEGFR-1/Flt-1染色细胞阳性率。
1.7 统计学分析
数据采用SPSS13.0统计软件进行分析,P<0.05为差异有统计学意义。
2 结果
2.1 MSCs体外培养
第1~3代MSCs增长迅速,传代细胞1~3 d为潜伏期,随即快速增殖并进入对数生长期,5~6 d达高峰期,此后进入平台期。细胞接种后的最初几日,培养板中可见较多的悬浮细胞,主要为造血系细胞,随着不断的细胞换液而被清除,接种细胞于2 d左右逐渐贴壁,贴壁细胞以较为均匀的小梭形细胞为主;7 d后细胞迅速增殖;10 d左右可见典型的克隆集落,中心细胞为近圆形,密集生长,外周细胞为长梭形纤维样细胞,呈鱼群状排列。见图1。
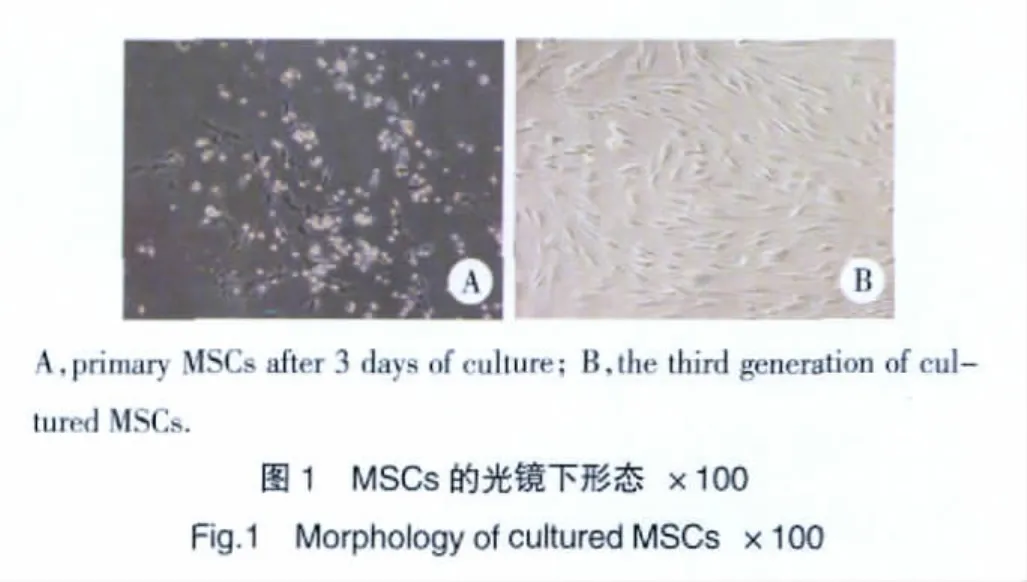
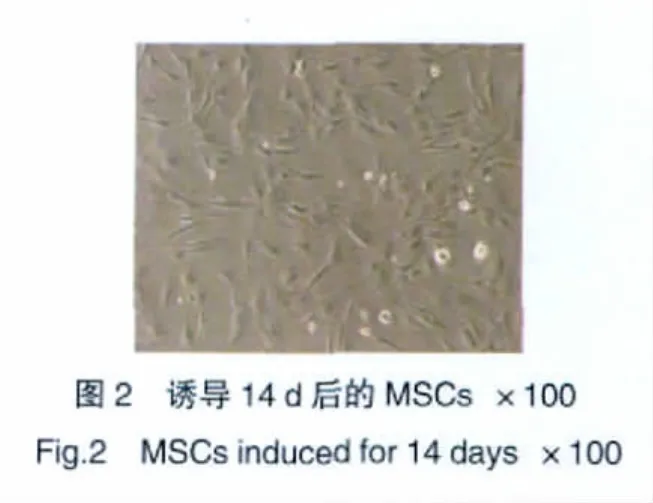
2.2 细胞诱导培养
经诱导培养后,B、C、D、E组的细胞形态与A组比较无显著差异。B~E组细胞增殖迅速,从第7天开始融合,至诱导后14 d达到相互融合(图2)。
2.3 VEGF165对MSCs增殖的影响
培养 24 h 后,A、B、C、D、E 组吸光度值平均分别为 0.358 0±0.033 2、0.580 6±0.073 9、0.627 8±0.079 6、0.175 8±0.053 7 和 0.202 4±0.012 5,B 组、C组与A组比较,B组与C组比较,差别均有统计学意义(P<0.05),B、C组具有明显的促进增值作用,且C组促增殖作用明显强于B组;D组、E组与A组比较,差别也有统计学意义(P<0.05),D、E组的促增殖作用不如A组。
2.3 VEGFR1/Flt1免疫组化染色结果及细胞阳性率
MSCs经过 14d 的培养,A、B、C、D、E 组 VEGFR-1/Flt-1免疫组化染色细胞阳性率分别为(2.159 8±0.255 5)%、(30.3591±5.1687)%、(44.7643±2.1011)%、(56.0111±2.9603)%、(86.2438±0.9663)%。其中任意 2组比较差异均有统计学意义(P<0.05),随着浓度的增高,被染为棕黄色的阳性细胞比例逐渐增高。见图3。

3 讨论
MSCs是源于骨髓基质的一类间充质干细胞,在过去的十年间受到了广泛的关注和深入的研究。它们以前被认为在红细胞生成过程中起关键作用[1],但是近年来其自我增殖和多项分化潜能逐渐成为一个研究热点。目前,国内外学者对MSCs的组织工程学应用研究较多,多将MSCs诱导分化为骨、软骨、脂肪等组织细胞。
目前实验中所使用的促骨髓基质干细胞向血管内皮细胞诱导分化的因子有很多,Norrby[2]描述了38种之多,然而在动物模型实验中广泛使用的仍然是VEGF和bFGF。VEGF是在1970年被Dvorak及其助手发现的,以其再生血管活力而周知,但血管化和血管发生的分子机制尚不完全清楚,甚至是有争议的[3,4]。尽管如此,最近仍然有不同的学者采用不同的方法诱导MSCs向血管内皮细胞分化获得成功,但是其中大多是采用了包含VEGF在内的多种因子联合诱导的鸡尾酒式的方法[5],但是对于单纯使用VEGF诱导的报道相对较少,并且对于如何才能提高诱导率未提及[6]。本研究不仅单独应用VEGF165诱导MSCs向血管内皮细胞分化获得成功,并且根据文献报道的各种实验结果,根据不同的VEGF165浓度设置了分组实验并证明其诱导效果并不相同。此外,本研究还证明VEGF在促进MSCs的作用,我们发现保持高浓度的VEGF165(50 ng/ml)并不能够提高MSCs的增殖,其促进增殖作用反而不如低浓度组,而保持相对的高浓度对于促进诱导分化具有良好作用。对于诱导后的血管内皮细胞检测,现在的试验大多检测 CD34、CD31、vWF、Flk-1 等血管内皮细胞特有表面标志,本研究选用了Flt-1作为检测指标,Flt-1不但与Flk-1/KDR共同调控内皮细胞的分裂,而且通过影响Flk-1的信号转导调控毛细血管的出芽生长,在血管新生中起主要作用[7]。Flt-1在MSCs表面不表达,诱导分化2周以后,我们发现试验各组Flt-1均有不同程度的表达,且VEGF165浓度在50和100 ng/ml时表现出更强的血管内皮细胞诱导能力,其Flt-1表达更加强烈。
尽管MSCs具有广阔的临床应用前景,但目前研究仅处于起步阶段,有待于继续攻克一些难题,例如:(1)如何找到最具价值的MSCs的特异性表面标记,对其分离纯化;(2)MSCs多向分化的生物学机制及其中是否存在发生可以向血管内皮细胞诱导分化分化的亚群;(3)MSCs向血管内皮细胞诱导分化的最佳条件是什么,如何提高诱导率。
我们相信,随着对上述问题的进一步认识和解决,以MSCs细胞为基础的细胞、基因和组织工程治疗手段在临床有关复杂器官组织工程血管化及细胞移植修复损伤组织等方面具有巨大的发展前景。
[1]Dexter TM,Spooncer E,Schofield R,et al.Hematopoietic stem cells and theproblemof self-renewal[J].Blood Cells,1984,10(2-3):315-339.
[2]Norrby K.Angiogenesis:new aspectsrelatingtoitsinitiation and control[J].APMIS,1997,105(6):417-437.
[3]Xu J,Liu X,Jiang Y,et al.MAPK/ERK signaling mediates VEGF-induced bone marrow stem cell differentiation into endothelial cell[J].JCell Mol Med,2008,12(6A):2395-2406.
[4]Ball SG,Shuttleworth CA,Kielty CM.Mesenchymal stem cells and neovascularization:role of platelet-derived growth factor receptors[J].JCell Mol Med,2007,11(5):1012-1030.
[5]胡昕婴,史剑慧,牛玉宏,等.体外定向诱导人骨髓基质干细胞内皮化[J].复旦学报(医学版),2004,31(4):336-339.
[6]Oswald J,Boxberger S,J准rgensen B,et al.Mesenchymal stem cells canbedifferentiatedintoendothelialcellsinvitro[J].StemCells,2004,22(3):377-384.
[7]Kearney JB,Kappas NC,Ellerstrom C,et al.The VEGFreceptor flt-1(VEGFR-1)is a positive modulator of vascular sprout formation and branchingmorphogenesis[J].Blood,2004,103(12):4527-4535.
