不同血清对驴卵泡颗粒细胞体外培养的影响
2021-12-06郭旭川王艳萍张强王璐曾维斌
郭旭川,王艳萍,张强,王璐,曾维斌
(石河子大学动物科技学院,新疆 石河子 832003)
卵泡颗粒细胞作为卵泡内重要的功能细胞,通过缝隙连接与卵母细胞相连,对卵母细胞生长,卵泡发育、成熟及微环境的维持起重要作用,二者关系紧密,卵母细胞指导颗粒细胞的增殖、分化,颗粒细胞的发育状态会影响卵母细胞的质量和随后胚胎的发育潜能[1]。因此,颗粒细胞的生长状态将直接影响卵细胞的发育,进而影响动物的繁殖性能,通过对颗粒细胞发育分子层面的研究,可在一定程度上揭示卵巢卵泡发育的机制[2]。研究发现,颗粒细胞的凋亡可导致卵泡闭锁,其功能受损将抑制其雌激素的分泌[3]。因此颗粒细胞是研究卵泡发育及内分泌的重要细胞材料。血清因含促进细胞生长的各种营养成分和细胞因子,成为细胞培养液的重要成分。目前,胎牛血清(FBS)已普遍用于各种动物体外组织的培养,但考虑到其生物安全性、动物福利及效率,国内外许多学者对培养材料的自体血清培养效果进行了探究,证实了自体血清的优越性[4-5]。但驴自体血清对驴卵泡颗粒细胞培养的效果未见报道。
MTT法是一种利用酶标仪快捷检测细胞增值的方法,所测得的光吸收值与活细胞数成正比。划痕实验在一定程度上模拟了体内细胞迁移侵袭的过程,可以直观的判定细胞的迁移能力。Annexin V-FITC/PI具有特殊的理化特性,可对不同状态细胞进行着色,经流式细胞仪可以将细胞分为4个不同的亚群,从而分析出凋亡细胞比例。超氧化物歧化酶(SOD)具有极强的抗氧化性,可清除体内自由基,防止自由基对细胞结构的损伤,检测SOD活性在一定程度上可以反映细胞的活力[6]。基因BAX和BCL-2分别是BCL-2家族中最具代表性的促进凋亡和抑制凋亡基因,BCL-2/BAX比值决定细胞是否进入凋亡状态,当细胞内BCL-2因子较多时,BCL-2和BAX的异源二聚体增多,凋亡趋势减弱;当细胞内BAX较多时,则BAX本身形成的同源二聚体占主导,则易于发生凋亡[7]。自噬在维持细胞水平和整个生物体内的能量稳态方面具有极为重要的作用,ATG7在自噬体形成的过程中作为激活酶参与了ATG12-ATG5-ATG16L1和ATG8-PE 两个关键自噬复合体的形成,是一种关键酶,它的降低会导致细胞自噬水平的降低[8]。
本研究通过测定体外培养驴卵泡颗粒细胞的增殖、迁移、凋亡及自噬情况,比较含驴自体血清与胎牛血清的细胞培养液对颗粒细胞的培养效果,为建立驴卵泡颗粒细胞安全、高效的培养方法提供依据。
1 材料与方法
1.1 试验试剂
DMEM、胎牛血清(Hyclone),青链霉素、MTT、ANNEXIN V-FITC/PI凋亡检测试剂盒(Solarbio),胰蛋白酶购自(Gibco),超纯RNA提取试剂盒、反转录试剂盒、SYBR Green Ι(康为世纪),超氧化物歧化酶(SOD)检测试剂盒(南京建成生物工程研究所)。
1.2 驴自体血清的制备
选取3头健康状态良好的母驴,用真空采血管颈静脉采集全血30 mL,室温静置2 h,4℃过夜,3 000 r·min离心10 min,取淡黄色上清液,无菌条件下用0.22 μm滤菌器过滤,56 ℃水浴15 min,灭活血清补体,-20 ℃冷冻保存备用。
1.3 原代卵泡颗粒细胞的分离培养
将采自石河子九昌驴业有限公司屠宰的健康、性成熟母驴的离体卵巢置于含双抗的37 ℃生理盐水中,2 h内运回实验室。无菌环境下,用注射器抽取卵泡液并置于15 mL离心管,1 000 r·min-1离心5 min,PBS洗涤2遍,加入预先配制好的完全培养液(90%DMEM+10%FBS +100 IU·mL-1青霉素+100 μg·mL-1链霉素)悬浮后,调整细胞浓度为(0.5~1)×105个·mL-1,接种于60 mm培养皿中,轻轻晃动,使细胞分散均匀,再加入2 mL培养液置于37 ℃、5%CO2、饱和湿度培养箱中培养。24 h后观察细胞生长情况,并更换培养液,待细胞铺满至80%~90%时进行传代。
1.4 MTT法测定不同血清对驴卵泡颗粒细胞增殖的影响
当第二代卵泡颗粒细胞长至90%以上时,胰蛋白酶消化,重悬细胞,调整细胞数为1×105/mL,按200 μL·孔-1接种于96孔培养板中。培养24 h完全贴壁后,弃培养液,并分别加入含10%胎牛血清,5%、10%、15%驴自体血清培养液。分别培养12、24、48、72、96 h后弃培养液,再加入含有MTT的培养液120 μL(MTT∶DMEM=1∶5)培养4 h后弃培养液,每孔加入150 μL DMSO,37 ℃孵育10 min,酶联免疫分光仪490 nm测定吸光度,以培养时间为横轴、吸光值OD490均值为纵轴,绘制细胞生长曲线。
1.5 细胞划痕实验
将第二代颗粒细胞接种至12孔板,培养细胞融合至80%~90%后,采用200 μL Tip头在培养皿中间划出一条直线,PBS洗去脱落细胞,形成一条“裸露”区域。分别加入含10%胎牛血清,5%、10%、15%驴自体血清培养液,培养至24、48、72 h时在倒置相差显微镜下观察裸露区域的细胞迁移状态并拍照,Image J软件计算划痕汇合面积,汇合率=(0 h划痕面积-检测时划痕面积)/0 h划痕面积*100%。
1.6 流式细胞术测定细胞凋亡
收集第二代对数生长期细胞,12孔板铺板每孔104~105个。孵育至细胞铺满孔底,分别加入含10%胎牛血清,5%、10%、15%驴自体血清培养液,对照组(DMEM+双抗),孵育24 h。将贴壁的颗粒细胞用0.25%胰酶消化,室温1 000 r·min-1离心5 min,收集细胞。用4 ℃ 预冷PBS洗涤2次,加入1 mL 1×Binding Buffer悬浮细胞,调整细胞为1×106个·mL-1。每管中加入100 μL细胞(1×105个),再加入5 μL的Annexin V-FITC混匀后,室温避光孵育15 min,再加入5 μL PI,室温避光孵育5 min,加入PBS至500 μL,轻轻混匀,1 h内用流式细胞仪检测。
1.7 细胞SOD活性的测定
按照SOD活性检测试剂盒说明书操作。
1.8 凋亡及自噬相关基因相对表达量测定
第三代细胞贴壁后更换不同血清培养液培养72 h,用RNA试剂盒提取各组细胞总RNA,反转录试剂盒将其反转录为cDNA,RT-qPCR测定细胞凋亡及自噬相关基因BAX、BCL-2、ATG7的相对表达量。定量相关基因引物序列见表1,引物由上海生工合成。

表1 实时荧光定量PCR引物序列
1.9 数据分析
所得数据用SPSS 21.0软件单因素方差分析进行统计学处理,所有试验至少重复3次,结果采用“平均值±标准差”表示,P<0.05或P<0.01分别表示数据间差异显著或极显著。
2 结果与分析
2.1 不同血清对驴卵泡颗粒细胞增殖的影响
如图1所示,经MTT法检测,与添加10%的胎牛血清组相比,添加驴自体血清各组OD值均高于胎牛血清组;48 h后,含15%驴自体血清组的OD值较快速升高;72 h后,生长曲线趋于平缓,但各时间段内细胞生长增殖的OD值之间没有显著差异(P>0.05)。
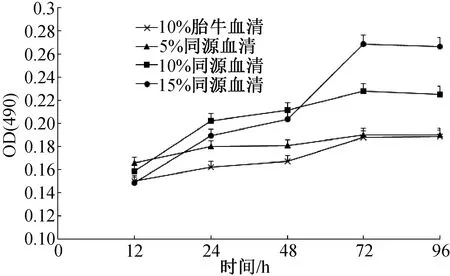
图1 不同血清对驴卵泡颗粒细胞增殖的影响
2.2 不同血清对驴卵泡颗粒细胞迁移能力的影响
如图2所示,随着培养时间的延长,每组划痕区域宽度都不断变窄,可明显观察到新生细胞爬至划痕区。划痕汇合率如表2所示,培养24 h后,10%自体血清组极显著高于10%胎牛血清组(P<0.01);培养48 h,10%自体血清组极显著高于除15%自体血清组外的其他各组(P<0.01);培养72 h,10%胎牛血清组极显著低于其他各组(P<0.01),10%自体血清组最高为(88.37±1.93)%,细胞基本汇合。此表明驴自体血清各组细胞的迁移能力均优于胎牛血清组。

图2 不同血清对驴卵泡颗粒细胞迁移能力的影响(100×)
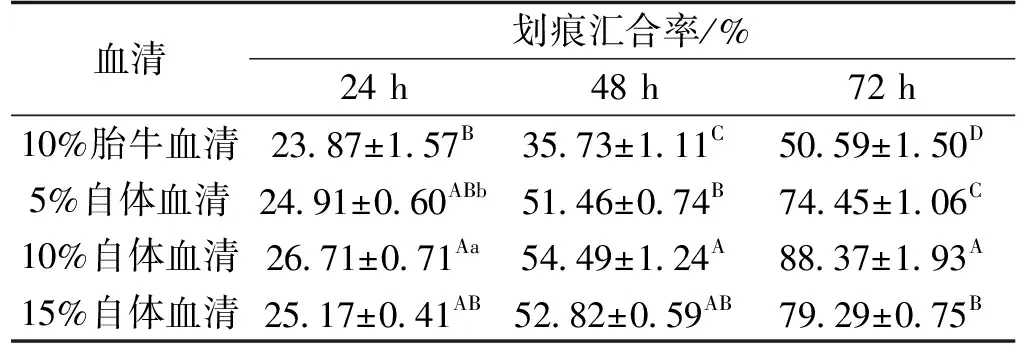
表2 不同血清组颗粒细胞划痕汇合率
2.3 不同血清对驴卵泡颗粒细胞凋亡的影响
如图3所示,经流式细胞仪分析,各组散点图中四个象限Q1、Q2、Q3、Q4分别代表机械性损伤细胞、晚期凋亡细胞、活细胞、早期凋亡细胞所占比例,细胞凋亡率为Q2与Q4之和;柱状图中含10%胎牛血清组细胞凋亡率极显著高于不同浓度自体血清组凋亡率(P<0.01),而含10%自体血清组凋亡率最低15.10%±0.26%。
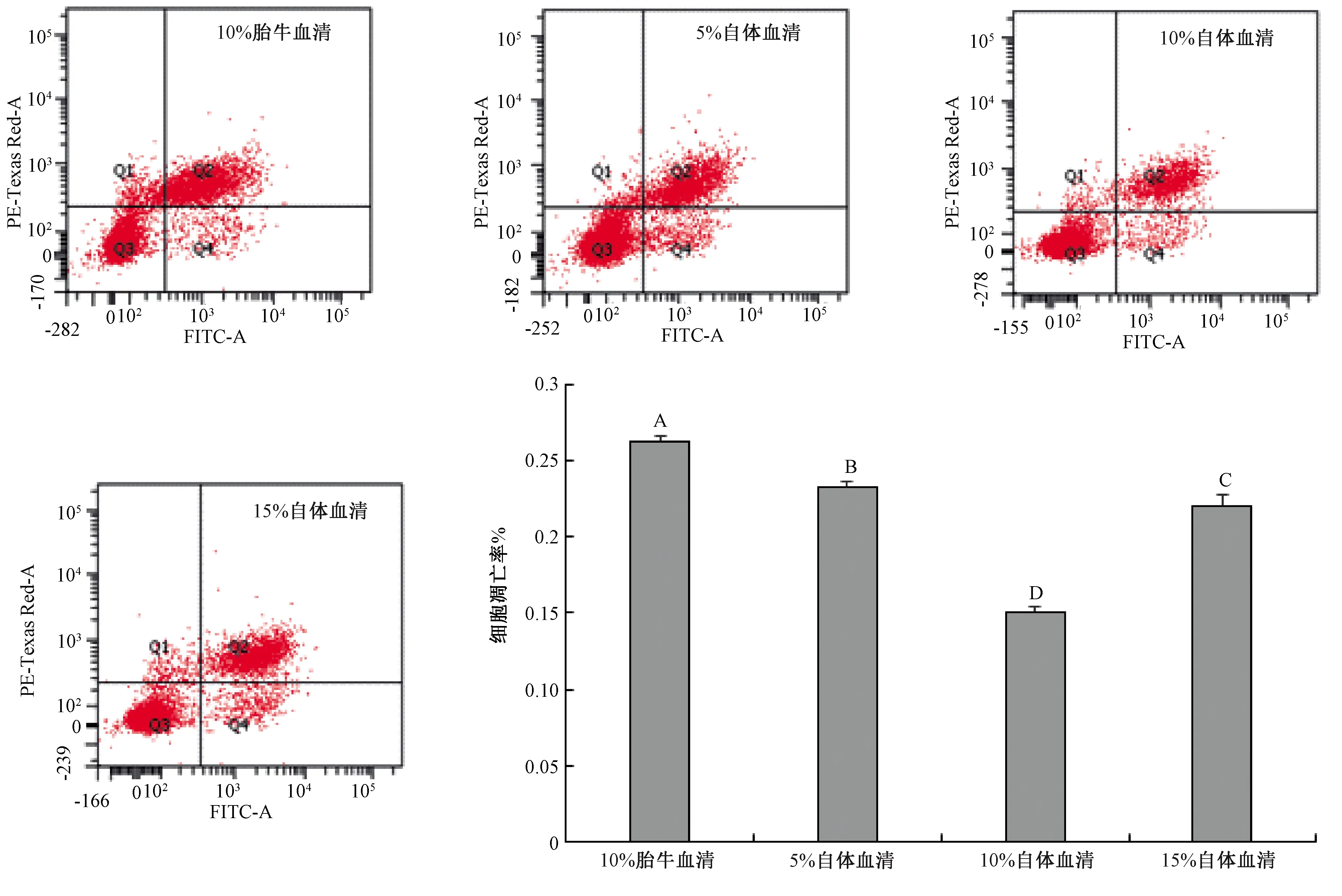
图3 不同血清组驴卵泡颗粒细胞凋亡率
2.4 不同血清对卵泡颗粒细胞内SOD含量的影响
如图4所示,含10%自体血清组SOD活力极显著高于其他组(P<0.01)。而10%胎牛血清组SOD活力极显著高于含5%自体血清组(P<0.01),显著高于含15%自体血清组(P<0.05),5%自体血清组SOD活力最低。

图4 不同血清组驴卵泡颗粒细胞内SOD活力
2.5 不同血清对卵泡颗粒细胞凋亡及自噬相关基因相对表达量的影响
如图5所示,促进凋亡基因BAX与自噬基因ATG7在含10%胎牛血清组的表达水平极显著高于其他各组(P<0.01),且含10%自体血清组为最低;抑制凋亡基因BCL-2在含10%胎牛血清组的表达水平极显著低于其他各组(P<0.01),且含10%自体血清组的表达最高。
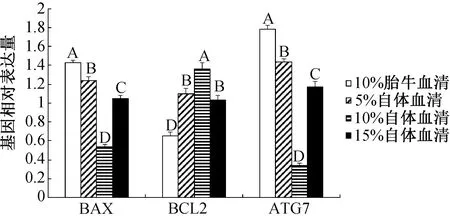
同一基因标注不同字母表示差异极显著(P<0.01), 标注相同字母表示差异不显著(P>0.05)。图5 不同血清对卵泡颗粒细胞凋亡及 自噬相关基因相对表达量影响
3 讨论
细胞培养液是各种细胞体外培养生存和增殖的基础,其成分决定培养细胞的生长状态。血清是细胞培养液中不可或缺的成分,它能提供维持细胞快速生长的各类营养物质,使培养液接近与机体内环境。而无血清培养基的成本高、培养周期长,且其稳定性和安全性仍有待提高。在细胞培养过程中血清浓度的设定亦尤为重要,浓度过高会抑制细胞生长,浓度过低则会影响细胞的增殖。胎牛血清作为动物细胞和组织培养的生长添加剂在基础研究中广泛应用,但存在一定局限性,如蛋白质和非编码RNA,在不同物种的血清中是不同的,可能有助于物种特有的作用模式,影响细胞在培养中的表性差异[9]。
自体血清与自身细胞来源于同一物种,相对而言因其保持了同源性,更接近机体内环境,能最大限度满足培养细胞生长所需的各种生长因子及细胞因子,使细胞具有更高的活力[10-11]。研究表明,相对胎牛血清,人血清可显著促进HeLa细胞迁移能力[12];不同浓度仔猪血清体外培养金华猪耳缘组织成纤维细胞,10%浓度组细胞活力强、增殖迅速[13];用含10% AB血清、自体血清和胎牛血清的基础培养基培养人骨髓基质干细胞,自体血清较胎牛血清更能促进人骨髓基质干细胞的增殖[14]。本研究通过MTT法及划痕实验也表明,驴自体血清组颗粒细胞具有优于胎牛血清组的增殖和迁移能力,尤以10%驴自体血清最优。
细胞凋亡是一种复杂的生物学现象,由多个相关基因调控。卵泡的发育与颗粒细胞凋亡过程中都有细胞自噬的存在,且自噬与凋亡之间存在紧密复杂的分子联系[15]。大鼠卵泡颗粒细胞出现凋亡时,细胞内SOD活性降低[16],SOD活性降低会使凋亡关键基因BAX上调,从而激活凋亡终末剪切酶Caspase-3促进细胞凋亡[17]。多囊卵巢综合征(PCOS)大鼠卵巢中颗粒细胞的增殖能力减弱,经治疗BCL-2/BAX比值明显升高,颗粒细胞增殖能力恢复,卵泡发育趋于正常[18]。BCL-2表达水平的下降与自噬体的积累诱导颗粒细胞的凋亡[19]。ATG7在自噬发生过程中起重要作用,特异性敲除生殖细胞的自噬诱导基因ATG7,会导致卵巢卵泡严重丢失,雌鼠生育能力低下[20]。本研究同样发现,驴体外培养颗粒细胞各组中含10%驴自体血清组凋亡基因BAX与自噬基因ATG7表达量最低,抑凋亡基因BCL-2表达量最高,BCL-2/BAX比值及颗粒细胞SOD活力显著高于同浓度的胎牛血清组,自体血清组凋亡率显著低于胎牛血清组,驴自体血清对体外培养驴卵巢颗粒细胞的生长与活力比胎牛血清具有更好的效果。
4 结论
含10%驴自体血清培养液培养的驴卵泡颗粒细胞其增殖、迁移及活力均优于含10%胎牛血清培养液,故更适合驴卵泡颗粒细胞的体外培养,但自体血清优于胎牛血清的生物学机制有待于进一步研究。
