分支杆菌噬菌体Leo生物学特性及抗结核作用
2015-06-24江莉莎邬亭亭姚义勇郭述良
江莉莎,邬亭亭,刘 平,张 莉,姚义勇,郭述良
分支杆菌噬菌体Leo生物学特性及抗结核作用
江莉莎1,邬亭亭2,刘 平3,张 莉1,姚义勇1,郭述良1
目的 明确分支杆菌噬菌体Leo的生物学特性及其抗结核作用,为“鸡尾酒疗法”筛选候选噬菌体。方法 采用双层平板法制备噬菌体Leo,观察噬菌斑形态;电镜观察噬菌体颗粒形态;提取噬菌体DNA,限制性内切酶酶切分析确定其核酸类型;以不同MOI扩增噬菌体Leo,确定最佳MOI及最低MOI;通过一步生长曲线,确定潜伏期及裂解量;采用终点滴定反浊法测定耻垢分支杆菌对噬菌体Leo的耐受突变率;检测噬菌体Leo对酒精、温度的耐受性及在不同pH下的裂解能力;通过体外杀结核分枝杆菌实验,明确噬菌体Leo对结核分枝杆菌的杀灭作用。结果 Leo噬菌斑圆形透明,边缘清晰,含对称的多面体头部,直径(70±3.0)nm, 可弯曲的尾部,尾长(211±31.7)nm;其基因组能被限制性内切酶HindⅢ、BglⅠ切开;最佳MOI为0.0 0001,最低MOI为0.0 001,潜伏期为150 min,裂解量74,耐受突变率为10-7。Leo对温度、酒精敏感,在pH 7.4和pH 5.0时均能裂解宿主菌。Leo作用于结核分支杆菌72 h后,Leo组菌量明显低于空白组(P<0.05)。结论 分支杆菌噬菌体Leo属长尾噬菌体科,双链DNA噬菌体,能够杀灭结核分支杆菌,可作为“鸡尾酒疗法”的候选噬菌体。
分支杆菌噬菌体Leo;生物学特性;结核分支杆菌
近年来,耐药结核病的流行严重威胁了人类健康和生命,而广泛耐药结核分枝杆菌的出现更加剧了这一威胁。噬菌体作为一种抗菌剂,具有特异性强、自我增殖快、来源广等其他抗菌剂无法比拟的优点,成为新型抗菌药物研究的热点之一。噬菌体疗法现阶段主要应用于铜绿假单胞菌、乳酸菌等快生长菌导致的感染,而诸如结核分枝杆菌等慢生长胞内寄生细菌的相关研究少有报道。目前此类研究主要的分枝杆菌噬菌体包括D29和TM4。彭丽[1-2]将分支杆菌噬菌体D29用于结核病的治疗,取得了良好疗效。但D29已进行了专利注册,且单一噬菌体的应用易引起细菌对噬菌体耐药变异,不利于噬菌体疗法的发展及应用,故需筛选多种噬菌体组成“鸡尾酒制剂”,以期一定程度上降低耐药变异的产生几率[3]。鉴于此,本文对分支杆菌噬菌体Leo的生物学特性及其对结核分枝杆菌的杀灭作用进行了研究,以论证其是否可为“鸡尾酒制剂”的候选噬菌体之一。
1 材料与方法
1.1 菌种和噬菌体 耻垢分枝杆菌(Mycobacterium smegmatis, MS) mc2155 (CMCC 93202)由中国药品生物制品检定所王国治教授馈赠。结核分枝杆菌标准株购于重庆市胸科医院,噬菌体Leo由加拿大拉瓦尔大学 Félix d’Hérelle 噬菌体中心提供。
1.2 噬菌体Leo制备 取10 μL 噬菌体Leo原液,用phage buffer从10-1按10倍梯度稀释到10-10。将各稀释液与100 μL 耻垢分枝杆菌混合,于室温下静置15 min后,加入3 mL 7H9半固体培养基(BD,USA)震荡混匀,再倾倒于已制备的 7H10 固体培养基(BD,USA)平皿上,冷却凝固,于37 ℃下倒置培养。次日观察噬菌斑形态及透明度。
1.3 电镜 纯化噬菌体颗粒,取20 μL噬菌体液滴于铜网上,待噬菌体自然沉降15 min后,加入20 μL 2%磷钨酸于铜网上,染色10 min,自然干燥后电镜观察噬菌体形态。
1.4 噬菌体酶切分析 取10 mL噬菌体收集液,采用λ噬菌体提取试剂盒(北京艾比根公司)。按操作规程提取噬菌体DNA。采用限制性核酸内切酶HindⅢ、BglⅠ(Canda,Fermentas Inc.)酶切噬菌体基因组。酶切反应体系置于37 ℃水浴30 min后,进行酶切产物琼脂糖凝胶电泳(电压80 V,时间90 min),DNA maker为1 000~10 000 bp。根据所得酶切图进行噬菌体DNA类型分析。
1.5 最佳感染复数和最低感染复数测定 感染复数(multiplicity of infection,MOI)是指初始感染时加入噬菌体量与宿主菌量的比值。按不同的MOI加入噬菌体和耻垢分支杆菌,7H9/7H10双层培养基37 ℃培养过夜,各点均作3份复板培养取平均值。采用平板菌落计数法测定宿主菌浓度。次日收集噬菌体,梯度稀释测定滴度,以产生最高噬菌体滴度的MOI作为最佳感染复数。并以噬菌体感染耻垢分支杆菌24 h后全部宿主菌被裂解的最小MOI作为噬菌体最低MOI。
1.6 一步生长曲线 参考李明的研究方法[4],按MOI为0.1加入噬菌体和耻垢分支杆菌,37 ℃温育15 min后离心(13 000 g 1 min)去上清,再以7H9液洗涤2次并稀释104倍,重悬沉淀,置于37 ℃摇床中震荡培养(160 r/min),开始计时。从0 min开始,每隔15 min取样离心,收集上清测定噬菌体滴度,每个时间点均重复3次。0 min 时取样100 μL 离心后沉淀与耻垢分枝杆菌混匀后铺板,产生的噬菌斑数即为感染初期感染噬菌体的宿主菌数。以感染时间为横坐标,噬菌体滴度的对数值为纵坐标,绘制一步生长曲线,并计算潜伏期和裂解量(裂解量 = 裂解末期噬菌体滴度/感染初期感染噬菌体的宿主菌数)。同时,分别设无噬菌体宿主菌培养液和无宿主菌噬菌体培养液作为对照。
1.7 耐受突变率 参考张劼的研究方法[5],采用终点滴定反浊法测定噬菌体的耐受突变率,将耻垢分支杆菌(MS)连续10倍梯度稀释(109~100CFU/mL),取1 mL分别加入无菌试管,再加入100 μL噬菌体,静置15 min后,置于37 ℃ 200 r/min振荡培养,观察72 h各管反浊情况。此时,用接种环蘸取各浓度菌液划线培养,72 h后观察是否有菌落长出及菌落形态,以验证反浊实验结果。
1.8 噬菌体对理化因素的稳定性
1.8.1 噬菌体的热稳定性 将噬菌体原液(8.7×1010PFU/mL)置于恒温水浴箱中,分别于60 ℃、70 ℃保温,每隔10 min取样,冷却至室温,经适当稀释后,双层平板法测定噬菌体滴度,并计算存活率(存活率=加热后噬菌体滴度/加热前噬菌体滴度×100%)。
1.8.2 噬菌体的酒精稳定性 将噬菌体原液10 μL(2.1×1010PFU/mL)加入990 μL 75%酒精中,同时以10 μL噬菌体原液加990 μL ddH2O作为对照。每隔10 min分别取样,经适当稀释后,双层平板法测定噬菌体滴度,并计算存活率(存活率=酒精处理组噬菌体滴度/对照组噬菌体滴度×100%)。
1.9 噬菌体在不同pH环境中的裂解能力 将7H9半固体培养基的pH值调至7.4和5.0,取等量研磨均匀的耻垢分支杆菌两份,分别与不同pH值的7H9半固体培养基混匀后,倾倒于已制备的7H10固体培养基上,制成菌苔。将Leo噬菌体液从1010PFU/mL 10倍梯度稀释到103PFU/mL,取5 μL各稀释液分别滴至不同pH值的菌苔上。37 ℃培养过夜,观察有无噬菌斑形成。
1.10 噬菌体体外杀结核分支杆菌实验 在盛有10 mL 7H9液体培养基的试管中,加800 μL研磨均匀的对数期结核分支杆菌H37Rv,并随机分成两组,实验组中加入200 μL的Leo噬菌体(2.01×1010PFU/mL),对照组中加入等量的ddH2O,放入摇床中37℃160 r/min震荡培养,每组设4个复管。分别在培养第0 h、24 h和72 h时,吸取100 μL菌液,按10倍梯度稀释至10-10,每个梯度取100 μL稀释液接种于罗氏培养管中,37 ℃恒温培养,每天观察其生长情况,30 d停止观察,进行菌落计数,并计算细菌浓度。
1.11 统计处理 各组间差异性比较采用SPSS 19.0软件(SPSS Inc.,USA)中两独立样本t检验(P<0.05)模块进行。
2 结 果
2.1 噬菌斑形态及噬菌体颗粒形态 由图1可见噬菌体Leo噬菌斑圆形透明,边缘清晰,平均直径约为1.5 mm,呈裂解性噬菌体的特征。由电镜观察可见(图2),噬菌体Leo有一对称的多面体头部,直径70±3.0 nm, 尾部可弯曲但不可收缩,尾长211±31.7nm,属于长尾噬菌体科(Siphoviridae)[6]。
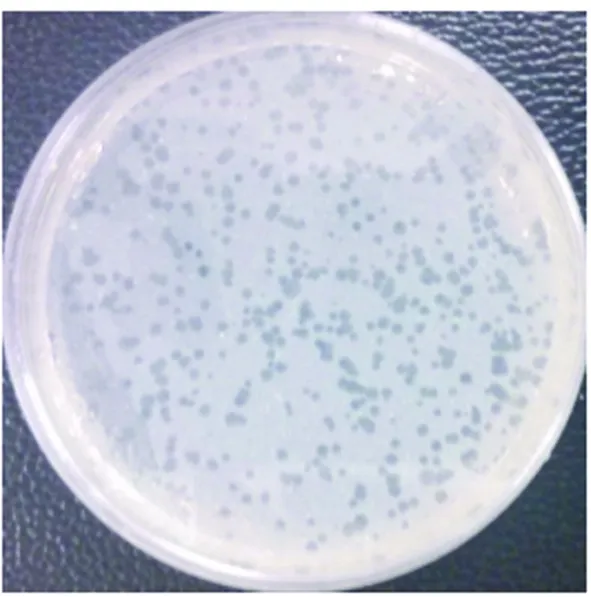
图1 Leo噬菌斑形态
2.2 噬菌体酶切分析 限制性内切酶HindⅢ、BglⅠ能够识别并切割双链DNA分子特定的核苷酸序列,而Leo基因组可被这2种酶切开,因此噬菌体Leo基因组为双链DNA(图3)。
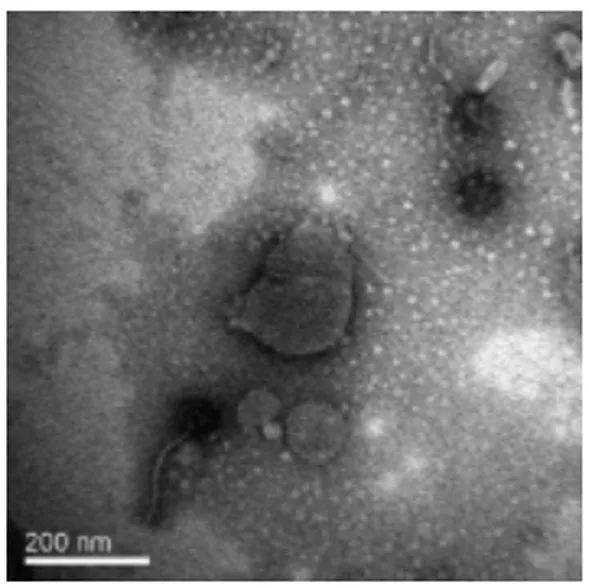
图2 Leo电镜观察(×100 000)
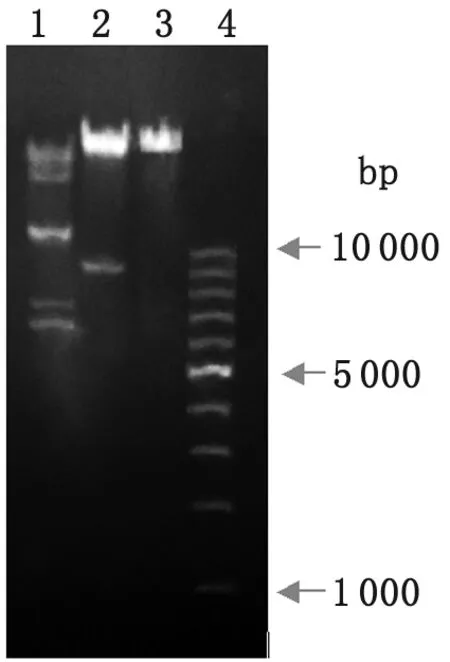
1: BglⅠ; 2: Hind Ⅲ; 3: Genome of Leo; 4: DNA maker.
2.3 最佳感染复数和最低感染复数测定 噬菌体Leo以不同的MOI分别感染耻垢分支杆菌后,检测子代噬菌体的滴度,结果见表1。当MOI为0.0 0001时,噬菌体产量最高(1.8×1010PFU/mL)。因此,可确定噬菌体Leo的最佳感染复数为0.000 01。另据表1,噬菌体感染耻垢分支杆菌24 h后平板完全透明,耻垢分支杆菌裂解完全,故确定使耻垢分支杆菌裂解完全的最低感染复数为0.000 1。
2.4 一步生长曲线 从噬菌体吸附细菌开始,到细菌释放新的噬菌体为止称为潜伏期;平均每个受感染细菌所释放的新噬菌体数称为裂解量。以感染时间为横坐标,噬菌体滴度的对数值为纵坐标,绘制一步生长曲线(图4)。曲线显示噬菌体感染宿主菌150 min后,噬菌体滴度开始上升。故噬菌体Leo的潜伏期为150 min,裂解量为74。
2.5 耐受突变率 将噬菌体分别加入各浓度耻垢分支杆菌(MS)菌液后,继续培养72 h,菌液稍变澄清后又开始由高浓度逐渐反浊,最低浓度反浊管细菌浓度为107CFU/mL。此时用接种环蘸取各浓度梯度菌液划线培养,观察长出菌落的各试管中最低浓度也为107CFU/mL,与反浊情况一致。根据终点反浊法,耐受突变率为最低浓度反浊管的细菌量的倒数。因此,噬菌体Leo的耐受突变率=1/(107CFU/mL×1 mL)=10-7。
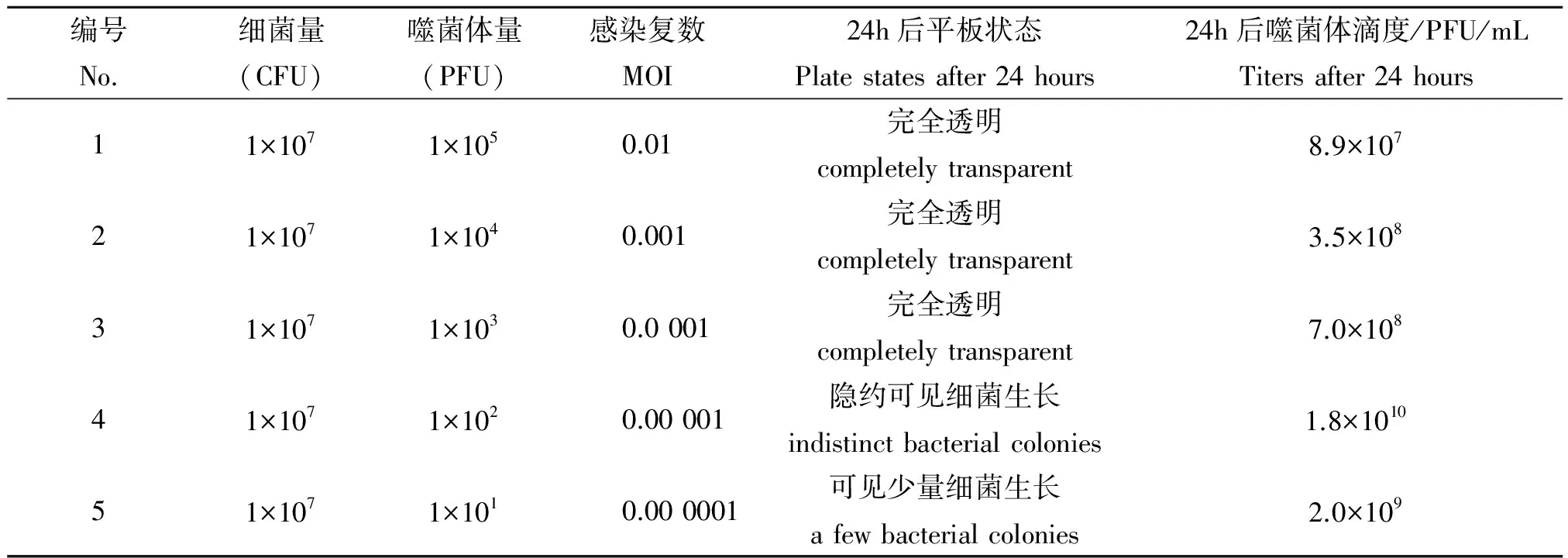
表1 最佳感染复数检测
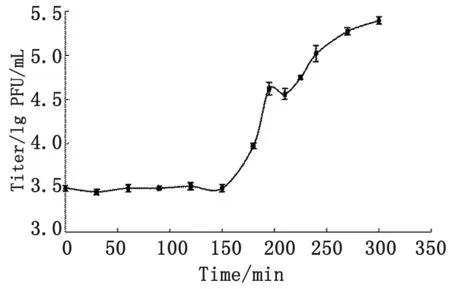
图4 一步生长曲线
2.6 噬菌体对理化因素的抵抗力 噬菌体Leo对热敏感,60 ℃恒温加热10 min后噬菌体滴度由8.7×1010PFU/mL降至1.3×105PFU/mL,存活率低于1%,但加热时间延长至20 min,仍有噬菌体存活(1.2×104PFU/mL)。而当噬菌体Leo 70 ℃恒温加热10 min时,几乎无噬菌体存活。噬菌体Leo对75%酒精亦十分敏感,作用10 min后无噬菌体存活。
2.7 噬菌体在不同pH环境中的裂解能力 结核分支杆菌是胞内寄生菌,进入人体后会被巨噬细胞吞噬。人体血液pH值为7.35~7.45,而巨噬细胞内pH值为5.0。实验证实,不管在高浓度还是低浓度,噬菌体Leo均能在pH 7.4及pH 5.0环境中裂解耻垢分支杆菌,形成噬菌斑(图5)。据此初步推测噬菌体Leo不仅能裂解血液中的结核分支杆菌,还能裂解巨噬细胞内的结核分支杆菌。
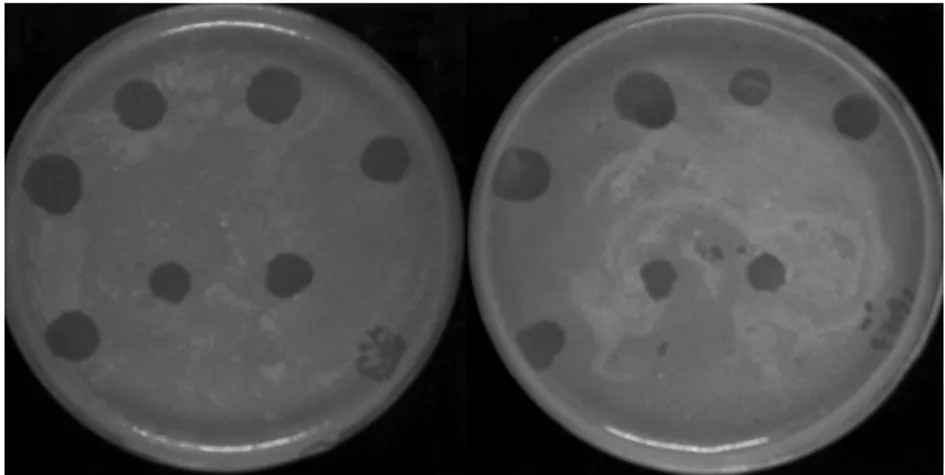
注:噬菌体滴度从左到右分别为(第一排)1010、109、108和107,(第二排)106、105、104和103。
2.8 噬菌体体外杀结核分支杆菌实验 噬菌体Leo作用于结核分支杆菌72 h,分别检测0 h、24 h和72 h Leo组与空白组菌量。由表2可知,0 h和24 h时,Leo组与空白组差异不明显(P>0.05),无统计学意义;而72 h时,Leo组与空白组差异明显(P<0.05),具有统计学意义。由此可知,当两组细菌起始浓度相同时,噬菌体Leo作用72 h后对结核分支杆菌有一定杀灭作用。
3 讨 论
2010年全国第5次结核病流行病学抽样调查报告显示:全国15岁及以上人群活动性肺结核的患病率为459/10万,其中涂阳肺结核患病率为66/10万,耐多药率高达6.8%[7]。耐多药结核及广泛耐多药结核的增多,使噬菌体疗法重新进入人们的视线。本研究中噬菌体Leo噬菌斑清晰透明,呈裂解性噬菌体的特征。噬菌体疗法是基于烈性噬菌体侵入宿主菌后可引起宿主细胞裂解这一特性建立的。因此,噬菌体Leo满足噬菌体疗法的基本要求。

表2 Leo体外裂解结核分支杆菌不同时间点菌量
# 实验组与对照组差异有统计学意义(P<0.05)
Note: # Experimental group was statistically different from control group (P<0.05).
噬菌体Leo基因组能被限制性内切酶HindⅢ、BglⅠ切开,表明其为双链DNA。目前发现的分枝杆菌噬菌体均为含双链DNA的有尾噬菌体[6]。大部分(71株)属长尾噬菌体科,尾长,可弯曲但不可收缩;少数(9株)属肌尾噬菌体科,具有可收缩的尾部[6]。本研究经电镜观察发现,噬菌体Leo尾部可弯曲不可收缩,尾长约211 nm,表明其属长尾噬菌体科。研究表明,具有较长卷尺蛋白(>1 100 aa)的噬菌体,含有motif3基序,能够裂解休眠结核分支杆菌[8-9]。而卷尺蛋白氨基酸序列长度与噬菌体尾长是成正相关的[10-11]。一般来说,卷尺蛋白每增加一个氨基酸,噬菌体尾部长度增加0.15 nm[11]。根据噬菌体Leo尾长211 nm,推测其卷尺蛋白大于1 100 aa,含有motif3基序,能够裂解休眠结核分枝杆菌。而D29尾部较短约129 nm[12],卷尺蛋白长837 aa,不含motif3基序,不能裂解休眠结核分枝杆菌[9]。休眠结核分枝杆菌对Rif、INH这些一线抗结核药耐药,是结核病病程长、易复发、迁延不愈的原因。噬菌体Leo对休眠结核分支杆菌的潜在裂解力为潜伏结核病治疗提供了新思路。
噬菌体一步生长实验的前提是保证1个噬菌体吸附1个宿主菌,所以本实验选择的感染复数是0.1。通过一步生长曲线得知,噬菌体Leo的潜伏期为150 min,较其他种类噬菌体的潜伏期长。如铜绿假单胞菌φKMV的潜伏期为12~13 min[13],乳酸菌噬菌体φps05的潜伏期为34 min[14]。噬菌体一步生长周期与宿主菌、环境条件等密切相关。分支杆菌生长速度缓慢,耻垢分支杆菌虽是快生长分支杆菌,但较铜绿假单胞菌及乳酸菌生长速度仍缓慢,可能是导致噬菌体Leo潜伏期长的原因。噬菌体侵染同一宿主菌时,若吸附快、潜伏期短,则溶菌周期短,因此认为潜伏期短的噬菌体更优。前期研究测得10株分支杆菌噬菌体潜伏期为120~210 min不等,而噬菌体Leo的潜伏期为120 min,在分支杆菌噬菌体中是较短的,具有较好的应用前景。
噬菌体疗法需要扩增大量的噬菌体,噬菌体Leo最佳感染复数为0.000 01,此时子代噬菌体产量可达1.8×1010PFU/mL,可以为噬菌体疗法提供大量的噬菌体。且Leo的最低感染复数为0.000 1,表明噬菌体Leo对耻垢分支杆菌极度易感。[15]噬菌体在制备过程中,需注意实验室的生物安全问题。噬菌体Leo对温度、酒精均敏感,70 ℃加热10 min 或 75%酒精处理10 min即可将噬菌体Leo全部杀死,因此可以利用高压灭菌的方式消毒废弃物,用75%酒精作实验室日常消毒。
结核分支杆菌是胞内寄生菌,当其由呼吸道进入人体后,会迅速被血液中的巨噬细胞吞噬。通常认为杀灭巨噬细胞内的结核分枝杆菌,是抗痨治疗成功的关键。人体血液中pH环境为7.35~7.45,巨噬细胞中pH环境为5.0。噬菌体Leo在pH 7.4和pH 5.0 环境中均能侵入宿主菌形成噬菌斑,初步推测它能裂解血液和巨噬细胞内的结核分支杆菌。而噬菌体TM4 在pH 5.0时不能裂解宿主菌,需要以耻垢分支杆菌为载体来杀灭巨噬细胞内结核分支杆菌[16],因此,能在pH 5.0环境中裂解宿主菌是噬菌体Leo的一大优势。一般来说,大部分分支杆菌噬菌体都能裂解快生长分支杆菌,如耻垢分支杆菌,仅有少数分支杆菌噬菌体(如D29、TM4)能裂解慢生长分支杆菌,如结核分支杆菌。因此,本研究通过噬菌体对结核分支杆菌的体外杀菌实验,探讨噬菌体Leo对结核分支杆菌是否具有直接杀菌作用。结果发现,作用72 h后Leo对结核分支杆菌有明显杀菌效应。
噬菌体Leo具有潜伏期短、对宿主菌易感、能直接杀灭结核分支杆菌以及在巨噬细胞内能保持裂解力等特点,可以用于噬菌体疗法,作为“鸡尾酒制剂”的候选噬菌体。
[1]Peng L, Luo YA, Chen BW, et al. Therapeutic effect of bacteriophage D29 in the treatment for guinea pigs infected with sensitive strain ofMycobacteriumtuberculosis[J]. Chin J Zoonoses, 2009, 25(8): 733-736. (in Chinese) 彭丽,罗永艾,陈保文,等.噬菌体D29对感染敏感株结核分枝杆菌豚鼠的疗效[J].中国人兽共患病学报,2009, 25(8): 733-736.
[2]Peng L, Chen BW, Luo YA, et al. Utility of bacteriophage D29 in treatment of guinea pigs with resistant tuberculosis[J]. J Fourth Mil Med Univ, 2009, 30(17): 1576-1579. (in Chinese) 彭丽,陈保文,罗永艾,等.噬菌体D29对耐药结核病豚鼠的治疗作用[J].第四军医大学学报,2009, 30(17): 1576-1579.
[3]Goodridge LD. Designing phage therapeutics[J]. Curr Pharm Biotechnol, 2010, 11(1): 15-27. DOI:10.2174/138920110790725348
[4]Li M, Shen XD, Zhou YB, et al. Study on biological characteristics ofPseudomonasaeruginosaphage PaP1[J]. J Third Mil Med Univ, 2005, 27(9): 860-863. (in Chinese) 李明,申晓冬,周莹冰,等.铜绿假单胞菌噬菌体PaP1生物学特性的研究[J].第三军医大学学报, 2005, 27(9): 860-863.
[5]Zhang J, Luo YA, Isolation and biological characteristics of phages of carbapenem-resistantAcinetobacterbaumannii[J]. J Shanghai Jiaotong Univ Med Sci, 2012, 5(32): 589-593. (in Chinese) 张劼,罗永艾.耐碳青霉烯类鲍曼不动杆菌噬菌体的分离鉴定及其生物学特性[J]. 上海交通大学学报:医学版,2012,5(32):589-593.
[6]Hatfull GF. The secret life of mycobacteriophages[J]. Adv Virus Res, 2012. DOI: 10.1016/B978-0-12-394621-8.00015-7
[7]Technical Guidance Group of Fifth National TB Epidemiological Survey: The Office of the Fifth National TB Epidemiological Survey, The fifth national tuberculosis epidemiological survey in 2010[J]. Chin J Anititubere, 2012, 34(8): 485-508. (in Chinese) 全国第五次结核病流行病学抽样调查技术指导组,全国第五次结核病流行病学抽样调查办公室,2010年全国第五次结核病流行病学抽样调查报告[J].中国防痨杂志,2012,34(8):485-508.
[8]Piuri M, Hatfull GF. A peptidoglycan hydrolase motif within the mycobacteriophage TM4 tape measure protein promotes efficient infection of stationary phase cells[J]. Mol Microbiol, 2006, 62(6): 1569-1585.DOI: 10.1111/j.1365-2958.2006.05473.x
[9]Dusthackeer A, Hassan VN, Kumar V. Tape measure protein having MT3 motif facilitates phage entry into stationary phase cells ofMycobacteriumtuberculosis[J]. Comput Biol Chem, 2008, 32(5): 367-369. DOI: 10.1016/j.compbiolchem.2008.03.016
[10]Pedulla ML, Ford ME, Houtz JM, et al. Origins of highly mosaic mycobacteriophage genomes[J]. Cell, 2003, 113: 171-182. DOI: 10.1016/S0092-8674(03)00233-2
[11]Pham TT, Jacobs-Sera D, Pedulla ML, et al. Comparative genomic analysis of mycobacteriophage Tweety: evolutionary insights and construction of compatible site-specific integration vectors for mycobacteria[J]. Microbiology, 2007, 153: 2711-2723. DOI: 10.1099/mic0.2007/008904.0
[12]Liu P, Wu TT, Luo YA, et al.Isolation and biological characteristics of mycobacteriophage Chy2[J]. J Third Mil Med Univ, 2012, 34(12): 1176-1180. (in Chinese) 刘平,郭述良,罗永艾,等.分枝杆菌噬菌体 Chy2 的分离及生物学特性[J]. 第三军医大学学报,2012,34(12):1176-1180.
[13]Lavigne R, Burkal'tseva MV, Robben J, et al. The genome of bacteriophage φKMV, a T7-like virus infectingPseudomonasaeruginosa[J]. Virology, 2003, 312(1): 49-59. DOI: 10.1016/S0042-6822(03)00123-5
[14]Yoon SS, Barrangou-poueys R, Breidt F Jr, et al. Detection and characterization of a lyticPediococcusbacteriophagefrom the fermenting cucumber brine[J]. J Microbiol Biotechnol, 2007, 17(2): 262-270.
[15]Niu DY. Use of bacteriophage to controlEsherichiacoliO157:H7 in cattle and their environment[D]. Dalian: Dalian University of Technology, 2009. (in Chinese) 牛冬燕.应用噬菌体控制牛及其饲养环境中大肠杆菌 O157:H7 的研究 [D].大连理工大学,2009.
[16]Broxmeyer L, Sosnowska D, Miltner E, et al. Killing ofMycobacteriumaviumandMycobacteriumtuberculosisby a mycobacteriophage delivered by a nonvirulent mycobacterium: a model for phage therapy of intracellular bacterial pathogens[J]. J Infect Dis, 2002, 186(8): 1155-1160. DOI: 10.1086/343812
Biological characteristics of mycobacteriophage Leo and its bactericidal effect onMycobacteriumtuberculosis
JIANG Li-sha1,WU Ting-ting2,LIU Ping3,ZHANG Li1,YAO Yi-yong1,GUO Shu-liang1
(1.DepartmentofRespiratoryandCriticalCareMedicine,theFirstAffiliatedHospitalofChongqingMedicalUniversity,Chongqing400016,China; 2.DepartmentofRespiratoryMedicine,theThirdPeople'sHospitalofChengdu,Chengdu610031,China; 3.DepartmentofRespiratoryMedicine,People'sHospitalofChangshouDistrict,Chongqing401220,China)
To investigate the biological characteristics of mycobacteriophage Leo and its bactericidal effect onMycobacteriumtuberculosisfor cocktail therapy, we observed mycobacteriophage plaques after amplifying phage by double-layer agar plate method. The morphological characteristics were observed by electron microscopy. Mycobacteriophage Leo DNA was extracted and then digested by restriction enzyme to identify the nucleic acid type. Leo was amplified in different multiplicity of infection (MOI) to find the optimal MOI and the minimum MOI. One step growth experiment was carried out to find the latent period and burst size of Leo. The frequency ofMycobacteriumsmegmatismutation treated with mycobacteriophage Leo was inspected by the endpoint titration test. The effect of temperature and alcohol on Leo survival was surveyed. The ability of Leo to crack host bacteria at different pH values was examined. The effect of Leo onMycobacteriumtuberculosiswas determined by bactericidal assay. Results showed that the Leo plaque was round and transparent with a diameter of 1.5 nm. Leo has an isometric head (70±3.0 nm in diameter) and a flexible tail (211±31.7 nm in length). Its genome could be digested by restriction enzyme ofHind Ⅲ andBglⅠ. The optimal MOI and the minimum MOI of Leo were 0.000 01 and 0.000 1, respectively. The mutation frequency was 10-7. The latent period was 150 min, and the burst size was 74. Leo could not only crack host bacteria in solid medium at pH 7.4 but also at pH 5.0. After 72 hours, the amount ofMycobacteriumtuberculosisin Leo group was less than that in control group (P<0.05). In conclusion, Leo has a bactericidal effect onMycobacteriumtuberculosisand could be a candidate of phage cocktails. Keywords: mycobacteriophage Leo; the biological characteristics;MycobacteriumtuberculosisSupported by the National Major Science and Technology Program in “Twelfth Five-year” Plan (No. 2012ZX10003009),National Key Clinical Specialty Foundation(No.2012-649)Corresponding author: Guo Shu-liang, Email: guosl999@sina.com
10.3969/cjz.j.issn.1002-2694.2015.03.001
国家“十二五”重大专项课题(2012ZX10003009),国家临床重点专科专项经费资助项目(No. 2012-649)资助, 江莉莎与邬亭亭对本文同等贡献
郭述良,Email:guosl999@sina.com
1.重庆医科大学附属第一医院呼吸与危重症医学科,重庆 400016; 2.成都市第三人民医院呼吸内科,成都 610031; 3.重庆市长寿区人民医院呼吸内科,重庆 401220
R378.91
A
1002-2694(2015)03-0193-06
2014-07-30;
2014-12-11
