交叉引物恒温扩增法检测甲型H1N1流感病毒及临床应用
2015-06-24白志军李魁彪钟华燕陈艺韵鲁恩洁
白志军,胡 林,李魁彪,钟华燕,陈艺韵,鲁恩洁,狄 飚
交叉引物恒温扩增法检测甲型H1N1流感病毒及临床应用
白志军1,胡 林2,李魁彪1,钟华燕2,陈艺韵1,鲁恩洁1,狄 飚1
目的 建立交叉引物恒温扩增(Cross Priming Amplification, CPA)技术对甲型H1N1流感病毒进行检测的方法,并对该方法通过临床标本进行评价。方法 根据甲型H1N1流感病毒的保守序列设计特异性引物,并在同一温度下实现RNA的逆转录和DNA扩增,该扩增产物可通过全封闭式核酸检测装置进行检测。14份健康人咽拭子标本、7个其他呼吸道病毒和6个虫媒病毒株被用来检测CPA反应的特异性;已知病毒滴度的甲型H1N1毒株进行对照梯度稀释,以测试CPA的敏感性;102份甲型H1N1临床咽拭子标本为检测对象,评估其临床的检测的可行性。结果 CPA反应未出现对健康样本以及其他病毒产生交叉反应;对已知滴度的病毒进行梯度稀释检测,证明CPA的敏感性为10拷贝/μL 。对甲型H1N1流感临床病例发病1~3 d临床标本新建检测方法的检出率为100%,4~6 d临床标本检出率为79.31%,≥7 d临床标本检出率为9.09%。讨论 CPA具有较高的敏感性、特异性,对设备要求低,适合基层医疗单位对甲型H1N1流感发病早期诊断使用。
甲型H1N1流感病毒;交叉引物恒温扩增技术;临床应用
2009年3月,甲型H1N1流感始于北美,迅速在全世界蔓延,中国大陆已经普遍流行近年各地均有报告甲型H1N1 流感病例[1-2]。对于H1N1疫情防控策略的制定,实验室检测是比较有效的办法。目前,实验室检测最快捷、有效的方法是荧光定量PCR,在但荧光定量PCR法需要价格昂贵的荧光定量PCR仪,检测成本较高,且不易在基层医院和防疫部门推广,也不便于现场病原检测的使用。因此,建立适合疫情现场检测所需的,且不需特殊仪器的,费用低廉的甲型H1N1流感病毒的核酸检测技术就显得尤为重要。本研究结合了交叉引物恒温扩增技术(Cross Priming Amplification, CPA)、核酸检测试纸条技术和全封闭式核酸检测装置,建立了快速检测甲型H1N1流感病毒特异性核酸的方法。使得RNA的逆转录以及DNA扩增能在同一个温度实现,而扩增后的核酸产物可以用一个含有核酸试纸条的全封闭式核酸检测装置进行检测。
1 材料与方法
1.1 标本来源及其诊断标准 2009年8月至2010年9月广州市疾病预防控制中心收集甲型H1N1流感病毒疑似感染患者咽拭子标本102份和健康人咽拭子标本14份,以及实验室保存的甲型流感病毒H3亚型、副流感病毒、禽流感H7N9亚型病毒、乙型流感病毒BV、BY亚型病毒和腺病毒等其他7株呼吸道病毒。广州军区疾病预防控制中心保存并提供西尼罗病毒、流行性乙型脑炎(乙脑)病毒、黄热病毒;西门利克病毒、基孔肯雅病毒和辛德毕斯病毒等6株虫媒病毒;所有咽拭子标本按照《WS285-2008流行性感冒诊断标准》进行常规处理后,均接种MDCK细胞进行病毒分离培养,并用中国疾病预防控制中心国家流感中心提供的鉴定血清进行血凝抑制试验,鉴定其型别与亚型。经鉴定甲型H1N1流感疑似标本均为阳性,健康人标本均为阴性。
1.2 主要试剂和仪器 Bst DNA聚合酶购自NEB公司、反转录酶购自杭州博日科技有限公司、病毒核酸提取试剂盒购自Qiagen公司,含有核酸试纸条的全封闭式核酸检测装置由杭州尤思达生物技术有限公司提供[3]。
1.3 CPA检测
1.3.1 病毒核酸提取 使用病毒核酸提取试剂盒,按照说明书程序从140 μL标本和病毒液中提取50 μL RNA并于-80 ℃保存。
1.3.2 CPA引物的设计及反应原理 CPA扩增主要包含以下几个步骤,如图1所示:
①交叉正向引物CPF中的PFs与模板DNA中PFa互补,启动DNA合成,使得PRa被引入到所扩增的产物中;
②外围引物DP1s与PFa前端DP1a序列互补,通过链置换型DNA聚合酶向前延伸,一边置换CPF合成的能与CPR和DP2a结合的单链产物(结构3),一边与模板DNA形成双链产物(结构2);
③在结构3中,DP2a通过链置换型DNA聚合酶向前延伸,置换出由CPR所延伸的单链产物(结构5),同时合成与步骤2中由CPF延伸所产生单链DNA形成双链产物(结构4);
④单链结构5中的3′端的PFa和PRs可分别与CPF中的PFs和CPR中的PRa互补结合, 可在链置换型DNA聚合酶的作用下延伸和置换出相应的单链产物(结构8);
⑤扩增引物CPF和CPR的不断杂交和延伸;,DNA拷贝数不断的增加,从而达到基因扩增的效果。
1.3.3 CPA反应体系 针对甲型H1N1流感病毒的HA基因保守区设计特异性引物,其中两条特异性检测探针分别带有生物素标记和荧光素标记,引物见表1。CPA反应体积为20 μL,其中包括正向外围引物0.3 μmol/L,反向外围引物0.1 μmol/L,正向交叉引物2.0 μmol/L,反向交叉引物0.6 μmol/L,检测探针各0.6 μmol/L;0.4 mmol/L dNTP;12U Bst酶 DNA聚合酶,2U反转录酶和4 μL RNA核酸模板。恒温反应温度为60 ℃,90 min。
1.4 CPA结果判定 CPA反应结束后,按照含核酸试纸条的全封闭式核酸检测装置的操作说明书进行操作[4-5]。室温静止15~30 min,当检测装置中的核酸免疫试纸条在检测区和质控区显示两条红色条带,结果为阳性;检测区没有红色条带而质控区显示红色条带,结果为阴性。
2 结 果
2.1 CPA的敏感性 CPA 反应分别对病毒滴度为2.25 × 107PFU /mL的H1N1病毒分离培养液进行10倍梯度稀释检测,每个稀释度重复3次试验,结果显示检测敏感度为10拷贝/μL。
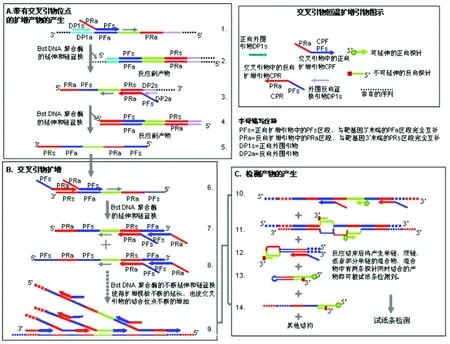
图1 交叉引物设计及反应原理
2.2 CPA的特异性 CPA反应对甲型流感病毒H3亚型、副流感病毒、禽流感H7N9亚型病毒、乙型流感病毒BV、BY亚型病毒、腺病毒、西尼罗病毒、流行性乙型脑炎(乙脑)病毒、黄热病毒、西门利克病毒、基孔肯雅病毒和辛德毕斯病毒等13种病毒的检验没有交叉反应,结果为阴性。14份健康人标本检测结果为阴性。
2.3 CPA对临床标本的诊断 将以上CPA法检测完成的102份阳性H1N1患者临床标本,均通过MDCK细胞进行病毒分离成功。细胞分离阳性率为100%,以细胞分离法为标准,CPA法的检出率为84.3%(86/102),按照发病后不同采集时间进行数据分析。可见发病1~3 d CPA法检出率为100%(62/62);4~6 dCPA法检出率为79.31%(23/29),漏检率为20.69%(6/29);≥7 d CPA法检出率为9.09%(1/11),漏检率为90.9%(10/11),数据经χ2检验有统计学意义(P<0.01)。见表2。
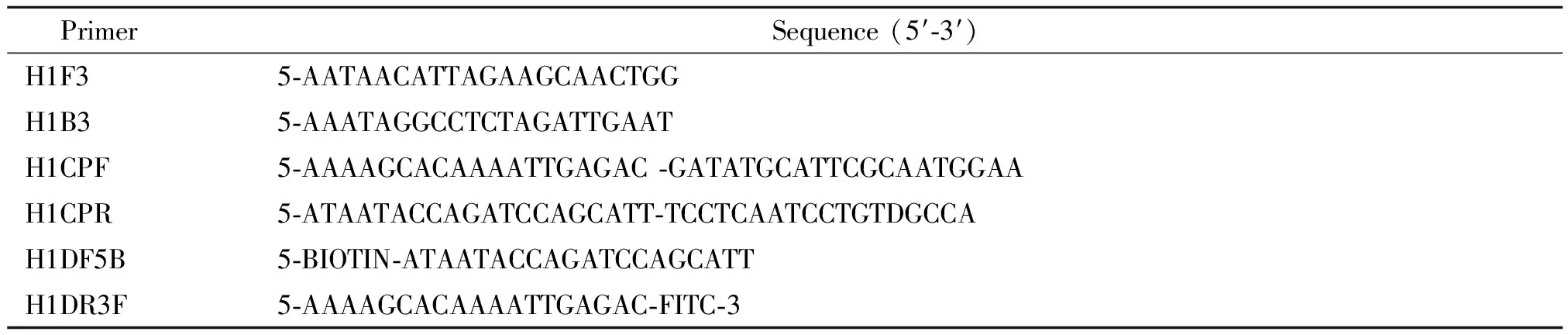
表1 检测甲型H1N1流感病毒CPA系统的引物序列
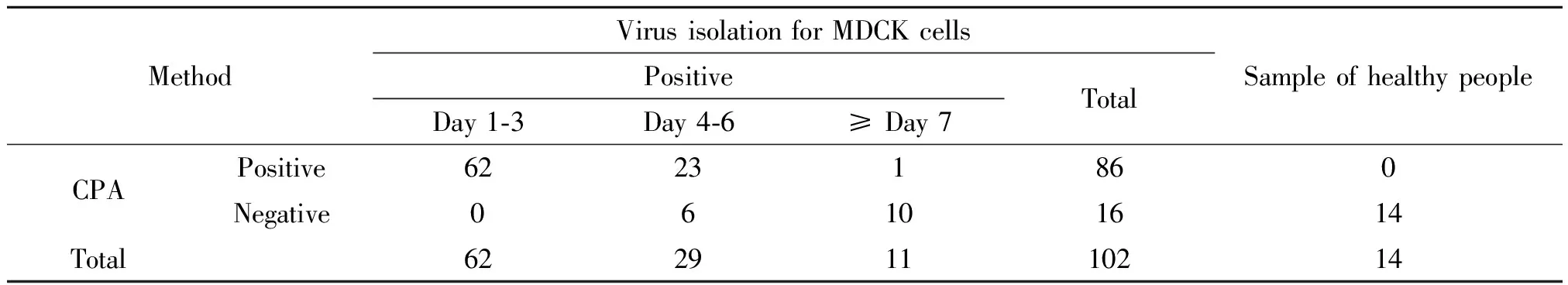
表2 CPA方法和MDCK细胞分离病毒方法检测结果
3 讨 论
甲型H1N1流感自2009年到现在流行期间,国内外陆续出现了许多针对新甲型H1N1流感不同的快速检测方法,主要是荧光定量PCR法和胶体金免疫层析法[6-11]。由于荧光定量PCR法需要价格昂贵的荧光定量PCR仪,检测成本较高,不易在基层医院和防疫部门推广,也不便于现场病原检测的使用。胶体金免疫层析法检测的敏感性仍有一定的局限性。
CPA是一种新型的核酸恒温扩增技术,能对基因在60℃的条件下同时实现RNA的逆转录以及DNA的扩增,而通过恒温扩增得到的产物可以利用含核酸试纸条的全封闭式核酸检测装置进行检测并降低扩增物的交叉污染[12]。目前,CPA已经成功的运用到细菌和病毒的核酸检测当中,如结核分支杆菌(Mycobacteriumtuberculosis)、阪崎肠杆菌(Enterobactersakazakii)和新布尼亚病毒(novelbunyavirus),并且已经被证明具有高度的特异性和敏感性[13-15]。在本研究中,我们通过对CPA恒温扩增技术和核酸试纸条检测技术的结合建立了一整套检测甲型H1N1流感病毒的技术。
通过对已知浓度的H1N1病毒株进行10倍浓度梯度稀释,CPA的检测下限为10拷贝/μL。CPA对7株呼吸道症候群病毒和6株虫媒病毒的检测结果,证明了其具有较高的特异性。虽然本研究以细胞分离法为标准,CPA法的检出率仅为84.3%(86/102),但如果我们对不同发病时段采集的临床标本检测数据分析显示,CPA方法对发病后1~3 d的咽拭子标本阳性检出率最高为100%;随后4~6 d和7 d以后的的标本检出率逐渐下降。咽拭子标本中抗原检出情况完全符合机体对病原免疫应答的规律,在发病1~3 d因为机体免疫系统还未大量产生可中和病毒的抗体,故CPA检测的阳性检出率较高;发病4 d后,机体产生的特异性IgM和IgG逐渐发生中和作用,降低了血清中的病毒载量,故CPA法阳性检出率逐渐下降。在本项研究发病后1~3 d标本检测数据中,CPA方法和病毒细胞分离2种检测方法检测结果之间一致性较好,可见CPA适合于甲型H1N1流感临床发病早期的诊断。
CPA在实际操作还是在仪器要求方面,都比传统的RT-PCR或者real-time RT-PCR技术更为简单。同时利用全封闭式核酸检测装置,不仅避免了靶核酸扩增物释放到空气中形成污染,同时还可通过显色判读结果,降低了对操作人员的要求。利用CPA检测甲型H1N1流感具有高较好的特异性和灵敏性,适用疾病防控的第一防线基层哨点部门或现场工作中,因此CPA 技术更具备广泛的应用前景。此次我们对CPA技术在甲型H1N1流感检测中的应用和评估,也为今后该技术的推广利用积累了实验室经验,将会在疾病的早期诊断及预防控制方面发挥重要作用。
[1]World health Organization. Pandemic (H1N1) 2009-update 31. 17 May 2009[EB/OL].(2009-05-17)[2014-06-24].http: //www.who. int/csr/don/2009_05_17/en/index.html
[2]World Health Organization. Pandemic (H1N1) 2009-update 64. 04 September 2009[EB/OL].(2009-09-04)[2014-06-24].http: //www. who.int/csr/don/2009_09_04/en/index.html
[3]Kong HM, Ranalli T, Lemieux B, et al. New isothermal molecular diagnostics platforms[J]. IVD Technol, 2007, 13: 35-43. DOI: 10.1016/j.virusres.2013.12.007
[4]Chow WHA, McCloskey C, Tong Y, et al. Application of isothermal helicase-dependent amplification with a disposable detection device in a simple sensitive stool test for toxigenicClostridiumdifficile[J]. J Mol Diagnost, 2008, 10(5): 452-458. DOI: 10.2353/jmoldx.2008.080008
[5]Goldmeyer J, Li HJ, McCormac M, et al. Identification ofStaphylococcusaureusand determination of methicillin resistance directly from positive blood cultures by isothermal amplification and a disposable detection device[J]. J Clin Microbiol, 2008, 46(4): 1534-1536. DOI: 10.1128/JCM.02234-07
[6]Drexler JF, Helmer A, Kirberg H, et al. Poor clinical sensitivity of rapid antigen test for influenza A pandemic (H1N1) 2009 virus[J]. Emerg Infect Dis, 2009, 15(10): 1662-1664. DOI:10.3201/eid1510.091186[7]Faix DJ, Sherman SS, Waterman SH. Rapid-test sensitivity for novel swine-origin influenza A (H1N1) virus in humans[J]. N Engl J Med, 2009, 361(7): 728-729. DOI: 10.1056/NEJMc0904264
[8]Tian D, He J, Liu Y, et al. Sensitivity analysis on colloidal gold immunochromatography assay kit in rapid antigen test of influenza A pandemic (H1N1) 2009 virus[J]. Lab Med, 2013, 28(2): 154-158. DOI: 10.3969/j.issn.1673-8640.2013.02.018 (in Chinese) 田棣,何静,刘祎,等.胶体金免疫层析试剂盒对甲型H1N1流感病毒( 2009)抗原快速检测的敏感性分析[J].检验医学, 2013 ,28(2):154-158. DOI: 10. 3969 /j. issn. 1673-8640. 2013. 02. 018
[9]Yin H, Yang HL, Chen Y, et al. Establishment of one-step TaqMan real time RT-PCR for Pandemic/2009 influenza viruses in swine[J]. Chin J Prev Vet Med, 2013, 35(1): 36-39. DOI: 10.3969/j.issn.1008-0589.2013.01.09 (in Chinese) 尹航,杨焕良,陈艳,等.甲型H1N1流感病毒实时荧光定量PCR检测方法的建立[J].中国预防兽医学报, 2013, 35(1) :36-39 DOI: 10.3969/j.issn.1008-0589.2013.01.09
[10]Pierro A, Gaibani P, Rossini G, et al. Clinical application of a molecular method based on real time RT-PCR for detection of influenza A(H1N1)v virus[J]. New Microbiol, 2013, 36(4): 405-408.
[11]Chen Y, Liu T, Cai L, et al. A one-step RT-PCR array for detection and differentiation of zoonotic influenza viruses H5N1, H9N2, and H1N1[J]. J Clin Lab Anal, 2013, 27(6): 450-460. DOI: 10.1002/jcla.21627
[12] Xu G, Hu L, Zhong H, et al. Cross priming amplification: mechanism and optimization for isothermal DNA amplification[J]. Sci Rep, 2012, 2: 246. DOI: 10.1038/srep00246
[13]Fang R, Li X, Hu L, et al. Cross-priming amplification for rapid detection ofMycobacteriumtuberculosisin sputum specimens[J]. J Clin Microbiol, 2009, 47(3): 845-847. DOI: 10.1128/JCM.01528-08
[14]Yulong Z, Xia Z, Hongwei Z, et al. Rapid and sensitive detection ofEnterobactersakazakiiby cross-priming amplification combined with immune-blotting analysis[J]. Mol Cell Probes, 2010, 24: 396-400. DOI: 10.1016/j.mcp.2010.09.001
[15]Cui L, Ge Y, Qi X, et al. Detection of severe fever with thrombocytopenia syndrome virus by reverse transcription-cross-priming amplification coupled with vertical flow visualization[J]. J Clin Micro, 2012, 50: 3881-3885. DOI: 10.1128/JCM.01931-12
Establishment of cross priming amplification for influenza A virus (H1N1) and its clinical application
BAI Zhi-jun1,HU Lin2,LI Kui-biao1,ZHONG Hua-yan2,CHEN Yi-yun1,LU En-jie1,DI Biao1
(1.GuangzhouCenterforDiseaseControlandPrevention,Guangzhou510440,China; 2.UstarBiotechnologies(Hangzhou)Co.,Ltd.,Hangzhou310012,China)
In this study, we established Cross Priming Amplification (CPA) technology for detection of influenza A virus (H1N1) approach, and evaluated the method through clinical specimens. A set of specific primers were designed for CPA according to the conservative gene sequences, designed and realized in the same temperature reverse transcription of RNA and DNA amplification. The amplification products can be totally enclosed nucleic acid detection device for testing. Fourteen healthy pharyngeal swab specimens, seven other respiratory viruses, and six arboviruses strains were used as the controls. We used a method that application of gradient dilution to the H1N1 virus strain as the control to test the sensitivity of the CPA. We also used 102 clinical pharyngeal swab specimens of H1N1 patients for detection object to evaluate the feasibility of CPA clinical detection. Results showed that the CPA reaction did not appear cross reaction on health cases samples and other viruses. The sensitivity of the CPA was approximately 10 copies/uL in the established method that exactly titer H1N1 virus strain gradient dilution test. As to the positive results among the clinical pharyngeal swab samples collected from patients at different stages after onset, the CPA had the highest positive detection rate during the first three days after onset (100%). While the detection rate from day 4 to day 6 after onset was 79.31%. After 7 days, the detection rate was 9.09%. The established CPA assay was a highly sensitive, specific and reproducible approach for rapid detection of H1N1 virus, which is conducive to the early diagnosis of influenza A virus (H1N1) for basic medical units.
influenza A virus(H1N1); cross priming amplification (CPA); clinical application
Di Biao, Email: biao65di@yahoo.com
10.3969/cjz.j.issn.1002-2694.2015.03.004
国家科技重大专项(2012ZX10004-213-005),广州市医药卫生科技项目(20131A011115,201102A212006),广州市科技和信息化局项目(2012Y2-00020),广东省科学技术厅项目(2012B040304002),广州市医学重点学科建设项目(2013-2015-07)联合资助
狄飚,Email: biao65di@yahoo.com
1.广州市疾病预防控制中心,广州 510440 2.杭州优思达生物技术有限公司,杭州 310012
R373.1
A
1002-2694(2015)03-0208-04
2014-06-24;
2014-11-30
Supports by grants from the National Science and Technology Major Project of China (No. 2012ZX1004-213-005), the Science and Technology Program of Guangzhou Health Department (Nos. 20131A011115, and 201102A212006), the Guangzhou Science and Technology Department Program (No. 20121Y2-00020), the Science and Technology Program of Guangdong Province (No. 2012B040304002), and the Project for Key Medicine Discipline Construction of Guangzhou Municipality (No. 2013-2015-07)
