嗜水气单胞菌鞭毛蛋白基因flaB的克隆、表达及其免疫原性分析
2015-06-24沈雪飞翟新新温振才贾生美
沈雪飞,翟新新,温振才,孙 真,贾生美,卢 强
嗜水气单胞菌鞭毛蛋白基因flaB的克隆、表达及其免疫原性分析
沈雪飞,翟新新,温振才,孙 真,贾生美,卢 强
目的 克隆、表达及纯化嗜水气单胞菌鞭毛FlaB蛋白,比较了它与天然鞭毛蛋白的抗原性,为以后鱼类弧菌病的防治及其疫苗的制备奠定了基础。方法 利用PCR扩增出嗜水气单胞菌鞭毛蛋白基因flaB,经确定后将该基因克隆到原核表达载体pET-30a中,在大肠杆菌BL21(DE3)中获得了表达,并用电洗脱法对表达的蛋白进行纯化,用纯化的重组蛋白免疫家兔制备抗血清,并进行Western-blot分析。结果 嗜水气单胞菌鞭毛蛋白flaB基因全长912 bp,编码303个氨基酸,预测分子量为32 kDa,Western-blot结果表明兔抗FlaB血清不仅能与重组鞭毛蛋白发生反应,而且能与天然鞭毛蛋白发生反应。结论 鞭毛蛋白FlaB可能是嗜水气单胞菌的重要保护抗原之一,为下一步疫苗的制备奠定了基础。
嗜水气单胞菌;鞭毛;蛋白
嗜水气单胞菌(Aeromonashydrophila)属于弧菌科、气单胞菌属,是水生环境中普遍存在的一种细菌,能够感染多种水生和陆生动物,是一种重要的人-兽-鱼共患的细菌病原菌[1]。嗜水气单胞菌可以使淡水鱼类发生疖病和败血症,给水产养殖业带来了严重危害[2]。人感染致病性嗜水气单胞菌后会发生腹泻、食物中毒、继发感染的临床症状,严重威胁到人类公共卫生安全[3-5]。
与其他生物一样,嗜水气单胞菌的致病性与其产生多种毒力因子有着直接关系,毒素是其致病的物质基础。细菌粘附于宿主细胞表面是对机体感染致病的先决条件,对细菌侵入宿主并有效发挥毒素等作用具有重要的意义[6]。鞭毛就是一种重要的粘附因子,它在黏附、生物膜形成以及病原菌定植过程中起着重要作用[7-8]。
鞭毛的形成过程是一个复杂的一连串的事件,需要协调表达超过50个基因编码的结构亚单位、调节蛋白和化学传感器。根据在组装蛋白时间顺序可以把这些基因分为3类:早期、中期和晚期基因[9-10]。早期基因编码的调节蛋白,控制整个调节子的表达;中期基因编码钩状体、基础小体、传输结构和诱导晚期表达的调节蛋白;晚期基因表达包括丝状体、鞭毛马达和趋化蛋白因子。
鞭毛由基体、钩状体和丝状体三部分组成[11]。(1)基体:基体由MS-C环、转动杆和LP环组成。位于鞭毛根部,嵌在细胞壁和细胞膜中,其功能是一个可逆旋转马达,给鞭毛的运动提供动力。(2)钩状体:鞭毛伸出细胞壁后的部分称为钩状体,高度弯曲的管状结构,可以改变鞭毛运动方向。(3)丝状体:丝状体呈丝状连接在钩状体后面,由FlaA和FlaB两个鞭毛蛋白单体紧密缠绕而成。其中鞭毛丝状体蛋白基因位于Region2区上,主要有FlaA和FlaB两个蛋白单体组成。本研究克隆和表达了嗜水气单胞菌鞭毛FlaB蛋白,用纯化的鞭毛蛋白免疫家兔制备了抗血清,Western-blot对其免疫原性进行了分析,为嗜水气单胞菌疫病的防治及其疫苗的研发提供了理论依据。
1 材料与方法
1.1 实验动物 新西兰大白兔,购自长春生物制品所。
1.2 菌株和质粒 嗜水气单胞菌AHCS-02和嗜水气单胞菌鞭毛蛋白由本实验室保存,嗜水气单胞菌天然鞭毛蛋白由本实验室纯化保存,E.coliDH5α、BL21(DE3)、表达载体pET-30a均有本实验室保存,克隆载体pUC18购自TaKaRa公司。
1.3 主要试剂 T4 连接酶,Taq plus聚合酶,限制性内切酶EcoR I、XhoI,DNA Marker DL 5 000 bp/2 000 bp 均购自TaKaRa公司、细菌基因组提取试剂盒 购自北京康为世纪生物科技公司、DNA凝胶回收试剂盒,质粒提取试剂盒 均购自杭州爱思进生物公司、蛋白Marker购自北京全式金生物公司。
1.2 方法
1.2.1 细菌基因组DNA的提取 用康为世纪公司细菌基因组DNA提取试剂盒提取嗜水气单胞菌基因组DNA,操作步骤按照说明书进行。
1.2.2 目的基因flaB的扩增 根据GenBank中登录的嗜水气单胞菌AH-1鞭毛基因flaB的序列(DQ650656.1),利用Primer Premier 5.0设计一对引物上游引物:上游引物:5′-CGGAATTCATGGCCATGTACATCAAC-3′(下划线为EcoR I酶切位点),下游引物:5′-CGCTCGAGACCCAGCAGGGACAG-3′(下划线为XhoI酶切位点),以上引物由华大基因公司合成。扩增条件为:94 ℃预变性5 min,94 ℃变性45 s,51 ℃退火45 s,72 ℃延伸45 s。30个循环,72 ℃延伸10 min。用1%的琼脂糖凝胶电泳进行鉴定并回收目的条带。
1.2.3 构建原核表达载体 用EcoR I和XhoI双酶切PCR产物和表达载体pET-30a,将胶回收的PCR酶切产物和载体酶切产物进行连接,构建融合表达质粒pET30a-flaB,转入感受态大肠杆菌BL21(DE3)细胞中,涂于含有20 μg/mL的卡那霉素LB平板上,37 ℃过夜培养。挑取阳性克隆进行双酶切鉴定,并送至长春库美生物公司测序。
1.2.4 诱导表达条件的优化 取测序正确的阳性菌液50 μL接种到若干个5mLKan+(50 μg/mL)的LB液体培养基中,37 ℃震荡培养1~1.5 h至OD600值0.6~0.8时,取出一管作未诱导对照,然后进行表达条件的优化:实验组加入IPTG终浓度为(mmol/L)一次为0.2、0.4、0.6、0.8、1.0在37 ℃,160 r/min诱导6 h;同时空载体pET-30a(+)转化的E.coliBL21(ED3)作诱导和未诱导对照。
1.2.5 表达形式的鉴定 将表达菌以1∶100的比例加入Kan+(50 μg/mL)的LB液体培养基中,37 ℃震荡揺菌至OD值为0.6~0.8时,加入终浓度为0.6 mmol/L的IPTG诱导表达,6 h后收集菌液。4 ℃,5 000 r/min离心20 min,用PBS悬浮沉淀,置冰浴中,超声破碎使菌液变的清亮,离心分别收集上清和沉淀进行SDS-PAGE电泳。
1.2.6 重组蛋白的纯化及Western-blot鉴定 重组质粒pET30a-flaB转化E.coliBL21(ED3)菌后,经终浓度为0.6 mmol/L的IPTG诱导6 h后,超声裂解提取包涵体经SDS-PAGE电泳后,用KCI染色,切取目的条带后,利用电洗脱法将目的蛋白洗脱出来,后经透析、浓缩纯化出重组鞭毛蛋白,用抗His标签的二抗对目的蛋白进行Western鉴定。
1.2.7 抗体的制备 以纯化的重组鞭毛蛋白包为抗原,免疫家兔,具体免疫方案如下:初次免疫用500 μg的抗原和等体积的弗氏完全佐剂进行乳化,采取背部皮下多点免疫,12 d后耳静脉采血测效价;二免,用250 μg的抗原与等体积的弗氏不完全佐剂进行乳化,背部皮下多点免疫,12 d后耳静脉采血测效价;第4次免疫后的第7 d进行心脏采血,37 ℃静置1 h后,4 ℃静置过夜,10 000 g离心10 min,上清即为兔抗重组鞭毛蛋白的免疫血清,吸取上清分装于1.5 mL的离心管中,-20 ℃保存备用。
1.2.8 重组蛋白的免疫原性分析 将诱导后的重组鞭毛蛋白和天然鞭毛蛋白进行SDS-PAGE电泳后,将其上的蛋白转移到NC膜,5%脱脂奶粉4 ℃封闭过夜。加入抗血清(兔抗FlaB血清),室温孵育1~2h,用TBST洗3次(5 min/T),加入1∶10 000倍稀释的HRP标记的二抗(羊抗兔),室温孵育1 h;用TBST洗3次(5 min/T),蛋白检测。
2 结 果
2.1 目的基因电泳分析 PCR产物进行琼脂糖核酸电泳,发现有912 bp大小的特异性条带,与预期相符,见图1;重组表达载体pET-30a-flaB双酶切电泳,发现有912 bp大小的目的条带,见图1,说明目的基因成功的连接到表达载体上。

1:flaB基因PCR产物;
2.2flaB的诱导表达及表达条件的优化 pET30a-flaB质粒转入BL21(DE3)宿主菌后,用不同浓度的IPTG诱导后,进行全菌SDS-PAGE电泳分析,结果表明:IPTG诱导后的工程菌目的蛋白均有表达,在38 kDa处有一新的蛋白带与预期的分子量相符。而未诱导的阳性菌和未诱导的空载体转化的BL21(DE3)菌均没有相应的蛋白带,见图3。
2.3 表达形式的鉴定 诱导8 h后的培养基,菌体离心、超声破碎后,经SDS-PAGE电泳分析。结果表明:经0.6 mmol/L IPTG,37 ℃诱导表达8 h,重组蛋白绝大部分以包涵体形式存在,可溶性蛋白较少,见图4。
2.4 FlaB蛋白的纯化及鉴定 见图5。

1:pET-30a-flaB的双酶切产物

M:蛋白marker(14-100kDa);1:未诱导的pET-30a2:诱导的pET-30a;3:未诱导的30a-flaB4-8:不同IPTG浓度(0.2、0.4、0.6、0.8、1.0mmol/L)诱导的30a-flaB

M:蛋白marker(14-100 kDa);1:诱导上清 2:诱导包涵体沉淀
2.5 重组蛋白免疫原性分析 见图6。
3 讨 论
嗜水气单胞菌在自然环境中分布很广,尤其是在水环境中最多。嗜水气单胞菌疾病的频发不仅给我国淡水养殖业带来了重大经济损失,而且还严重威胁到人类公共卫生安全。目前,对该病的防治主要依靠化学药物和抗生素,尽管抗生素可以用于细菌性鱼病的治疗,但是重复使用抗生素可产生耐药性致病菌或抑制鱼的免疫系统[12]。此外,药物的残留危害到消费者的饮食健康,因而开发高效、安全的疫苗成为今后防治嗜水气单胞菌疾病的重要方向。Snieszko和Schaperclaus早期尝试用疫苗免疫防治鱼类细菌性疾病。在20世纪60年代, Klontz和Fryer通过口服免疫防治虹鳟鱼的“红嘴病”[13]。嗜水气单胞菌有极生单鞭毛,其主要成分是蛋白,在感染与免疫以及细菌分类鉴定等方面发挥重要的作用,特别是鞭毛蛋白的免疫原性在疫苗开发及疫病防控方面有重要的实际意义。
本研究扩曾出嗜水气单胞菌鞭毛flaB全长基因,并成功诱导表达出FlaB鞭毛蛋白,制备了兔抗FlaB多克隆抗体,初步探讨了重组鞭毛蛋白FlaB的免疫原性,为新型抗菌素及疫苗研发奠定基础,对鱼类疾病的防治具有一定的指导意义。
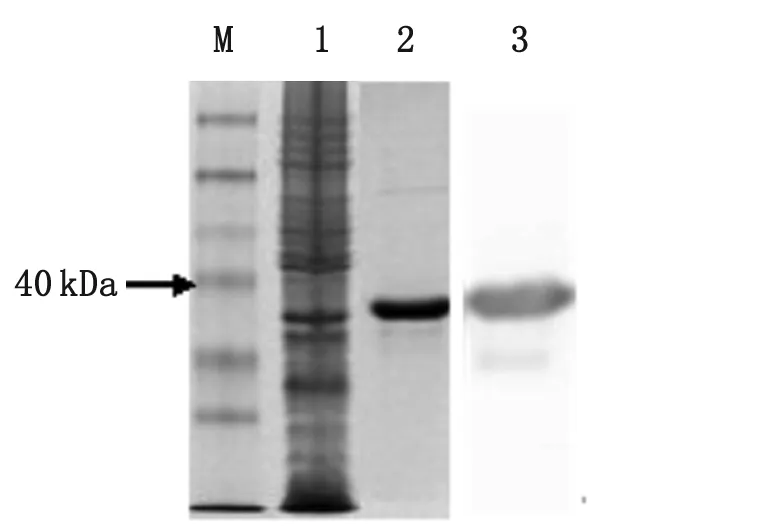
M:蛋白Marker(14-100kDa);1:全菌蛋白;2:纯化后的包涵体3:纯化后蛋白Western-blot

M:蛋白Marker;1:阴性对照;2:重组鞭毛蛋白FlaB;3:天然鞭毛蛋白
[1]McCoy AJ, Koizumi Y, Toma C, et al. Cytotoxins of the human pathogen Aeromonas hydrophila trigger, via the NLRP3 inflammasome, caspase-1 activation in macrophages[J]. Euro J Immunol, 2010, 40(10): 2797-2803.DOI: 10.1002/eji.201040490
[2]Huizinga HW, Esch GW, Hazen TC. Histopathology of red-sore diseaseAeromonashydrophilain naturally and experimentally infected largemouth bassMicropterussalmoides(Lacepede)[J]. J Fish Dis, 1979, 2(4): 263-277.DOI: 10.1111/j.1365-2761.1979.tb00169.X
[3]Kirov SM. The public health significance ofAeromonasspp. in foods[J]. Int J Food Microbiol, 1993, 20(4): 179-198. DOI: 10.1016/0168-1605(93) 90164-C
[4]Kirov SM. Bacteria that express lateral flagella enable dissection of the multifunctional roles of flagella in pathogenesis[J]. FEMS Microbiol Lett, 2003, 224(2): 151-159.DOI: 10.1016/S0378-1097(03)00445-2
[5]Janda JM, Duffey PS.Mesophilicaeromonadsin human disease: current taxonomy, laboratory identification, and infectious disease spectrum[J]. Rev Infect Dis, 1988, 10(5): 980-997.DOI:10.1093/clinids/10.5.980
[6]Dai ZJ, Yang GM. Molecular structure and assembly mechanism of bacterial adhesin[J]. Progr Microbiol Immunol, 2001, 29(3): 55-59. DOI:10.3969/j.issn.1005-5673 戴卓捷, 杨光明. 细菌粘附素的分子结构和装配机制[J]. 微生物学免疫学进展, 2001, 29(3): 55-59.DOI:10.3969/j.issn.1005-5673(in Chinese)
[7]Merino S, Rubires X, Aguilar A, et al. The role of flagella and motility in the adherence and invasion to fish cell lines by Aeromonas hydrophila serogroup O∶34 strains[J]. FEMS Microbiol Lett, 1997, 151(2): 213-217. DOI: 10.1111/j.1574-6968
[8]Thornley JP, Shaw JG, Gryllos IA, et al. Adherence ofAeromonascaviaeto human cell lines Hep-2 and Caco-2[J]. J Med Microbiol, 1996, 45(6): 445-451. DOI: 10.1099/00222615-45-6-445
[9]Aldridge P, Hughes KT. Regulation of flagellar assembly[J]. Curr Opin Microbiol, 2002, 5(2): 160-165. DOI: 10.1016/S1369-5274(02)00302-8
[10]Chilcott GS, Hughes KT. Coupling of flagellar gene expression to flagellar assembly inSalmonellaentericaserovar typhimurium andEscherichiacoli[J]. Micro Biol Mol, 2000, 64(4): 694-708. DOI: 10.1128/MMBR.64.4.694-708.2000
[11]Minamino T, Imada K, Namba K. Molecular motors of the bacterial flagella[J]. Curr Opin Struct Biol, 2008, 18(6): 693-701. DOI: 10.1016/j.sbi.2008.09.006
[12]Rijkers GT, Frederix-Wolters EM, Van Muiswinkel WB. The immune system of cyprinid fish. Kinetics and temperature dependence of antibody-producing cells in carp[J]. Immunology, 1980, 41(1): 91. DOI: 10.1016/0165-2427(81)90029-5
[13]Ross AJ, Klontz GW. Oral immunization of rainbow trout against an etiologic agent of "Redmouth Disease"[J]. J Fisheries, 1965, 22(3): 713-719. DOI: 10.1139/f65-063
Cloning, expression and antigenicity analysis of recombinantAeromonashydrophilaflagellar FlaB protein
SHEN Xue-fei,ZHAI Xin-xin,WEN Zhen-cai,SUN Zhen,LU Qiang
(KeyLaboratoryforZoonosis,MinistryofEducation,InstituteofZoonosis,JilinUniversity,Changchun130062,China)
We expressed flagellar FlaB protein ofAeromonashydrophilainE.coliand analyzed its immunogenicity. In this study, the flagellar geneflaBofAeromonashydrophilawas amplified by PCR from theAeromonashydrophilagenome, and cloned into the prokaryotic expression vector pET30a. After being sequenced, the recombinant plasmid pET30a-flaBwas transformed into strain BL21 (DE3), and FlaB protein was expressed by the recombinant strain after IPTG induction. By SDS-PAGE and electrophoresis elution purification, the purificated recombinant protein was inoculated to New Zealand rabbits. The full-length ofAeromonashydrophilaFlaB flagellin genes was 912 bp, which encodes 303 amino acids. The molecular weight of the induced protein was about 32 kDa as expected. Our result showed that the rabbit antibodies raised against the recombinant could recognize the natural flagellin and the recombinant protein, suggesting flagellin FlaB may be an important protective antigen ofAeromonashydrophilaand has potential for a novel target for vaccine development.
Aeromonashydrophila; flagellar; protein
Lu Qiang, Email: qlu@jlu.edu.cn
10.3969/cjz.j.issn.1002-2694.2015.03.002
国家自然科学基金项目(30972277);吉林大学基本科研业务费项目(200903250)
卢强, Email: qlu@jlu.edu.cn
吉林大学人兽共患病研究所,长春 130062;
R378.3
A
1002-2694(2015)03-0199-04
Supported by the National Science Foundation of China(30972277);the Fundamental Research of Jilin University(200903250)
2014-05-20;
2014-07-31
