生姜多糖的提取及抗氧化作用研究
2024-06-23孟宪伟罗亮孙源赵志刚王世会张瑞郭坤
孟宪伟 罗亮 孙源 赵志刚 王世会 张瑞 郭坤
摘要 采用超声辅助提取法从生姜中提取多糖,采用单因素和正交试验对生姜多糖提取工艺进行优化,结果发现:生姜多糖最佳提取工艺为液料比1∶20,匀浆时间5 min,匀浆温度70 ℃,超声时间80 min为宜,超声温度80 ℃,超声波功率为100 W,在该条件下多糖得率为12.56%。抗氧化活性测定结果表明,生姜多糖在5 mg/mL时对羟基自由基的清除能力可达到90.96%,且还原力最强。
关键词 生姜多糖;提取;结构表征;抗氧化作用
中图分类号 R284 文献标识码 A 文章编号 0517-6611(2024)11-0149-05
doi:10.3969/j.issn.0517-6611.2024.11.032
Study on Extraction and Antioxidant Effect of Polysaccharide from Zingiber officinale Roscoe
MENG Xian-wei1,2, LUO Liang2, SUN Yuan1 et al
(1. Research Center of Pharmaceutical Engineering, Harbin University of Commerce, Harbin, Heilongjiang 150076;2.Heilongjiang River Fisheries Research Institute, Chinese Academy of Fishery Sciences, Harbin, Heilongjiang 150070)
Abstract Ultrasonic assisted extraction method was used to extract polysaccharide from Zingiber officinale Roscoe. First, single factor and orthogonal test were used to optimize the extraction process of Zingiber officinale Roscoe polysaccharide. The experimental results showed that the optimal extraction process of Zingiber officinale Roscoe polysaccharide was as follows: liquid to material ratio 1∶20, homogenization time 5 min, homogenization temperature 70 ℃, ultrasonic time 80 min and ultrasonic temperature 80 ℃. Under the condition of ultrasonic power of 100 W, the yield of polysaccharide was 12.56%. Then, the antioxidant activity of the extracted Zingiber officinale Roscoe polysaccharide was determined. The experimental results showed that the hydroxyl radical scavenging ability of Zingiber officinale Roscoe polysaccharide reached 90.96% at 5 mg/mL, and the reducing power was the strongest.
Key words Zingiber officinale Roscoe polysaccharide;Extraction;Structural characterization;Antioxidation
基金项目 哈尔滨商业大学青年学术骨干支持计划项目(2020CX10);黑龙江省省属高等学校基本科研业务费科研项目(2023-KYYWF-1036);黑龙江省博士后科研启动金项目(BS0062)。
作者简介 孟宪伟(1993—),女,黑龙江鹤岗人,硕士研究生,研究方向:中药提取分离及活性。*通信作者,助理研究员,博士,从事环境微生物学研究。
收稿日期 2023-06-20;修回日期 2023-08-02
生姜(Zingiber officinale Roscoe)为多年生草本植物的新鲜根茎,作为传统药用和食用植物被人们广泛熟知,也是属于有价值的烹饪香料之一,具有广泛的应用前景。生姜包含多种化学成分,如黄酮、二苯基庚烷类化合物、姜黄素、姜辣素、姜精油、多糖等[1-2]。研究表明,生姜具有广泛的生物活性,如抗氧化[3]、抗炎[4]、抗菌[5]、抗肿瘤[6]、免疫调节[7]、降血脂血糖[8]、调节肠道菌群[9]等药理活性。多糖作为生姜活性化学成分之一,具有较高的研究价值。生姜多糖可通过调节肠道菌群,降低糖尿病小鼠的血糖[10],对脑缺血再灌注损伤具有保护作用[11],抑制癌细胞生长通过诱导其凋亡起到抗肿瘤作用[12-13]。生姜多糖还具有抗氧化[14-15],免疫调节[16-17],抗凝血[18],抗疲劳[19]等生物活性功能。但目前关于生姜的研究大多集中在黄酮类[20-21]、姜辣素[22-23]、姜精油[24]等化学成分上,对从生姜中提取多糖的研究较少,限制了其进一步的开发应用。笔者采用湿法匀浆协同超声波提取生姜多糖,先将生姜进行湿法匀浆,采用超声辅助提取法得到多糖,通过匀浆快速提取使有效成分溶出,再通过超声提取时超声波产生的振动作用使有效成分进一步释放、扩散和溶解,可以缩短提取时间,增加提取效率。在单因素试验的基础上,通过正交提取法得到最佳工艺,并测定其抗氧化活性作用,以期为生姜多糖的进一步开发应用提供参考依据。
1 材料与方法
1.1 试验材料
生姜(市售);实验室水为蒸馏水;氯仿、正丁醇、葡萄糖、苯酚、硫酸、无水乙醇、硫酸亚铁、水杨酸、30%过氧化氢、铁氰化钾、三氯乙酸、三氯化铁,以上均为分析纯。
1.2 仪器与设备
数控超声仪,购自宁波新芝生物科技股份有限公司;电子分光光度计,购自屹谱仪器制造(上海)有限公司;电子天平,购自上海力辰邦西仪器科技有限公司;冷冻干燥机,购自北京博医康实验仪器有限公司;高速冷冻离心机,购自安徽嘉文仪器装备有限公司。
1.3 生姜多糖提取工艺
清洗→切片→烘干→精密称取干品→匀浆→超声提取→离心→浓缩→醇沉→冷冻干燥→测定提取率。
1.4 单因素试验
1.4.1 液料比对生姜多糖得率的影响。
取生姜干品3份,在匀浆温度70 ℃下匀浆5 min,在超声温度70 ℃下超声80 min,超声功率设置在100 W条件下,考察液料比分别为1∶15、1∶20、1∶25、1∶30、1∶35(g/mL)时对生姜多糖得率的影响。
1.4.2 匀浆温度对生姜多糖得率的影响。
取生姜干品3份,液料比1∶25,匀浆5 min,在超声温度70 ℃下超声80 min,超声功率设置在100 W条件下,考察匀浆温度分别为 50、60、70、80、90 ℃时对生姜多糖得率的影响。
1.4.3 匀浆时间对生姜多糖得率的影响。
取生姜干品3份,液料比1∶25,匀浆温度70 ℃,在超声温度70 ℃下超声80 min,超声功率设置在100 W条件下,考察匀浆时间分别为 3、4、5、6、7 min时对生姜多糖得率的影响。
1.4.4 超声时间对生姜多糖得率的影响。
取生姜干品3份,液料比1∶25,匀浆温度70 ℃下匀浆5 min,超声温度70 ℃,超声功率设置在100 W条件下,考察超声时间分别为60、70、80、90、100 min时对生姜多糖得率的影响。
1.4.5 超声温度对生姜多糖得率的影响。
取生姜干品3份,液料比1∶25,在匀浆温度70 ℃下匀浆5 min,超声时间80 min,超声功率设置在100 W条件下,考察超声温度分别为40、50、60、70、80 ℃时对生姜多糖得率的影响。
1.4.6 超声功率对生姜多糖得率的影响。
取生姜干品3份,液料比1∶25,在匀浆温度70 ℃下匀浆5 min,在超声温度70 ℃下超声80 min条件下,考察超声功率分别为60、70、80、90、100 W时对生姜多糖得率的影响。提取率下式计算:
多糖得率(%)=提取的多糖质量/原料质量×100%
1.5 生姜多糖正交优化试验
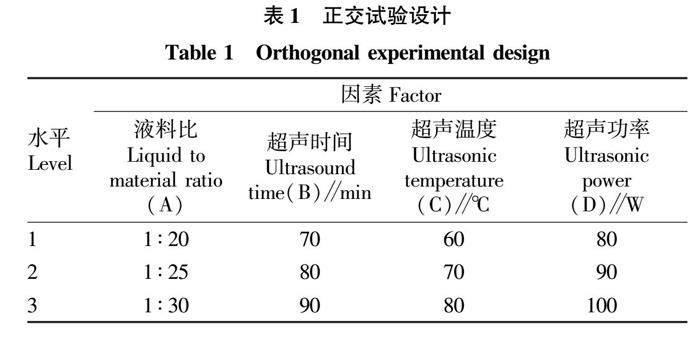
根据单因素考察结果,选取显著的影响因素,采用 L9(34)正交试验,每组试验平行3次,取生姜多糖提取率平均值进行极差分析(表1)。
1.6 生姜多糖纯化
将上述所得多糖溶于水,加入1/3体积Sevag试剂(氯仿∶正丁醇=4∶1,现用现配),剧烈振荡20 min,充分静止,除去有机相及蛋白与有机溶剂产生的蛋白变性物质,收集上层水相溶液,重复2~5次直至无蛋白析出。将脱蛋白后的溶液进行活性炭粉末脱色,3 500 Da透析袋进行透析,将得到的溶液加入4倍量无水乙醇4 ℃静置24 h,离心(4 000 r/min)10 min,弃去上清液取沉淀,干燥得生姜多糖粉末。
1.7 生姜多糖含量测定
1.7.1 葡萄糖标准曲线绘制。
生姜多糖含量测定采用苯酚硫酸法,精密称取葡萄糖干燥恒重,配制葡萄糖对照品溶液(0.1 mg/mL),分别吸取0.2、0.4、0.6、0.8、1.0、1.2、1.4 mL,用蒸馏水补至2.0 mL,依次加入1.0 mL 5%苯酚溶液和5.0 mL浓硫酸,充分涡旋混匀,冷却至室温。用2 mL蒸馏水代替对照品溶液,作空白对照,按上述方法操作。在490 nm波长处测定溶液的吸光度,纵坐标为吸光度,横坐标为葡萄糖浓度(mg/mL),绘制标准曲线,得到回归方程y=6.403 6x-0.042 0,R2=0.999 1。
1.7.2 生姜多糖含量计算。
按“1.7.1”中的方法测定吸光度,根据标准曲线并计算供试液中葡萄糖的含量,按如下公式计算多糖含量:
D=(C×V×B)×0.9/M×100%
式中:C为测得吸光度对应的浓度,mg/mL;
V为提取液体积,mL;
B为稀释倍数;
0.9为葡萄糖换算成多糖正交系数;
M为原料质量,mg。
1.8 生姜多糖体外抗氧化作用研究
1.8.1 羟自由基清除能力测定。
参照王振斌等[25]的方法并加以修改进行测定,吸取2.0 mL不同浓度生姜多糖溶液(1、2、3、4、5 mg/mL)依次加入FeSO4溶液(6 mmol/L)2.0 mL,水杨酸溶液(6 mmol/L)2.0 mL和过氧化氢溶液(6 mmol/L)2.0 mL,放置在37 ℃水浴锅中30 min,在510 nm 处测定其吸光度(A1)。按上述同样方法操作,用双蒸水替代水杨酸溶液测定空白组吸光度(A0),用双蒸水替代生姜多糖溶液测定空白对照组吸光度(A2)。按下列公式计算生姜多糖对羟自由基的清除率。
清除率%=[1-(A1-A2)/A0]×100%
1.8.2 还原力测定。
参照王振斌等[25]的方法并加以修改进行测定,吸取1.0 mL不同浓度生姜多糖溶液(1、2、3、4、5 mg/mL),依次加入2.5 mL pH为6.6的磷酸缓冲液(0.2 mol/L),1%铁氰化钾溶液2.5 mL,50 ℃水浴20 min后,加入10%三氯乙酸2.5 mL,离心(3 000 r/min)10 min。取上清液2.5 mL,加入去离子水2.5 mL,0.1%三氯化铁溶液0.5 mL,室温下放置10 min等待反应,在700 nm处测定吸光值。
1.9 数据处理
采用SPSS 19.0软件进行数据处理,GraphPad PrismV 9.0软件绘图。试验数据重复测定3次,数据以平均值±标准偏差表示。
2 结果与分析
2.1 生姜多糖单因素试验结果
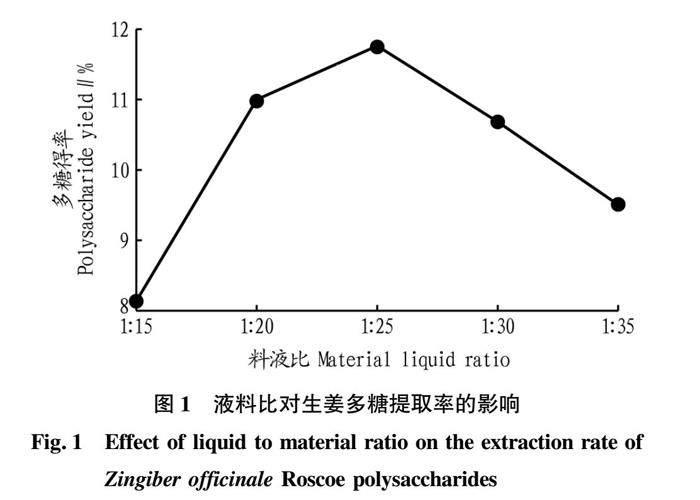
2.1.1 液料比对生姜多糖提取的影响。
从图1可知,液料比在1∶15~1∶25时,多糖的提取率呈上升趋势,在1∶25时,多糖的提取率达到11.75%,但随着液料比继续增大,多糖的提取率呈下降趋势。
2.1.2 匀浆时间对生姜多糖提取的影响。
从图2可知,随着生姜匀浆时间延长,生姜多糖的提取率呈先增大后降低趋势,匀浆时间5 min时,提取率可达到10.94%,但随着匀浆时间继续延长时,提取率降低,说明随着匀浆时间的延长,多糖的溶出率增大,同时除多糖以外的物质溶出,从而降低多糖提取率。
2.1.3 匀浆温度对生姜多糖提取的影响。
由图3可知,随着匀浆温度升高,生姜多糖提取率呈先增大后降低的趋势,匀浆温度在70 ℃时,提取率为11.29%,当匀浆温度超过70 ℃时,多糖提取率也随之降低。这说明温度升高加快分子效应,加剧生姜的细胞壁破坏,促使多糖释放,但温度过高破坏多糖的结构,不利于多糖溶出,降低提取率。
2.1.4 超声时间对生姜多糖提取的影响。
从图4可知,在超声时间为80 min时,多糖提取率最大,达12.22%,但随着超声时间的延长,提取率降低。这说明延长超声时间,多糖可以更好地溶入提取溶剂中,促进多糖从生姜细胞壁中溶出,但是时间过长会促使多糖降解,降低提取率。
2.1.5 超声温度对生姜多糖提取的影响。
从图5可知,超声温度升高,生姜多糖提取率逐渐增大,超声温度在80 ℃时,生姜多糖提取率为12.45%。可见,较高温度有利于多糖浓度提高。
2.1.6 超声功率对生姜多糖提取的影响。
从图6可知,超声功率增大时,多糖的提取率逐渐增大,在100 W时,多糖提取率达到11.25%。
2.2 正交试验结果
由表2的正交试验结果可知,超声功率(D)对生姜多糖提取的影响最大,其次依次是液料比(A)、超声时间(B)、超声温度(C)。提取工艺最佳组合为A1B3C1D1,各因素对生姜多糖提取率的影响表现为D>A>B>C。
2.3 验证试验
对生姜多糖的最佳提取工艺进行验证,并根据实际试验和仪器条件,得到最佳提取条件为料液比1∶20,匀浆时间5 min,匀浆温度70 ℃,超声时间80 min,超声温度80 ℃,超声功率为100 W,称取3份2 g生姜多糖粉末,在最优工艺条件下试验,测得生姜多糖平均含量为43.62%,说明该工艺组合较稳定,可行性高。
2.4 生姜多糖体外抗氧化试验结果
2.4.1 羟自由基清除能力。
由图7可知,生姜多糖浓度在1~5 mg/mL,随着多糖浓度增加,生姜多糖羟自由基清除能力逐渐增强,清除率从38.05%升高到90.96%,说明生姜多糖对羟自由基具有清除作用。但与VC相比,生姜多糖对羟自由基的清除能力仍有较大差距。
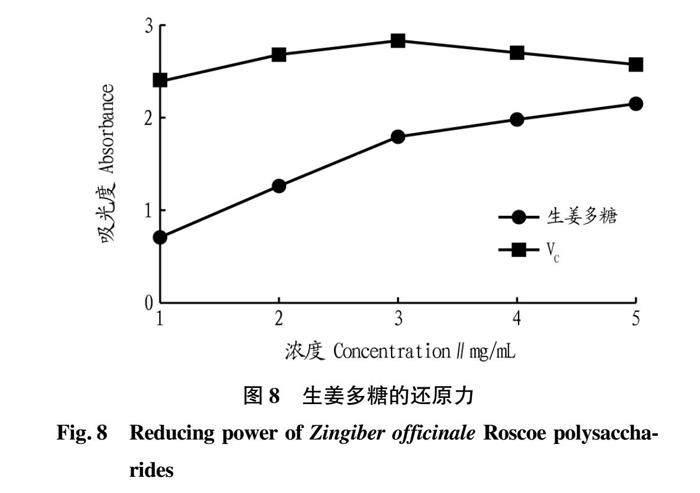
2.4.2 还原力。
从图8可知,随着生姜多糖浓度的升高,还原力逐渐升高,在5 mg/mL时,吸光度可达到2.155,但还原力仍弱于VC,VC在5 mg/mL时可达到2.565。
3 结论与讨论
目前,生姜多糖的提取工艺主要有传统水提法[26]、碱液提取法[27]、酶提取法[28]、超声辅助提取法[29]、微波提取法[30]、超声细胞研磨机提取[31]。该试验在单因素和正交试验提取生姜多糖工艺中,生姜多糖最佳提取工艺条件为液料比在1∶20,匀浆时间5 min,匀浆温度70 ℃,超声80 min,超声温度在80 ℃,超声功率100 W,在该条件下生姜多糖得率为12.56%,生姜多糖含量为43.62%。相较于林敏等[32]采用超声提取法和赵文竹等[33]采用传统方法热水提取法,将生姜多糖进行湿法打浆后超声辅助提取,可以大大提高生姜多糖提取率,进一步优化提取条件,有利于今后生姜多糖的应用和发展。
机体一直与外界接触,因辐射、紫外线、环境污染、化学药物滥用和情绪问题等因素[34],使机体内存在过量的自由基,产生癌症、糖尿病、衰老、老年痴呆症、帕金森病以及炎症等疾病[35-38]。近年来,研究人员发现,天然化合产物有很好的抗氧化,可去除过量自由基,具有广泛的应用前景。中药多糖作为抗氧化剂,是目前的研究热点之一,多糖具有天然、无毒副作用等优点,有着较好的抗氧化作用[39-41]。该研究发现,随着生姜多糖浓度的增加,对羟自由基活性清除能力和还原力增强,生姜多糖具有较好的抗氧化作用。生姜多糖作为一种天然抗氧化剂,应用于食品、水产动物饲料添加剂、保健品等方面,具有很好的开发价值。该研究为生姜多糖的后续研究提供理论依据,其结构特征、化学成分、生物活性作用机制还需进一步研究。
参考文献
[1] 强姝婷,国慧,熊浩荣,等.生姜多类型化学物质与药理作用及药食同源研究进展[J].江苏农业学报,2021,37(1):259-266.
[2] 赵文竹,张瑞雪,于志鹏,等.生姜的化学成分及生物活性研究进展[J].食品工业科技,2016,37(11):383-389.
[3] ZHOU X,POWER D,JONES A,et al.Antioxidant profiling of ginger via reaction flow chromatography[J].Natural product communications,2021,16(9):1-6.
[4] WU M D,CHENG M J,CHEN M H,et al.Active constituents isolated from Zingiber zerumbet with anti-arthritis activity[J].Chemistry of natural compounds,2022,58(5):918-922.
[5] SAMUEL-PENU B,BARIDAKARA S C.Anti-microbial activities of turmeric and ginger on bacterial isolates of normal skin flora[J].Journal of advances in microbiology,2021,21(3):59-62.
[6] MATHUR S,PAREEK S,VERMA R,et al.Therapeutic potential of ginger bio-active compounds in gastrointestinal cancer therapy:The molecular mechanism[J].Nutrire,2022,47(2):1-17.
[7] NALIATO R F,CARVALHO P L P F,VICENTE I S T,et al.Ginger(Zingiber officinale)powder improves growth performance and immune response but shows limited antioxidant capacity for Nile tilapia infected with Aeromonas hydrophila[J].Aquaculture nutrition,2021,27(3):850-864.
[8] VEISI P,ZAREZADE M,ROSTAMKHANI H,et al.Renoprotective effects of the ginger(Zingiber officinale)on Diabetic kidney disease,current knowledge and future direction:A systematic review of animal studies[J].BMC complementary medicine and therapies,2022,22(1):1-15.
[9] WAN Y,YANG L,LI H,et al.Zingiber officinale and Panax ginseng ameliorate ulcerative colitis in mice via modulating gut microbiota and its metabolites[J].Journal of chromatography B,2022,1203:1-15.
[10] 汪妮,陈梦霞,孟凡强,等.生姜多糖的提取及其对糖尿病小鼠肠道菌群的调节作用[J].食品工业科技,2023,44(4):278-286.
[11] 宋琳琳,沙靖全,张磊,等.生姜粗多糖的提取及对脑缺血再灌注损伤大鼠的保护作用[J].辽宁中医杂志,2015,42(12):2433-2435.
[12] WANG Y,WANG S X,SONG R Z,et al.Ginger polysaccharides induced cell cycle arrest and apoptosis in human hepatocellular carcinoma HepG2 cells[J].International journal of biological macromolecules,2019,123:81-90.
[13] QIAN Y F,SHI C Y,CHENG C,et al.Ginger polysaccharide UGP1 suppressed human colon cancer growth via p53,Bax/Bcl-2,caspase-3 pathways and immunomodulation[J].Food science and human wellness,2023,12(2):467-476.
[14] WANG Y,WEI X L,WANG F H,et al.Structural characterization and antioxidant activity of polysaccharide from ginger[J].International journal of biological macromolecules,2018,111:862-869.
[15] ZHANG Z S,WANG X M,ZHANG J J,et al.Potential antioxidant activities in vitro of polysaccharides extracted from ginger(Zingiber officinale)[J].Carbohydrate polymers,2011,86(2):448-452.
[16] YANG X H,WEI S Q,LU X M,et al.A neutral polysaccharide with a triple helix structure from ginger:Characterization and immunomodulatory activity[J].Food chemistry,2021,350:1-10.
[17] HOU M D,GAO J,LIU Z Q,et al.Antioxidant and immunomodulatory activities in vitro of a neutral polysaccharide from ginger(Zingiber officinale)[J].Starch-Strke,2021,73(9/10):1-11.
[18] WANG C,HE Y,TANG X,et al.Sulfation,structural analysis,and anticoagulant bioactivity of ginger polysaccharides[J].Journal of food science,2020,85(8):2427-2434.
[19] 夏树林,吴庆松.生姜多糖的提取及其抗疲劳作用[J].江苏农业科学,2014,42(4):240-242.
[20] 卢仲铖,王宇,张佳悦,等.生姜中有效成分的粗提取及提取物抑菌活性研究[J].辽宁科技学院学报,2022,24(5):30-34.
[21] 孙晓玲.纤维素酶-乙醇结合法提取生姜总黄酮的工艺研究[J].中国调味品,2018,43(11):113-117,125.
[22] XU T T,TAO M F,LI R,et al.Longevity-promoting properties of ginger extract in Caenorhabditis elegans via the insulin/IGF-1 signaling pathway[J].Food & function,2022,13(19):9893-9903.
[23] 王丽媛,周宁,宁月宝.超临界萃取黑姜姜辣素GC-MS分析及降血糖活性研究[J].中国调味品,2022,47(12):19-21,31.
[24] ZHANG S L,ZHANG L J,YU M J,et al.Essential oils of Zingiber officinale:Chemical composition,in vivo alleviation effects on TPA induced ear swelling in mice and in vitro bioactivities[J].Frontiers in nutrition,2022,9:1-14.
[25] 王振斌,孙亚钊,郭强.超声波对无花果多糖抗氧化活性的影响[J].食品工业科技,2013,34(3):97-99,103.
[26] 孔得福,吕凤娇.响应面法优化生姜多糖的提取工艺研究[J].海峡药学,2016,28(2):32-36.
[27] CHEN X H,CHEN G J,WANG Z R,et al.A comparison of a polysaccharide extracted from ginger(Zingiber officinale)stems and leaves using different methods:Preparation,structure characteristics,and biological activities[J].International journal of biological macromolecules,2020,151:635-649.
[28] 马利华,秦卫东,贺菊萍,等.复合酶法提取生姜多糖[J].食品科学,2008,29(8):369-371.
[29] 刘全德,唐仕荣,王卫东,等.响应曲面法优化超声波-微波协同萃取生姜多糖工艺[J].食品科学,2010,31(18):124-128.
[30] 王颖,曾霞,周天,等.响应面法优化微波提取生姜多糖的工艺[J].食品研究与开发,2015,36(13):58-61.
[31] LIAO D W,CHENG C,LIU J P,et al.Characterization and antitumor activities of polysaccharides obtained from ginger(Zingiber officinale)by different extraction methods[J].International journal of biological macromolecules,2020,152:894-903.
[32] 林敏,安红钢,吴冬青.响应面分析法优化超声提取生姜多糖的工艺[J].食品研究与开发,2013,34(10):42-44.
[33] 赵文竹,王欣珂,于志鹏,等.响应面优化生姜多糖提取工艺及其抗氧化活性研究[J].食品研究与开发,2017,38(20):31-36.
[34] CHEN X Y,SUN-WATERHOUSE D X,YAO W Z,et al.Free radical-mediated degradation of polysaccharides:Mechanism of free radical formation and degradation,influence factors and product properties[J].Food chemistry,2021,365:1-9.
[35] TONG H B,ZHENG X L,SONG J X,et al.Radical scavenging activity of sulfated Bupleurum chinense polysaccharides and their effects against oxidative stress-induced senescence[J].Carbohydrate polymers,2018,192:143-149.
[36] LIU L,SHA X Y,WU Y N,et al.Lycium barbarum polysaccharides protects retinal ganglion cells against oxidative stress injury[J].Neural regeneration research,2020,15(8):1526-1531.
[37] ARUNACHALAM K,SREEJA P S,YANG X F.The antioxidant properties of mushroom polysaccharides can potentially mitigate oxidative stress,beta-cell dysfunction and insulin resistance[J].Frontiers in pharmacology,2022,13:1-23.
[38] ZHUANG C,WANG Y J,ZHANG Y K,et al.Oxidative stress in osteoarthritis and antioxidant effect of polysaccharide from angelica sinensis[J].International journal of biological macromolecules,2018,115:281-286.
[39] ZHU Y L,YU X F,GE Q,et al.Antioxidant and anti-aging activities of polysaccharides from Cordyceps cicadae[J].International journal of biological macromolecules,2020,157:394-400.
[40] FENG S L,CHENG H R,XU Z,et al.Antioxidant and anti-aging activities and structural elucidation of polysaccharides from Panax notoginseng root[J].Process biochemistry,2019,78:189-199.
[41] WANG N N,ZHANG Y,WANG X P,et al.Antioxidant property of water-soluble polysaccharides from Poria cocos Wolf using different extraction methods[J].International journal of biological macromolecules,2016,83:103-110.
